DNA甲基化及其在结直肠癌中的研究进展
2022-08-08马晓阳江泽友
马晓阳 ,江泽友
1 自贡市第四人民医院检验科,四川自贡 643000;2 四川卫生康复职业学院;3 成都中医药大学附属医院检验科
结直肠癌是全世界第三大常见的恶性肿瘤,全球每年约有60万人死于结直肠癌[1]。结直肠癌多见于北美、欧洲等经济发达地区,与高蛋白、高脂肪、高糖及低纤维饮食密切相关。随着发展中国家的发展,预计 2035 年结直肠癌新发病例将达到 250 万[2]。在我国,由于近年来社会经济快速发展、人口老龄化、居民生活方式及饮食结构的改变,结直肠癌的发病率及病死率逐年上升,其发病人群呈年轻化趋势[3]。结直肠癌起源于结直肠黏膜上皮和腺体,根据病理特征将其发生分为经腺瘤癌变序列和锯齿状病变通路两种途径[4]。细胞内核心调控通路分子表达异常或结构异常使细胞生长代谢功能紊乱,促使正常肠黏膜转化为肠腺瘤或肠息肉,而后随着异常分子的逐渐累积发展为结直肠癌。分子异常由遗传学改变或表观遗传学改变引起,二者单独作用或相互依赖促进细胞癌变。常见的表观遗传学改变有DNA甲基化、组蛋白修饰、染色质重塑以及非编码RNA 调控。随着基因组学和表观遗传学的深入研究,DNA甲基化与肿瘤的关系成为研究热点。现就DNA甲基化在结直肠癌中的最新研究进展综述如下。
1 DNA甲基化概述
DNA 甲基化是一种共价修饰,指DNA 甲基转移酶(DNMT)将S-腺苷甲硫氨酸(SAM)提供的甲基基团 转 移 到 DNA 上 。DNMT 有 DNMT1、DNMT3a 和DNMT3b 三种。DNMT1 是一个维持性甲基转移酶,与DNA 复制过程相偶联催化子链DNA 甲基化,使之获得与亲链DNA 相同的甲基化模式。DNMT1 使基因组甲基化模式得以稳定遗传。而DNMT3a 和DNMT3b 具有从头合成甲基化活性,催化生成新的甲基化位点,在甲基化模式的建立和重构方面发挥重要作用。DNA 甲基化的逆过程,即DNA 去甲基化,并非甲基化过程的简单逆转,而是涉及多个调控过程的生物学行为。TET 是一种依赖α-酮戊二酸(2-OG)和 Fe2+的双加氧酶家族,有 TET1、TET2 和TET3 三种亚型。该家族可将5-甲基胞嘧啶(5mC)依次氧化为5-羟甲基胞嘧啶(5hmC)、5-甲酰基胞嘧啶(5fC)和5-羧基胞嘧啶(5caC)[5]。5mC、5hmC、5fC和5caC可干扰DNMT1在DNA复制过程中的甲基化维持功能,使5mC 含量在DNA 复制期间被稀释,从而导致甲基化程度降低[6]。该过程称为DNA 被动去甲基化,也称为依赖DNA 复制的去甲基化。同时,5fC 和5caC 可被胸腺嘧啶糖苷酶(TDG)切除,然后通过碱基切除修复(BER)机制使之被未甲基化的胞嘧啶取代[7]。该过程称为DNA 主动去甲基化,亦称为不依赖DNA 复制的去甲基化。研究表明,细胞中的TET 大多通过DNA 被动去甲基化使DNA 甲基化程度降低[6]。DNA甲基化是目前哺乳动物中研究最广泛和最常见的表观遗传学改变。
DNA 甲基化在调节和重编程基因表达模式中起关键作用,涉及细胞的多个生理过程如基因沉默、基因印迹、X 染色体失活以及细胞内特异性表达程序的建立和维持。DNA 甲基化通常发生在CpG 二核苷酸胞嘧啶的第5位碳原子上,形成5mC[8]。DNA碱基有A、T、G、C,二核苷酸的组成方式有16种。按照随机分配原则,CpG 的频率约为6%,然而CpG 实际频率只占预测频率的5%~10%。这是因为基因组中CpG 常处于甲基化状态(5mCpG),而5mC 稳定性差,常自发性脱氨转换为T碱基。因此,5mCpG转换为TpG(互补链上为CpA)的特征,导致CpG 的实际频率低于预测频率,TpG 和CpA 的实际频率高于预测频率。哺乳动物基因组中存在约15%的CpG 分布不均匀,成簇出现形成CpG 岛(CGI)。CGI通常位于基因的5′区域(启动子区域、非翻译区和1号外显子区),这些区域的CpG 可参与基因的转录调控过程。正常情况下,除了女性不活跃的X染色体、印迹基因以及某些仅在生殖细胞表达基因的CGI,其他区域的CGI 均处于未甲基化状态。而基因体区域(DNA 编码区和内含子区)的CpG 含量较低,呈随机散在分布,且通常处于甲基化状态。
DNA 启动子甲基化通过影响基因转录和染色体构型而调控基因的表达,主要有以下机制导致基因失活[9]:①DNA 甲基化可直接干扰转录因子与含CpG残基序列的转录因子结合位点结合。如转录因子激活蛋白2(AP-2)、环磷酸腺苷效应元件结合蛋白(CREB)、E2启动子结合因子(E2F)和核转录因子κB(NF-κB)能识别含 CpG 残基的序列。②甲基化CpG结合结构域(MBD)蛋白家族是一组含有MBD结构的序列特异性的DNA结合蛋白,靶序列为5mCpG。MBD蛋白与DNA结合后可间接阻止转录因子与启动子形成转录复合体。甲基化CpG 结合蛋白2(MeCP2)是第一个被发现的含有MBD 蛋白质,其核心是含有70个氨基酸的MBD结构。目前,已鉴定出11个含有MBD结构的蛋白质,包括MeCP2、MBD1-6、SETDB1-2、TIP5/BAZ2A 和 BAZ2B[10]。③MBD 蛋白与DNA 结合后可招募DNMT、组蛋白去乙酰化酶(HDAC)和染色质重塑因子,促进染色质的构象发生改变从而导致染色质凝缩成致密的非活性结构。
正常细胞的甲基化模式为基因组整体高甲基化和特定基因启动子区CGI 低甲基化,肿瘤细胞的甲基化模式为基因组整体低甲基化和特定基因启动子区CGI高甲基化。基因组整体低甲基化通常是由于重复性序列和基因体上的5mCpG 去甲基化导致。肿瘤细胞中DNA 甲基化既可增多亦可减少,呈现为极不稳定的状态,导致肿瘤细胞中基因启动子CGI高甲基化和基因组整体低甲基化可同时存在。
2 DNA甲基化在结直肠癌发生发展中的作用
研究表明,结直肠癌中DNA 异常甲基化频率更高且早于遗传学改变,在结直肠癌的发生发展中起重要作用[11]。在结直肠癌中,DNA 高甲基化主要影响基因启动子区的CGI,而低甲基化主要影响重复性序列。另外,与基因启动子区高度甲基化相反的是,结直肠癌中基因体呈低甲基化状态,导致基因印记丢失、有丝分裂后杂合性缺失以及染色体稳定性降低等[10-11]。见图1。
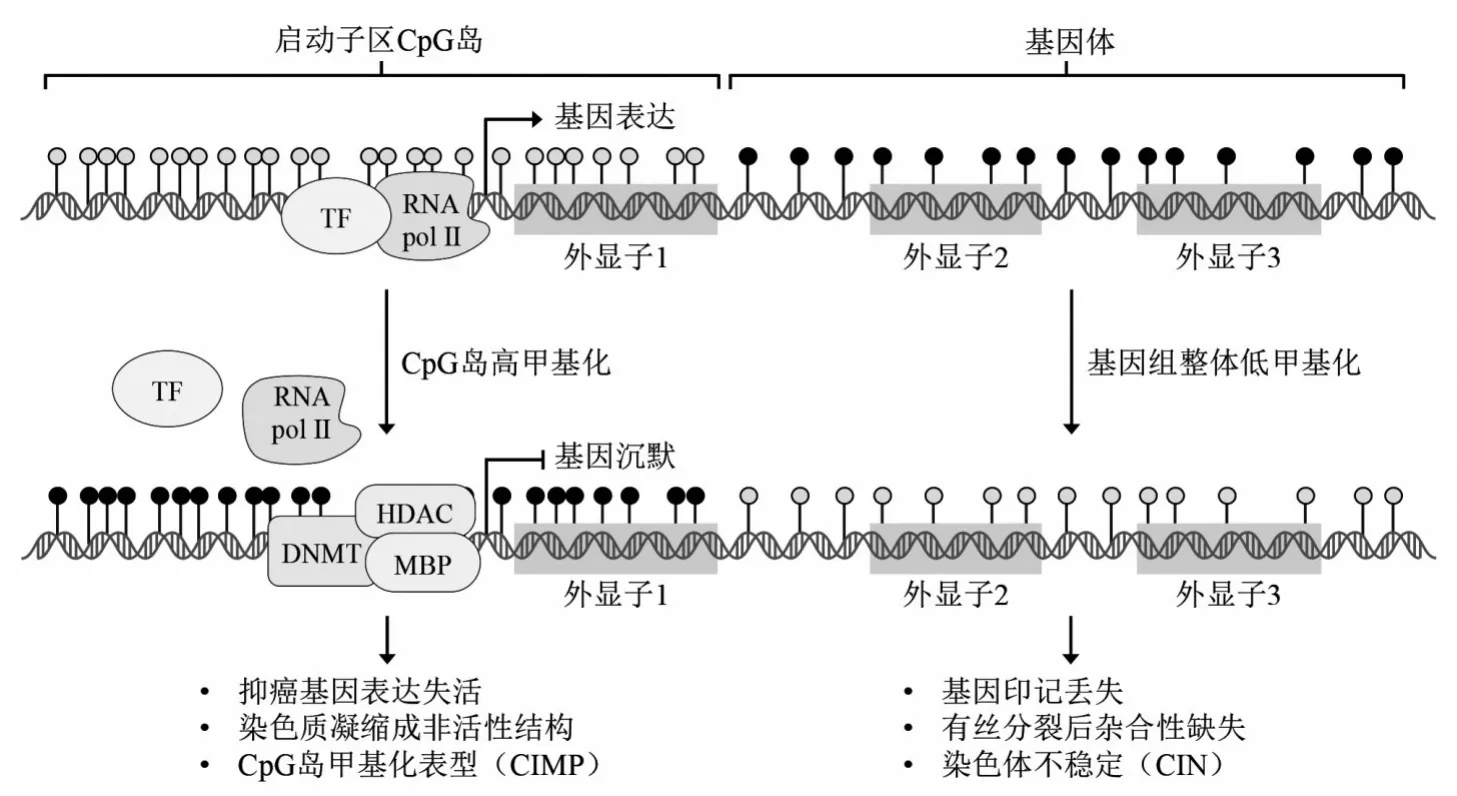
图1 结直肠癌中DNA甲基化模式变化及其功能影响
2.1 DNA 低甲基化在结直肠癌发生发展中的作用 人类肿瘤细胞基因组整体甲基化水平降低是最早发现的表观遗传学改变。后续研究证实,肿瘤细胞基因组的5mC含量比正常细胞少20%~60%,即肿瘤细胞表现为基因组整体甲基化水平降低。在正常细胞中,基因组的重复序列表现为DNA 高度甲基化,如卫星DNA、长散在重复元件(LINES)、短散在重复元件(SINES)等重复多拷贝序列。哺乳动物基因组中约80%的CpG 位于重复序列且呈散在分布,因此肿瘤细胞基因组整体低甲基化大部分是由于重复序列的5mCpG 去甲基化所致。基因启动子区域外的DNA 低甲基化可诱导细胞癌变,DNMT 抑制实验、DNMT 缺陷实验以及乏甲基膳食喂养实验均证实DNA 低甲基化可导致基因组不稳定而促进细胞发生恶变。
在结直肠癌中,DNA 低甲基化主要发生在长分散核苷酸元件1(LINE1)。LINE1 占人类基因组的17%,含大量CpG 位点,是研究最广泛的肿瘤相关去甲基化区域。在正常细胞中,LINE1处于沉默状态,且甲基化是沉默的主要机制。结直肠癌中LINE1常处于去甲基化状态,导致其表达升高。LINE1 表达升高使其频繁穿插于基因组,导致基因组“重编程”及稳定性降低,从而促进肿瘤的发生发展。DNA 去甲基化在结直肠癌中随着细胞恶变程度递增而递增,如结直肠腺瘤、结直肠癌及转移瘤中均存在基因组整体低甲基化,且去甲基化的程度依次递增。此外,LINE1 甲基化水平是细胞内5mC 含量的准确指标,可反映基因组整体甲基化水平。与抑癌基因启动子区高甲基化相对应的是,DNA 低甲基化也可发生于原癌基因启动子区域。原癌基因启动子区低甲基化可通过激活原癌基因表达,促进细胞发生癌变。LUO 等[12]研究表明,结直肠癌细胞存在原癌基因MYC 和HRAS 启动子区低甲基化,经SAM 处理使MYC 和HRAS 基因启动子区重新甲基化,可显著减弱结直肠癌细胞的生长增殖能力。尽管结直肠癌中存在原癌基因启动子DNA 异常低甲基化,但更多的研究证明结直肠癌中特定基因启动子区主要表现为异常高甲基化,这些异常高甲基化的基因也被称为假定肿瘤抑制基因。
2.2 DNA 高甲基化在结直肠癌发生发展中的作用 人肺癌和淋巴瘤中降钙素基因(CALCA)特异性位点高度甲基化是最早报道的高甲基化基因。之后,DNA 高度甲基化成为肿瘤领域的研究热点。结直肠癌中存在数百个高度甲基化的CGI,这些CGI多位于基因启动子区域,导致相关基因表达失活。从分子生物学的角度,结直肠癌分为微卫星不稳定性(MSI)、染色体不稳定性(CIN)以及CGI 甲基化表型(CIMP)三个亚类[13]。CIMP 表现为多个抑癌基因启动子呈高度甲基化状态。高甲基化诱导沉默的基因几乎涉及到细胞网络中的所有信号通路,包括DNA修复、细胞周期以及细胞增殖等。
MSI 约占结直肠癌的15%,是DNA 错配修复(MMR)蛋白缺失所致。其中,3%的MSI 为遗传性非息肉病性结直肠癌(Lynch 综合征),是生殖细胞中 MLH1、MSH2、MSH6、PMS2 等 MMR 基因突变引起的一种家族性遗传性疾病;12%为散发性结直肠癌,是体细胞中MLH1 基因启动子获得性高甲基化所致[14]。临床上,Lynch综合征的诊断策略为MSI分析和MMR蛋白的免疫组化检测。对于MMR表达缺失的结直肠癌患者,再通过检测MLH1 基因启动子是否高度甲基化来区分Lynch 综合征和散发性结直肠癌。O6-甲基鸟嘌呤-DNA 甲基转移酶(MGMT)是一种DNA 损伤修复基因,其编码蛋白可以抵御细胞突变和烷基化剂的毒性。MGMT基因启动子区高度甲基化在包括结直肠癌的多种人类肿瘤中被发现,其高甲基化可阻止鸟嘌呤O6位甲基基团的清除,且与 KRAS 和 TP53 基因的 G>A 突变相关。此外,在结直肠癌患者的前体病变组织及非恶性肠粘膜中也检测到了MGMT 基因启动子区高甲基化,推测MGMT表观遗传失活是良性锯齿状息肉转化为恶性结直肠癌的重要事件。
细胞周期蛋白依赖的激酶抑制剂2A(CDKN2A)是一种细胞周期调控基因,在G1/S 期转换中起负调节作用。CDKN2A 位于染色体9p21.3,共有8 个外显子,通过可变阅读框编码P14ARF 和P16INK4α两种蛋白质,二者都是细胞内重要的抑癌蛋白。在结直肠癌中,CDKN2A 基因通常通过启动子高度甲基化使之表达缺失。研究表明,CDKN2A基因启动子区高度甲基化在结直肠腺瘤和异常隐窝病灶中均被检测到,是结直肠癌发生的早期事件。KIM 等[15]研究表明,11.9%(34/285)的结直肠癌患者存在CDKN2A 基因启动子区高度甲基化。另外,在微卫星稳定(MSS)和微卫星低不稳定(MSI-L)结直肠癌患者中有10.6%(28/264)表现为CDKN2A高甲基化,而在MSI 患者中有28.6%(6/21)表现CDKN2A 高甲基化,差异有统计学意义[15]。因此,CDKN2A 基因启动子甲基化的发生与MSI 间可能存在潜在关联。
腺瘤性结肠息肉病(APC)基因是细胞内最重要的抑癌基因之一,该基因是Wnt信号通路的拮抗剂。Wnt信号通路是细胞正常生理活动中最重要的信号通路之一,其过度活化可诱导MYC、细胞周期蛋白D1 和其他下游基因的表达,促进细胞增殖,驱动细胞癌变[16]。APC表达缺失是结直肠癌发生的早期事件,APC 蛋白的缺乏可促使正常肠上皮转化为结直肠腺瘤。APC在生殖细胞中突变可导致家族性腺瘤性息肉病(FAP),至少90%的FAP 患者生殖细胞系存在APC 突变。FAP 是一种常染色体显性疾病,发病个体发展为数百至数千个良性结直肠腺瘤,且通常会转化为结直肠癌。APC体细胞突变可导致散发性结直肠癌,且多数结直肠癌中都存在APC 基因突变。除了突变失活,20%左右的散发性结直肠癌还存在APC 基因启动子区高度甲基化。WNT 抑制因子1(WIF1)基因编码WIF1 蛋白,可直接抑制WNT信号通路。WIF1 蛋白包含一个WNT 抑制因子(WIF)结构域和五个表皮生长因子(EGF)样结构域,是胚胎发育过程中关键的细胞外信号因子。WIF1基因作为抑癌基因,在高达82%的结直肠癌和72%的结直肠腺瘤中表达下调,且所有表达下调的组织样本均表现为WIF1 基因启动子区高度甲基化[17]。除此之外,分泌型相关卷曲蛋白基因(SFRPs)、RAS 相关结构与家族基因1A(RASSF1A)等在结直肠癌发生发展中亦发挥重要作用[18-19]。
3 DNA甲基化在结直肠癌中的临床应用
研究显示,晚期结直肠癌患者的5 年生存率不足10%,而早期患者5 年生存率90%以上[20]。传统的粪便隐血试验(FOBT)和肠镜检查筛查结直肠癌存在较大局限性[21]。DNA 异常甲基化在结直肠癌中普遍存在,数百个CGI可同时处于高甲基化状态,是肿瘤发生过程中最早的变化之一。故研究者们利用DNA 甲基化开发了结直肠癌早期无创筛查标志物,也为抗肿瘤药物的研发开启了新的方向。与遗传学改变相比,表观遗传修饰过程可逆,更适用于靶向治疗,是极具吸引力的治疗位点。
3.1 基因高甲基化作为无创筛查标志物 2014 年美国食品药品监督管理局(FDA)批准多靶点粪便DNA 筛查结直肠癌,该测试包括KRAS 基因突变、BMP3 和NDRG4 基因甲基化、粪便免疫化学检测(FIT)。2014 年 IMPERIALE 等[22]发表在《新英格兰医学杂志》的一项近万名受试者参与的随机试验研究表明,多靶点粪便DNA 和FIT 筛查结直肠癌的灵敏度分别为92% 和74%,特异度分别为87% 和95%。BOSCH 等[23]研究结果显示,多靶点粪便DNA和FIT 筛查进展期癌前病变(肠腺瘤和锯齿状息肉)的灵敏度分别为46%和27%,特异度分别为89%和93%。因此,多靶点粪便DNA 对结直肠癌的筛查效能显著优于FIT 检测,但同时也增加了假阳性风险。鉴于上述两项前瞻性研究的结果,美国预防服务工作组已将多靶点粪便DNA 纳入美国国立综合癌症网络结直肠癌筛查指南,同时建议将其纳入美国国家健康保险。2016 年FDA 再次批准Septin9 基因甲基化筛查结直肠癌,这是第一个基于血液样品检测的结直肠癌筛查方法。Septin9 编码一种GTP 结合蛋白,在细胞分裂、细胞周期、细胞凋亡、囊泡运输、细胞极性和微管系统的调控中起重要作用。Septin9基因启动子高甲基化导致蛋白表达降低,从而影响上述生理过程。YAN 等[24]使用 Meta 分析对 14 项研究的9 870例患者进行分析,结果显示血浆Septin9基因甲基化筛查结直肠癌的灵敏度为66%,特异度为91%。此外,有研究表明,多种基因启动子高甲基化可作为结直肠癌的筛查标志物,如Vimentin、GATA 结合蛋白4(GATA4)以及硫酸类肝素蛋白多糖(SDC2)基因甲基化等[25]。
3.2 基因高甲基化作为治疗靶点 DNMT 抑制剂是最常见的表观遗传药物,通过抑制DNMT 的活性发挥抗肿瘤作用。与传统的化疗方案相比,DNMT抑制剂通过重新编码基因表达过程影响多种细胞,可与其他药物协同作用,并激活机体免疫反应[26]。根据DNMT抑制剂的结构将其分为核苷类和非核苷类两大类。核苷类抑制剂在复制过程中代替胞嘧啶掺入DNA,与DNMT共价结合,竞争性抑制DNMT活性,阻断甲基化反应。常见的核苷类抑制剂有5-氮杂胞苷(阿扎胞苷)、5-氮杂-2-脱氧胞苷(地西他滨)、4-脱氧尿苷(泽布拉林)等。非核苷类药物通常是针对DNMT结构设计的特异性抑制剂或具有去甲基化功能的传统药物,如氨基苯甲酸类、茶多酚类、肼类以及邻苯二酰胺类等。FDA 已批准阿扎胞苷和地西他滨治疗骨髓异常增生综合征和白血病,但各类实体瘤中均尚未开发出相应的表观遗传治疗药物。临床前研究表明,DNMT 抑制剂用于治疗结直肠癌是可行的。DNMT 抑制剂可显著降低SW48 和HT-29 结肠癌细胞的存活率,以地西他滨与5-氟尿嘧啶或奥沙利铂协同效果最佳[27]。然而,临床实验表明,接受DNMT抑制剂药物的结直肠癌患者,尚未获得充足的生存获益证据[28]。因此,出于安全考虑,现有的DNMT 抑制剂药物均未进入Ⅱ期临床试验。目前,DNMT 抑制剂治疗结直肠癌的临床实验集中于晚期患者,晚期患者癌细胞异质性显著并积累大量遗传学和表观遗传学改变。DNA 甲基化通常发生在结直肠癌形成的早期阶段,故有研究者推测DNMT 抑制剂在结直肠癌患者的早期阶段作为辅助治疗药物可能效果更显著[17]。
综上所述,结直肠癌是一种异质性显著的复杂疾病,具有相似特征的结直肠癌有相同的发病机制和生物学行为。DNA 甲基化是结直肠癌中最常见的表观遗传学改变,在结直肠癌的发生发展中发挥重要作用。结直肠癌中存在大量抑癌基因启动子高甲基化,这些异常沉默的抑癌基因促进了结直肠的发生发展。故研究者们开发了一系列去甲基化药物,但这些药物用于治疗结直肠癌的临床试验均未成功,仍有待研发。此外,DNA 甲基化在结直肠癌中具有普遍性,研发的系列甲基化基因可用于结直肠癌的早期无创诊断。
