肺癌化疗患者并发细菌性肺部感染的病原菌特点和血清MMP-9、sTREM-1、sCD163变化情况及其诊断价值
2022-08-08张帆周勇锋辛伟
张帆 周勇锋 辛伟
(宝鸡市中医医院胸外科,陕西 宝鸡 721000)
肺癌是呼吸系统常见恶性肿瘤,目前化疗成为主要的治疗手段。随着肺癌化疗周期加长,机体免疫力逐渐低下,患者合并其他感染的发生率很高,以肺部感染为主[1]。细菌培养是确诊感染的金标准,但检验过程耗时较长。研究[2-4]发现,血红蛋白清道夫受体(sCD163)是迄今发现的最有效的体内血红蛋白清道夫受体,它可以调节炎症介质的表达;人基质金属蛋白酶-9(MMP-9)可降解细胞外基质中的胶原蛋白、多糖,在肺部感染发生、发展中起重要病理作用,导致感染加重;可溶性髓系细胞触发受体-1(sTREM-1)是免疫球蛋白受体,已被作为炎症反应的标志之一。本文主要探讨肺癌化疗患者并发细菌性肺部感染的病原菌特点和血清MMP-9、sTREM-1、sCD163变化情况及其诊断价值。
1 资料与方法
1.1一般资料 选取本院2017年1月至2019年1月收治的进行化疗的肺癌患者120例,根据其是否发生化疗后肺部细菌性感染,分为感染组(n=55)和未感染组(n=65)。。感染组中男33例,女22例;平均(65.18±6.57)岁;Ⅲ期34例,Ⅳ期21例;鳞癌18例,腺癌16例,小细胞癌21例。未感染组包括男35例,女30例;平均(64.36±6.49)岁;Ⅲ期33例,Ⅳ期32例;鳞癌21例,腺癌20例,小细胞癌24例。纳入患者均经影像学、细胞学、病理学检验等检查确诊为肺癌;均符合《医院感染诊断标准》中对放化疗术后感染的诊断标准[5];年龄≥60岁;肿瘤临床分期为Ⅲ期或Ⅳ期;接受放化疗治疗时间≥1周。已排除合并有全身感染、免疫性疾病及其他恶性肿瘤者;携带有传染病者;精神状况不好,不能配合者;纳入研究前有放化疗史。两组一般资料比较差异无统计学意义(P>0.05)。本研究经我院医学伦理委员会审核通过,患者及家属均知情同意。
1.2方法 细菌培养参照《临床检验操作规程(第四版)》相关内容进行[6]。感染组患者清晨用生理盐水清洁口腔2~3次,采用自主咳痰或诱导咳痰的方式,收集无菌操作下患者深咳出的痰液标本送检,在2 h内进行革兰染色处理,低倍镜下鳞状上皮细胞低于10个且白细胞大于25个即为合格痰标本。将筛选合格的痰标本接种于血琼脂培养基(青岛高科技工业园海博生物技术有限公司),35℃环境下培养24 h,选择疑似菌落进行革兰染色,采用ZR-1100全自动菌落计数仪及病原菌鉴定仪(深圳市聚鑫圆科技有限公司)及配套试剂对菌种进行鉴定。革兰氏阴性菌株选择ATCC25922大肠埃希菌、ATCC700603肺炎克雷伯菌、ATCC27853铜绿假单胞菌,阳性菌株选择ATCC25923金黄色葡萄球菌、ATCC96919肺炎链球菌(中国工业微生物菌种管理中心)。取静脉血1 mL,收集血清,-80℃低温保存,采用ELISA双抗体夹心法测定,试剂盒采用德国BAHMS Diagnostica公司的LUM test型免疫试剂盒,严格按照说明书检测血标本中sCD163、sTREM-1 和MMP-9。对诊断为肺部感染者,进行对症治疗,如抗炎、抗感染等。依据药敏试验的结果选用敏感菌抗菌药物。

2 结 果
2.1病原菌分布 55例患者分离出病原菌74株。见表1。
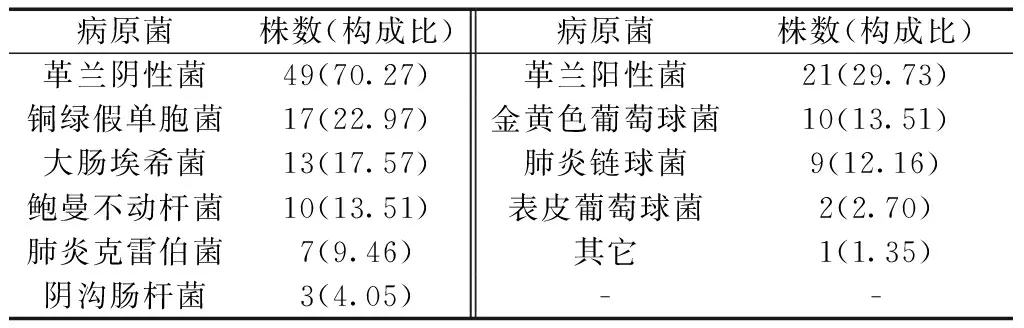
表1 感染组病原菌分布[n(%)]
2.2MMP-9、sTREM-1、sCD163水平 感染组患者的化疗后24、48 h的MMP-9、sTREM-1、sCD163水平均高于未感染组(t24 h=9.270、41.737、17.628;t48 h=12.187、55.506、19.660,P均<0.05)。见表2。

表2 两组MMP-9、sTREM-1、sCD163水平的比较
2.3感染组MMP-9、sTREM-1、sCD16的变化 控制感染后,感染组的MMP-9、sTREM-1、sCD163水平均降低(t=9.321、49.059、16.993,P均<0.05)。见表3。

表3 控制感染后感染组MMP-9、sTREM-1、sCD16的变化
2.4诊断价值 MMP-9的Kappa值为0.746(P<0.05),sTREM-1的Kappa值为0.746(P<0.05),sCD163的Kappa值为0.663(P<0.05)。其灵敏度、特异度见表4。
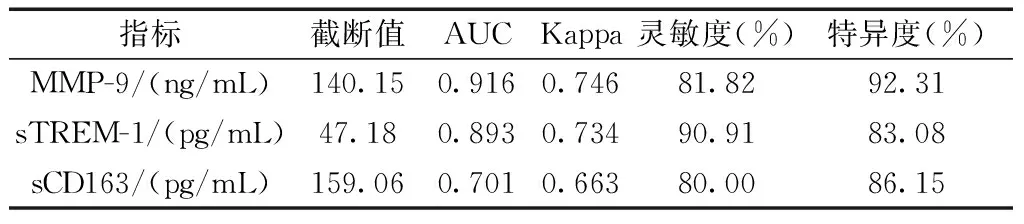
表4 MMP-9、sTREM-1、sCD16在感染中的诊断价值
3 讨 论
本研究55例患者痰培养分离出病原菌74株,其中革兰阴性菌49株,所占比例为70.27%,以铜绿假单胞菌和大肠埃希菌最为常见;革兰阳性菌21株,所占比例为29.73%,以金黄色葡萄球菌最为常见。结果说明引起肺癌化疗患者并发细菌性肺部感染的病原菌主要是革兰阴性菌。研究[7]显示,革兰阴性菌是肺癌患者呼吸道感染的主要致病菌群。考虑原因是革兰阴性菌生命力极强且铜绿假单胞菌和大肠埃希菌等对抗菌药物耐药率较低,且导致肺部感染的革兰阴性菌主要来源是医院,预防院内感染也很重要,首先要严格无菌操作[8]。对已发生肺部感染者,在临床用药上要严格掌握适应症,避免不合理使用抗生素,打破了机体正常菌群生理平衡而导致体内菌群失调,进而引发条件致病菌感染[9]。
本研究经独立样本t检验,感染组患者的化疗后24、48 h后,MMP-9、sTREM-1、sCD163水平均高于未感染组。说明以上标志物对肺癌化疗患者并发细菌性肺部感染的诊断有一定价值。sTREM-1通过转导分子蛋白促进效应器细胞激活,对促炎症因子的分泌和释放起到触发作用,临床相关研究[10]已证实其同时可以起到促炎作用,与感染疾病的发生密切相关。sCD163是单核巨噬细胞细胞膜上的CD163分子脱落入血组成,肿瘤、感染等疾病可以促进CD163的脱落,因此肺部感染时血清sCD163水平升高,研究[11]证实,sCD163有加速病毒及细菌清除的作用,在清除过程中,会释放大量炎症介质,介导机体的炎症反应,可作为感染性疾病进展及预后的判断指标,sCD163也为细菌性感染疾病的标记物提供了新的选择。MMP-9可以直接促进血管活性物质的释放,参与肿瘤新生血管的形成,在炎症介质生成方面发挥了关键作用。经一致性检验,MMP-9、sTREM-1、sCD163的Kappa值为(0.746 VS.0.734 VS.0.663),其灵敏度、特异度比值分别为(81.82%VS.90.91%VS.80.00%)、(92.31%VS.83.08%VS.86.15%)。说明以上三种标志物对炎症物质检验具有灵敏性和特异性,对肺部感染的诊断和治疗提供了参考价值。
