原发性脊柱感染的分析和治疗
2022-08-08罗伟刚尹园园任慧玲
罗伟刚,尹园园,任慧玲
(河北医科大学第三医院 神经内科,河北省 石家庄 050000)
脊柱感染是指特定的病原微生物引起的椎体、椎间盘及椎体周围软组织的感染[1]。脊柱感染在病因学上可描述为化脓性、肉芽肿性(结核性、布氏杆菌性、真菌性)或寄生虫性[2]。脊柱感染为罕见病,患病率估计为每100 000人/年0.4~1例[3]。近年来脊柱感染的发病率呈上升趋势[4-6],但本病起病隐匿,表现不典型,容易误诊漏诊。若不及时诊治,严重者会导致脊柱畸形、神经功能受损、瘫痪,甚至死亡。延误诊断和治疗是这些不良结果的独立危险因素。因此,提高对脊柱感染的警惕与早期明确诊断对指导治疗和改善预后至关重要。本研究旨在比较分析就诊我院的原发性脊柱感染患者的临床资料、实验室和影像学检查结果,以期在临床工作中实现对其病因的早期诊断。
1 资料与方法
1.1研究对象 对河北医科大学第三医院2016年1月-2020年12月收治的脊柱感染患者79例进行回顾性比较研究,临床资料、实验室检查、影像学表现符合原发性脊柱感染诊断标准[4, 7-8]。排除既往有脊柱手术病史和侵入性检查、鞘内药物治疗和存在皮肤表面伤口的患者,以及临床资料不全者。该研究仅包括原发性脊柱感染患者,根据病原体,将患者分为3组: 结核性脊柱感染(TSI组)、布氏杆菌性脊柱感染(BSI组)和其他细菌引起的化脓性脊柱感染(PSI组)。
1.2研究方法 收集并比较3组临床资料、实验室指标和影像学表现。根据以往的研究[9-12],选择候选预测因素来指导PSI、TSI和BSI的鉴别诊断。其中,临床资料包括年龄、性别、起病时间(从发病到就诊河北医科大学第三医院的时间)、临床症状(颈或背部疼痛、发热或寒颤、神经功能障碍)。实验室指标包括入院时白细胞(WBC)计数、中性粒细胞百分比、红细胞沉降率(ESR)、C反应蛋白(CRP)以及降钙素原(PCT)。影像学表现包括病变部位、受累椎体数量、椎间隙狭窄、椎体损害程度、骨桥形成、后凸畸形、椎旁脓肿或腰大肌脓肿及硬膜外脓肿。
1.3统计学方法 采用SPSS 25.0软件进行数据的统计分析。偏态分布的计量资料以中位数(四分位数)[M(Q1, Q3)]表示,组间比较采用Kruskal-Wallis检验和Bonferroni法多重比较分析;计数资料以[例(%)]表示,组间比较采用χ2检验或校正χ2检验和Fisher确切概率法。P<0.05为差异有统计学意义。
2 结 果
2.1人口学特征 符合入选标准的患者有79例,年龄61.0(48.0, 67.0)岁,男46例(58.2%),女33例(41.8%),其中PSI组、TSI组和BSI组分别为32例(40.5%)、28 例(35.4%)和19例(24.1%)。3组性别构成、年龄的差异均无统计学意义(P>0.05),见表1。
2.2临床表现 TSI组起病时间较PSI组时间长,差异有统计学意义(P<0.05);原发性脊柱感染最常见的临床症状是颈或背部疼痛[69例(87.3%)],其次为发热或寒颤[39例(49.4%)]。PSI组出现发热或寒颤症状的患者比例高于TSI组,差异有统计学意义(P<0.017),其余临床表现组间差异无统计学意义(P>0.05),见表1。
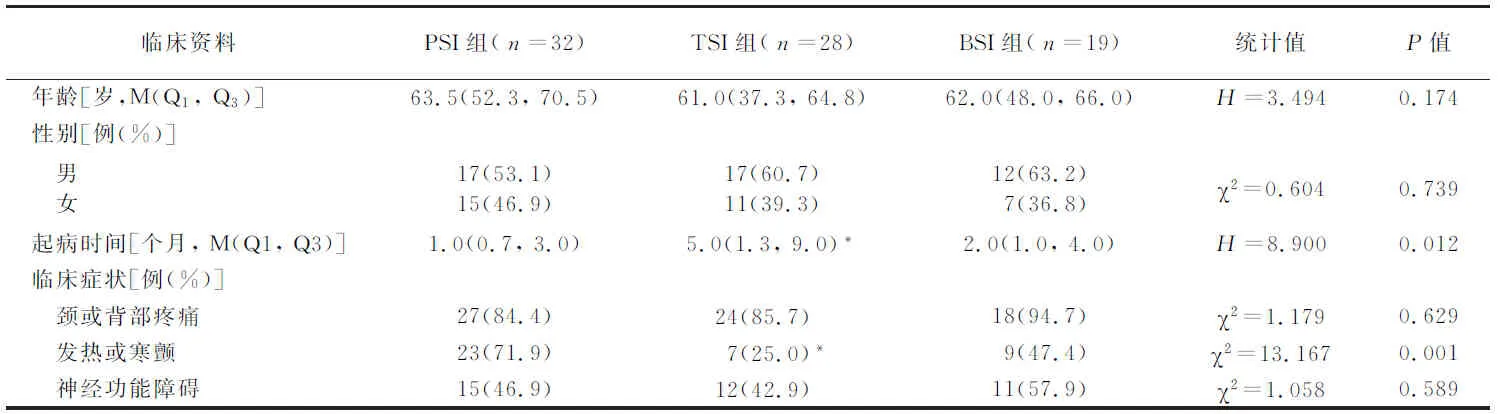
表1 3组临床资料比较
2.3实验室检查结果及微生物检测结果 PSI组入院时中性粒细胞百分比、CRP、PCT高于TSI组与BSI组,PSI组入院时WBC计数高于BSI组,PSI组ESR高于TSI组,差异均有统计学意义(P<0.05),见表2。在PSI组中,金黄色葡萄球菌为最常见的分离致病菌10/32(31.3%),其次为大肠埃希菌5/32(15.6%);其中有2例采用宏基因组二代测序技术,分离出的病原菌分别为金黄色葡萄球菌和大肠埃希菌。

表2 3组实验室检查结果比较[M(Q1, Q3)]
2.4影像学表现 PSI组、TSI组和BSI组中最常累及的部位均为腰骶部,分别为28例(87.5%)、16例(57.1%)和16例(84.2%)。然而,颈胸段受累在TSI组较PSI组中更为常见,差异有统计学意义(P<0.017)。TSI组出现椎旁脓肿和腰大肌脓肿的比例高于PSI组和BSI组,差异有统计学意义(P<0.017)。其余影像学表现组间差异无统计学意义(P>0.05),见表3。
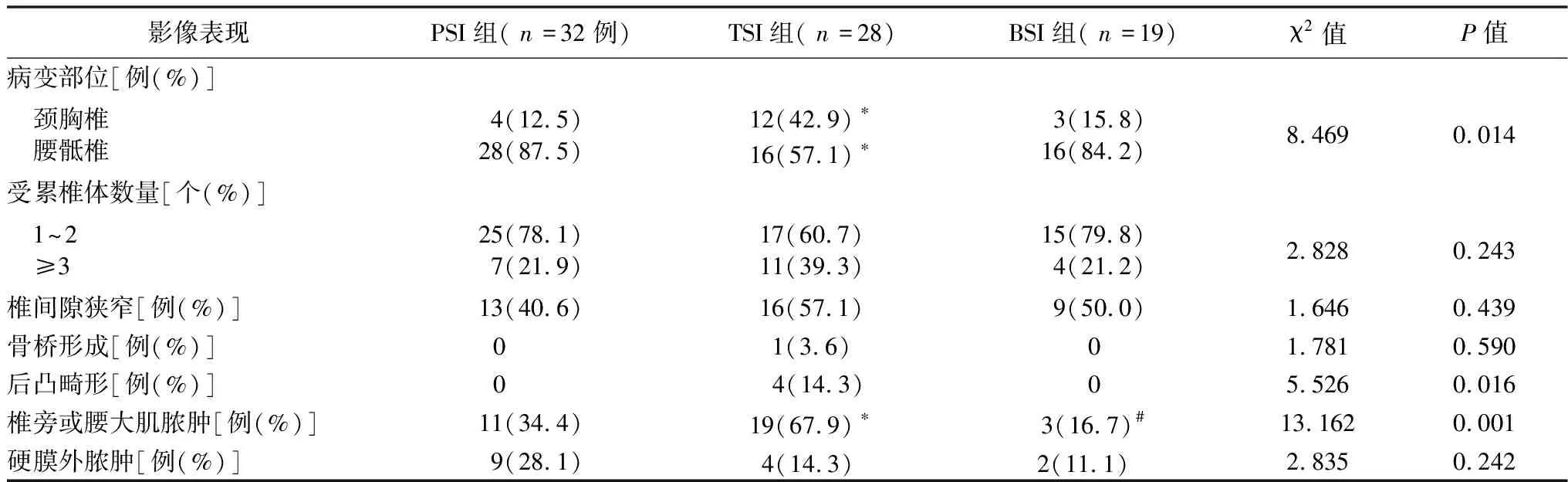
表3 3组影像学表现比较
3 讨 论
脊柱感染起病隐匿,临床表现不特异,临床上保持对脊柱感染的高度警惕和怀疑是及时诊断的核心,如果患者出现新的或恶化的脊柱疼痛和(或)新的脊髓神经根症状,并且至少有以下一种情况,则应怀疑脊柱感染:发热、ESR 或 CRP 升高、血流感染或感染性心内膜炎[13]。
脊柱感染通常最早出现非特异性背部或颈部疼痛,伴或不伴有发热[7, 14]。1/3的病例存在神经功能障碍,包括腿部无力、感觉障碍、神经根病和括约肌失控等[15]。本研究发现PSI最常出现的临床表现为背部或颈部疼痛,其次为发热或寒颤。TSI多伴有午后低热、盗汗,且大多患者有肺结核病史。当脊柱感染患者同时有家畜或畜产品的密切接触史,出现弛张型低热(体温不超过38.5 ℃)、乏力、多汗,多关节痛和全身性肌痛等症状时要高度怀疑BSI[16]。PSI典型表现为病程时间短,并伴有发热和寒颤;而TSI通常表现为相对长而隐匿的病程,从发生到出现临床表现平均需11.2个月,PSI则约为6.4个月[11]。本研究PSI组发病时间较TSI组长,且多伴有发热或寒颤,差异有统计学意义,TSI组多伴有结核病史,BSI组多有家畜和畜产品接触史,与之前研究结果一致。
除了临床表现外,脊柱感染的诊断通常通过WBC计数、中性粒细胞百分比、ESR、CRP以及PCT和典型的影像学表现来确定。与TSI相比,PSI更常伴有以下情况:血细胞比容小于30%,WBC计数大于或等于15 000/mm3,中性粒细胞比例大于75%,血清白蛋白水平小于3.0 g/dl,并且CRP水平大于7.25 mg/L[9]。BSI可见WBC减少、贫血、血小板减少、全血细胞减少和WBC增多[17]。本研究表明PSI组入院时中性粒细胞百分比,CRP,PCT均高于TSI组和BSI组;PSI组的WBC计数高于BSI组,ESR高于TSI组, 差异均有统计学意义。较高水平的非特异性炎性指标提示PSI,故在临床诊断中,对于背部或颈部非特异性疼痛患者,同时有起病急,WBC计数、中性粒细胞百分比、ESR、CRP和PCT大幅度升高的特点,且伴随高热寒颤且无手术史,外伤史患者高度警惕PSI。
脊柱感染的金标准是病原菌培养。对疑似脊柱感染的患者,应于抗生素治疗前留取血培养样本。因为抗生素的使用会大幅降低细菌培养的阳性率。如果阴性,可考虑经皮或开放手术获取病变组织标本。大多数脊柱感染是结核性或化脓性的[9-10]。PSI大多是单细菌感染,最常分离的微生物是金黄色葡萄球菌[10, 12, 18],其次是革兰阴性病原体,如大肠杆菌[6]。本研究中PSI最常分离出来的微生物为金黄色葡萄球菌,其次为大肠杆菌,与之前研究结果一致。对于疑似脊柱结核,应查结核菌素试验 (PPD) 和干扰素-γ释放试验[13],组织病理学检查能够区分化脓性和肉芽肿性感染,PCR是一种新的有前途的诊断技术,可以更快地获得诊断,并在24小时内得出结果[19]。标准试管凝集试验和酶联免疫吸附法检测布鲁氏菌的 IgG 和 IgM 抗体有助于诊断BSI[8, 13]。
在无法分离导致感染的致病微生物(即CT 引导下脊柱活检或血培养阴性)的情况下,MRI 在诊断脊柱感染中起到关键作用[10]。MRI是脊柱感染的首选成像方式[13]。怀疑脊柱感染时应进行MRI检查,因为非特异性临床特征会导致诊断延迟,进而使致残率和死亡率增加。脊柱感染椎体早期表现的特征是 T1 加权图像(T1WI)上的低信号强度和T2加权图像(T2WI) 高信号强度,静脉注射对比剂后T1WI序列对比增强[7, 8, 10, 13]。
PSI累及椎体终板、椎间盘间隙,并逐渐扩散至邻近椎体,通常不超过两个相邻的椎体和之间的椎间盘。腰椎是最常受影响的节段[10]。在PSI中,椎旁脓肿的发生率比TSI要低[10, 20]。脓肿壁增厚且不规则强化和界限不清的椎旁软组织提示PSI[21]。本研究表明PSI最累及部位为腰骶椎,椎体破坏较轻,椎旁脓肿出现比例低于TSI,其脓肿壁较厚。
与PSI不同,TSI通常会累及胸椎并且通常涉及两个或更多节段[10]。椎体通常受到严重破坏,通常累及后部[9, 20, 22],即破坏椎弓根和椎板[8],而在感染早期椎间盘相对保留(可能是由于分枝杆菌中缺乏蛋白水解酶)。感染过程通常沿着前纵韧带向头尾方向扩散,导致的多节段脊柱受累和跳跃性病变是TSI的体征[8, 10],故现在建议在诊断出TSI后立即使用全脊柱 MRI[7]。脊柱后凸畸形和受累椎体水平脊膜强化提示TSI[19, 23]。椎旁脓肿常见于TSI,在给予对比剂后显示薄而规则的边缘周边强化[10, 22]。冷脓肿椎体的外侧部分为扇形,这些软组织阴影中存在钙化高度提示TSI,可以通过X线摄影或CT而不是 MRI 来辨别[24-25]。本研究表明TSI组最常累及腰骶椎,但累及颈胸椎的比例高于其余2组,差异有统计学意义,累及超过两个椎体的比例高于其余2组,椎体破坏严重,易出现后凸畸形,常出现椎旁脓肿和腰大肌脓肿,强化后边缘为薄而规则强化。
在本研究中布氏杆菌性脊柱感染最常见的部位是腰骶椎区域,与之前研究一致[26-27]。布氏杆菌性脊柱炎的早期形态特征是上终板前部在椎间盘交界处的溶解。骨愈合几乎与炎症过程同时开始,并导致前骨赘(鹦鹉喙)的形成和硬化,但椎体可能在整个过程中保持完整。故相比于TSI、BSI椎体增生多,而椎体塌陷和脊柱后凸畸形很少见[27]。小关节受累是BSI的特异性表现[8]。椎旁脓肿很少发生,体积较小,椎旁钙化不如TSI常见[8]。本研究表明BSI很少出现椎体塌陷或破坏、没有脊柱后凸畸形,很少出现椎旁脓肿和腰大肌脓肿。
抗生素是治疗脊柱感染的主要手段。大多数脊柱感染可以通过抗生素和支架的保守治疗来治愈。PSI患者应在获得病原学结果后使用抗生素。然而,在严重脓毒症或病因诊断不确定的情况下,应根据经验开始使用广谱抗生素,应涵盖最常见病原体(尤其是金黄色葡萄球菌、链球菌和大肠杆菌)[6],对于大多数PSI患者,抗生素治疗6周是足够的[28]。敏感脊柱结核最常用的药物治疗原则与其他部位结核一致,WHO和疾病控制中心均建议使用2个月的利福平、异烟肼、吡嗪酰胺和乙胺丁醇,然后继续使用4个月的利福平和异烟肼[29]。对于BSI,阿米卡星(0.4 g/d 静脉注射)、妥布霉素(0.16 g/d静脉注射)、依替米星(0.2 g/d静脉注射)或头孢哌酮钠和舒巴坦钠(4.5 g/d静脉注射)联合左氧氟沙星(0.4 g/d静脉注射)使用2周。给予患者强力霉素(0.2 g/d口服)和利福平(0.6 g/d口服)或左氧氟沙星胶囊(0.5 g/d 口服)至少12周[30]。
当患者出现神经功能缺损、脓毒症、椎管内脓肿、>2.5 cm的腹侧或椎旁脓肿、脊柱不稳定、保守治疗失败及时进行手术治疗;不稳定标准为节段性后凸(>15°)、椎体塌陷>50%、平移>5 mm[6]。手术干预的主要目标是早期椎管减压和稳定受累节段,以及在神经功能缺损的情况下对受影响组织进行持续清创和椎旁脓肿引流[19]。在完成治疗后,症状和体征的复发或恶化,ESR或CRP再次升高、新的椎体病变和影像学进展可以提示疾病复发或再次感染[7, 9, 30]。
综上,脊柱感染起病隐匿,临床上保持对脊柱感染的高度警惕是及时诊断的核心,临床鉴别原发性脊柱感染的病因需要对患者的临床症状、实验室指标、影像学结果等进行综合考虑。必要时行经皮或开放手术活组织检查和细菌培养以明确感染类型及病原菌种类、为使用抗生素提供依据。对于脓毒症或病因诊断不确定的情况下,经验性给予抗生素,符合手术指征的患者,及时手术治疗,以免造成永久性脊柱畸形及神经损伤。
本研究的局限性为PSI、TSI和BSI样本量较少,而且部分患者来院前已进行抗感染治疗,导致炎性指标有偏倚,对三者椎体破坏范围和脓肿壁厚薄没有进行量化,对破坏的关节面没有进行上下终板分类,对椎体强化信号的是否均匀未做统计,此外本研究只针对了原发性化脓性、结核性和布氏杆菌性三种病因的脊柱感染,没有搜集真菌性、寄生虫性等其他病因脊柱感染的疾病,在今后的临床工作中,需要对更大的研究人群进行进一步研究,进行更精确的定量分析。
