原发性干燥综合征合并甲状腺功能减退眼表状态评估
2022-08-08于昊哲曾唯珍吴文雨姚中强
于昊哲,曾唯珍,吴文雨,姚中强,冯 云△
(北京大学第三医院1.眼科,2.风湿免疫科, 北京 100191)
原发性干燥综合征(primary Sjögren’s syndrome, pSS)是以外分泌腺发生淋巴细胞浸润为特点,临床表现以口干、眼干为主的常见慢性自身免疫性疾病[1]。患者常主诉明显的眼部不适就诊于眼科,并确诊干眼症(dry eye disease, DED)。已有研究表明pSS是睑板腺功能障碍、泪腺组织炎症的危险因素,可导致泪液分泌不足、泪液渗透压高以及泪膜稳定性差等,是引发DED的主要原因,又称为原发性干燥综合征相关性干眼(primary Sjögren’s syndrome related dry eye, pSS-DED)[2]。pSS-DED症状较普通DED更为严重,如明显角结膜上皮细胞角化、视觉质量显著降低、眼表和泪液中促炎因子增加,以及葡萄膜炎、巩膜炎、角膜穿孔等潜在严重并发症发生率提高[3]。除口干、眼干外,pSS也严重累及内分泌系统,导致下丘脑-垂体-甲状腺轴活动减退,临床主要表现为甲状腺功能障碍或自身免疫性甲状腺炎。中国风湿病数据中心的多中心研究发现pSS患者中逾68.59%存在眼干, 甲状腺功能障碍是pSS最常见合并症(11%), 其中合并甲状腺功能减退(hypothyroidism,HT)患者占比最大(6%)[4]。HT主要由甲状腺激素分泌不足等引起,既往研究发现泪腺同样作为甲状腺激素的靶器官,甲状腺激素水平降低可导致泪液分泌不足并进一步引发干眼,流行病学研究亦证实HT是干眼的危险因素(OR=1.95)[5]。合并HT的pSS-DED可能较单纯pSS-DED患者的眼表情况更为复杂,然而此类研究尚很少见,提高对合并HT的pSS-DED患者眼表情况的进一步认识,对于改善患者预后具有重要意义。因此,本研究旨在通过系统评估pSS-DED以及pSS-DED合并HT患者的眼表状态,探讨合并HT对pSS患者眼表情况的影响及其临床特征,以期为后续基础研究与临床治疗提供参考。
1 资料与方法
1.1 病例选择
选择2020年12月—2021年6月在北京大学第三医院眼科干眼门诊就诊的DED、pSS-DED以及合并HT的pSS-DED患者共计60例。DED诊断标准参照《中国干眼专家共识:检查和诊断(2020年)》[6]。pSS诊断标准参照2016年ACR/EULAR(American College of Rheumatology/European League Against Rheumatism)pSS分类标准共识[7],HT诊断参照2017年《成人甲状腺功能减退症诊治指南》[8],所有入组pSS患者均经北京大学第三医院风湿免疫科确诊。pSS-DED患者纳入标准:(1)符合pSS以及DED诊断标准;(2)无其他全身并发症(如紫癜、外周神经病等), 并且无其他眼科疾病(如青光眼等);(3)年满18岁,能配合各项眼科检查且临床资料完整。pSS-DED+HT患者纳入标准:(1)符合pSS、DED和HT诊断标准;(2)无其他全身并发症(如紫癜、外周神经病等),无其他眼科疾病(如青光眼等),并且既往未接受过甲状腺手术;(3)年满18岁,能配合各项眼科检查且临床资料完整。
本研究开始前获得北京大学第三医院科学研究伦理委员会审查批准(IRB00006761-M2020456), 所有参与研究的患者均签署知情同意书。
1.2 实验室指标
收集pSS+HT患者的唇腺活检结果、血清抗体及甲状腺功能相关指标,血清抗体包括SSA、SSB,甲状腺功能相关指标包括总甲状腺素(total thyroxine 4, TT4)、游离甲状腺素(free thyroxine 4, FT4)、促甲状腺激素(thyroid stimulating hormone, TSH)、甲状腺球蛋白抗体(thyroglobulin antibody, TGAb)与甲状腺过氧化物酶抗体(thyroid peroxidase antibody, TPOAb)。所有指标检测基于化学发光免疫分析法(西门子公司,德国)在北京大学第三医院进行。TGAb与TPOAb<60 U/mL认为阴性,TGAb以60~279 U/mL、280~500 U/mL以及>500 U/mL分别定义为弱阳性、中阳性与强阳性;TPOAb以60~679 U/mL、680~1 300 U/mL以及>1 300 U/mL分别定义为弱阳性、中阳性与强阳性。
1.3 眼表与泪液检查
采用泪膜破裂时间(tear film break-up time, BUT)、泪液分泌Schirmer试验、泪河高度检查、角/结膜荧光素染色以及眼表疾病指数(ocular surface disease index, OSDI)评估患者眼表与泪膜功能。使用荧光素钠眼科检测试纸(辽宁美滋林药业有限公司)对患者进行眼表均匀染色,在裂隙灯钴蓝光下记录第一个干燥斑出现时间,重复3次即得BUT;将泪液分泌检测滤纸(辽宁美滋林药业有限公司)置于患者下眼睑内靠外1/3处,记录闭眼5 min后的泪液分泌量;泪河高度由眼表综合分析仪(Oculus Company,Germany)获得;使用眼表角结膜染色检测试纸(辽宁美滋林药业有限公司)对患者眼表进行均匀染色,在裂隙灯观察角/结膜点染情况并计分相加,获得角/结膜荧光素染色评分。
1.4 睑板腺功能检查
采用睑板腺分泌能力、睑酯性状评估以及睑板腺成像评估患者睑板腺功能。挤压患者各眼上下睑,观察患者分泌物睑酯排出难易程度,计0~3分,0分为全部具有排出能力,3分为不具备排出能力;对各眼上下睑腺体分泌物睑酯进行观察评分,0分为睑酯呈清亮、透明,3分为睑酯浓稠,呈牙膏状;睑板腺成像由眼表综合分析仪(Oculus Company,德国)获得。
1.5 角膜形态学检查
使用共聚焦显微镜(德国海德堡公司)对患者中央角膜进行观察,每幅图像采集尺寸400 μm× 400 μm,每层采集5张图片;基底下神经丛特征分析与树突状细胞计数范围设定于40~70 μm处;基于ImageJ软件计算树突状细胞密度并确定神经纤维长度、密度;神经纤维曲率评分采用Oliveira-Soto标准[9]。
1.6 统计学分析
采用IBM SPSS 24.0软件,符合正态分布的计量资料以均数±标准差表示,组间比较采用t检验或单因素方差分析,事后多重检验采用S-N-K方法。计数资料采用相对数表示,组间比较采用卡方检验。偏态资料采用中位数(四分位间距)表示,偏态资料与等级资料组间比较采用秩和检验。检查资料组间比较报道效应量,认为Cohen’sd(t检验与秩和检验)>0.4与η2(单因素方差分析)>0.06时结果具有中等效应。采用Spearman秩相关分析甲状腺功能实验室指标与眼表状态的相关性,相关系数|r|≥0.5认为存在中等以上相关关系,置信区间设定为α=0.05。
2 结果
2.1 纳入病例基本情况
共纳入36例pSS-DED患者,其中女性患者26例(72.2%),平均年龄(47.5±13.8)岁,患者唇腺活检评分均在2级及以上,SSA阳性率为89%,SSB阳性率为78%,抗核抗体阳性率为87%,确诊pSS并出现眼干病程2.0(1.0,3.0)年,其中12例合并HT,女性患者9例(75.0%),平均年龄(43.4±4.2) 岁,确诊pSS并出现眼干病程2.0(1.0,3.0)年,pSS+DED组及pSS+DED+HT组的唇腺活检评分(3.0±0.8vs.3.1±0.9,P<0.05)、SSA(2.2±0.6vs.2.3±0.7,P<0.05)、SSB(2.1±0.7vs.2.2±0.8,P<0.05)组间差异无统计学意义。另纳入24例单纯DED患者作为对照组,其中女性患者16例(66.7%), 平均年龄(48.7±12.7)岁,确诊干眼病程1.5(1.0,2.0)年。3组患者性别比例(χ2=0.28,P=0.87)、年龄(F=0.91,P=0.41),以及出现眼干病程(H=1.08,P=0.58)差异无统计学意义。
2.2 眼表与泪液相关检查
对3组患者进行眼表与泪液相关检查(图1),组间比较发现合并HT后的pSS-DED患者较DED与pSS-DED患者,泪膜破裂时间(F=12.43,P<0.01,η2=0.30)、Schirmer试验(F=6.96,P<0.01,η2=0.20)以及泪河高度(F=3.31,P<0.05,η2=0.10)检查结果水平偏低,差异具有统计学意义。组内比较发现pSS-DED患者相关指标水平低于DED患者,但差异无统计学意义;pSS-DED+HT患者平均泪膜破裂时间[(2.7±0.8) svs.(4.2±0.90) s]、Schirmer实验[(4.9±4.8) mmvs.(9.5±3.9) mm]以及泪河高度[(0.13±0.03) mmvs.(0.16±0.04) mm]均低于pSS-DED患者,差异具有统计学意义(P<0.01,P<0.01,P<0.05)。pSS-DED+HT患者较pSS-DED以及DED患者角/结膜荧光素染色评分更高(9.1±2.5vs.8.8±4.5vs.8.7±4.1), 但差异无统计学意义。3组患者中pSS-DED患者OSDI评分更高(20.5±2.5), 随后依次为pSS-DED+HT患者(20.1±5.8)与DED患者(19.8±6.6), 差异无统计学意义。
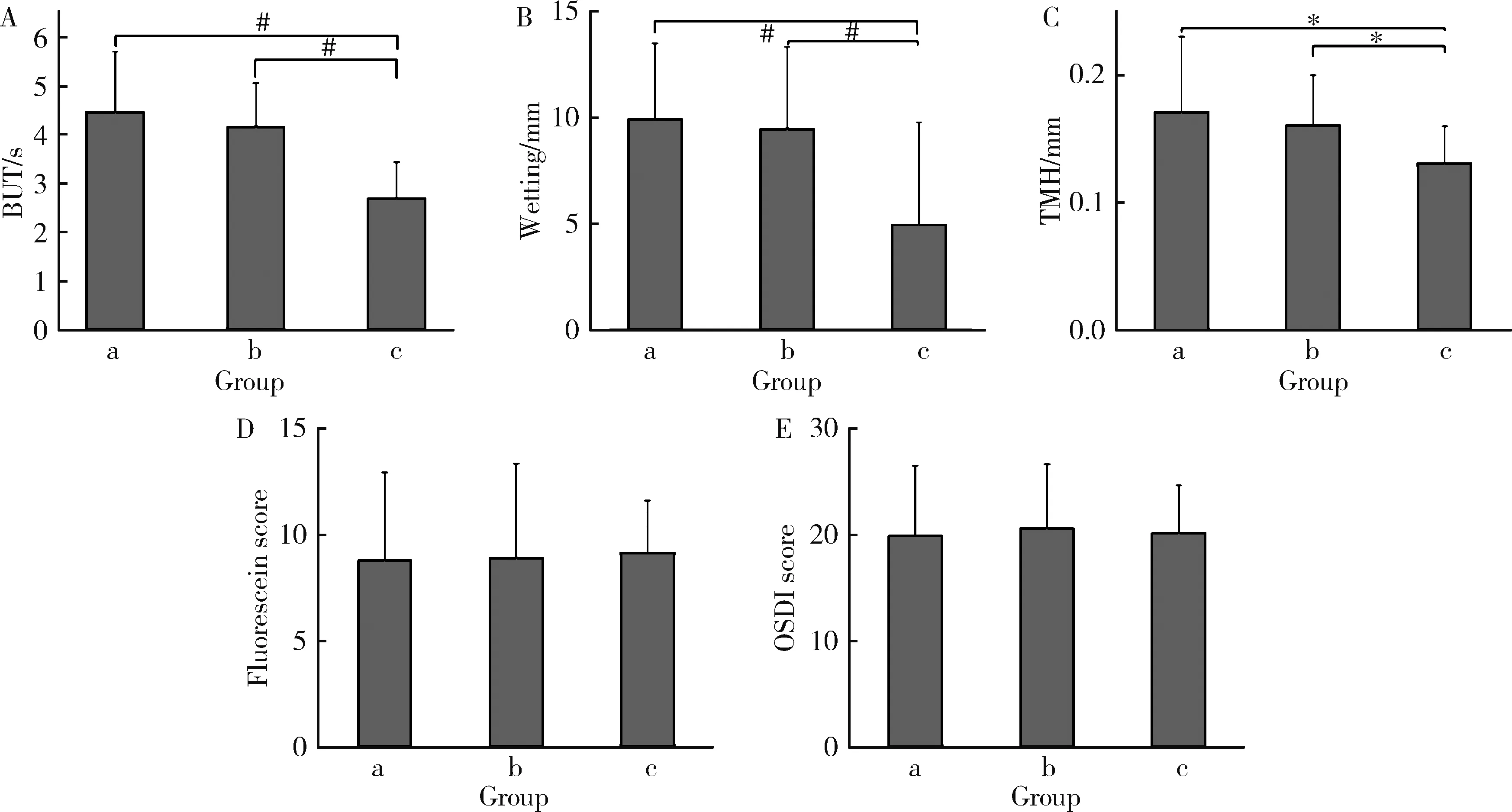
A, BUT (tear break-up time); B, Schirmer test; C, TMH (tear meniscus height); D, corneal/conjunctival fluorescein staining; E, OSDI (ocular surface disease index). a, DED (dry eye disease); b, pSS (primary Sjögren’s syndrome)+DED; c, pSS+DED+HT(hypothyroidism). *P<0.05; # P<0.01.图1 DED、pSS-DED以及pSS-DED合并HT患者的眼表与泪液检查结果Figure 1 Ocular surface and tear examination results of DED, pSS-DED and pSS-DED with HT patients
2.3 睑板腺功能相关检查
3组患者睑板腺功能相关检查的组间比较显示DED、pSS-DED以及pSS-DED合并HT患者睑板腺分泌能力分布不同,差异具有统计学意义(P<0.05)。组内比较结果表明pSS-DED+HT分泌能力明显低于单纯DED患者(P<0.05), pSS-DED+HT与 pSS-DED患者睑板腺分泌能力评分相似,集中于2分段,且pSS-DED+HT患者较pSS-DED患者分布更为集中于高分段,但差异无统计学意义(50.0%vs.58.3%vs.12.5%)。3组患者睑酯性状评估分数分布差异具有统计学意义(P<0.05),pSS-DED与pSS-DED+HT患者评分高于DED患者,且评分有增高的趋势,特别在2分段(41.6%vs.50.0%vs.12.5%)。图2展现了功能评分相近的3组患者典型睑板腺形态红外成像,可以发现合并HT的pSS-DED患者较DED与pSS-DED患者腺体数量较少、退行较多,整体排列疏松,且形态较为弯曲。
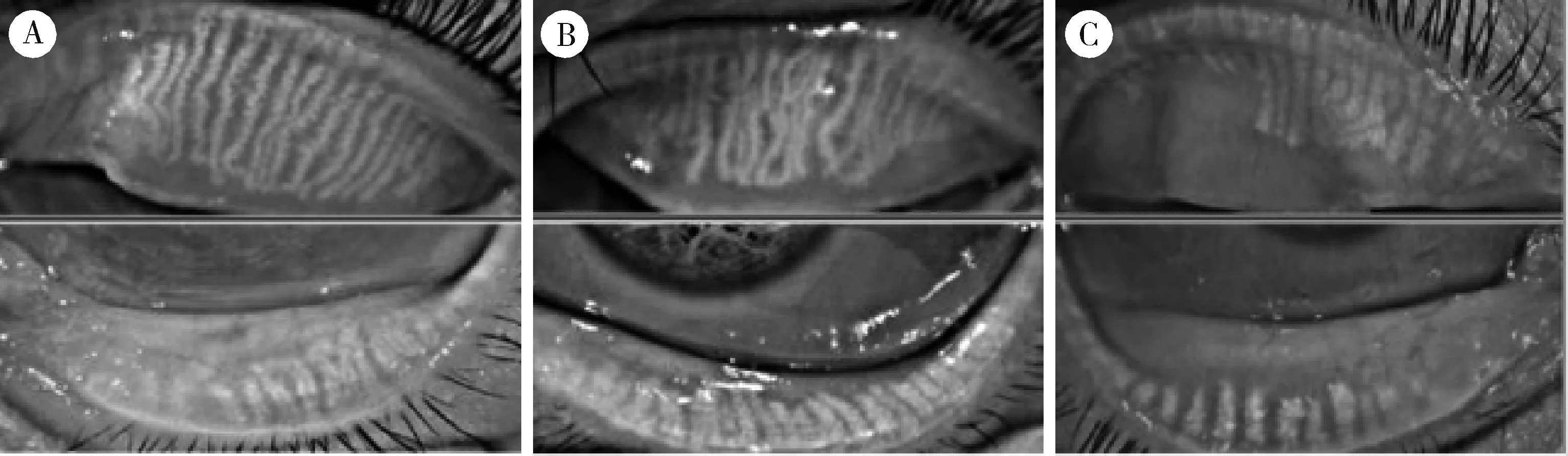
A, DED (dry eye disease); B, pSS (primary Sjögren’s syndrome)+DED; C, pSS+DED+HT (hypothyroidism).图2 睑板腺形态红外成像Figure 2 Infrared imaging of meibomian gland morphology
2.4 甲状腺功能指标与眼表状态的相关性
表1显示了甲状腺功能相关指标与眼表状态的相关关系,发现pSS+HT患者TT4、FT4水平与BUT、Schirmer试验以及泪河高度显著相关,且r均大于0.5,表明其具有紧密正相关性;其中FT4水平与Schirmer试验以及泪河高度的相关性大于TT4(0.66vs.0.64,0.62vs.0.61)。TSH水平表现出与BUT、Schirmer试验以及泪河高度的边缘负相关(P<0.1)。TGAb、TPOAb与眼表状态均无相关性,睑板腺分泌能力与甲状腺功能无相关性。
2.5 角膜形态学变化
共聚焦显微镜观察pSS-DED与pSS-DED+HT患者中央角膜细胞与神经纤维形态如图3所示,pSS-DED患者可见较正常的角膜上皮翼状细胞,排列相对紧密(图3A);角膜上皮下可见神经纤维迂曲分叉,走行紊乱,可见炎性树突状细胞浸润(图3B);基质细胞出现多形性趋势(图3C);内皮细胞未见明显异常(图3D)。pSS-DED+HT患者镜下可见角膜上皮翼状细胞排列密集但相对混乱(图3E);角膜上皮下可见神经纤维出现多处分叉,神经纤维增粗,树突状细胞浸润进一步增多(图3F);基质细胞多形性增加,反光增强,密度增加(图3G);内皮细胞未见明显异常(图3H)。计数分析可以发现合并HT的pSS-DED患者较pSS-DED患者神经纤维密度降低,曲率增加,差异具有统计学意义,此外,合并HT后的pSS-DED患者树突状细胞密度表现出升高趋势,神经纤维长度表现出缩短趋势,但与pSS-DED患者结果差异无统计学意义(表2)。
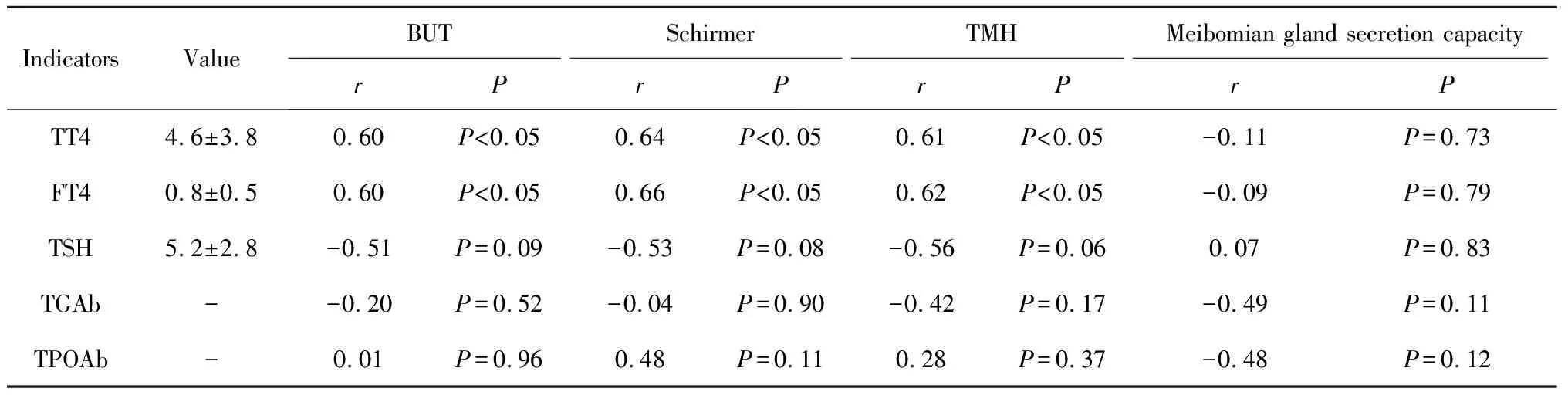
表1 pSS-DED合并HT患者甲状腺功能指标与眼表状态Spearman秩相关分析Table 1 Spearman’s rank correlation analysis of thyroid function indicators and ocular surface status in patients with pSS-DED+HT
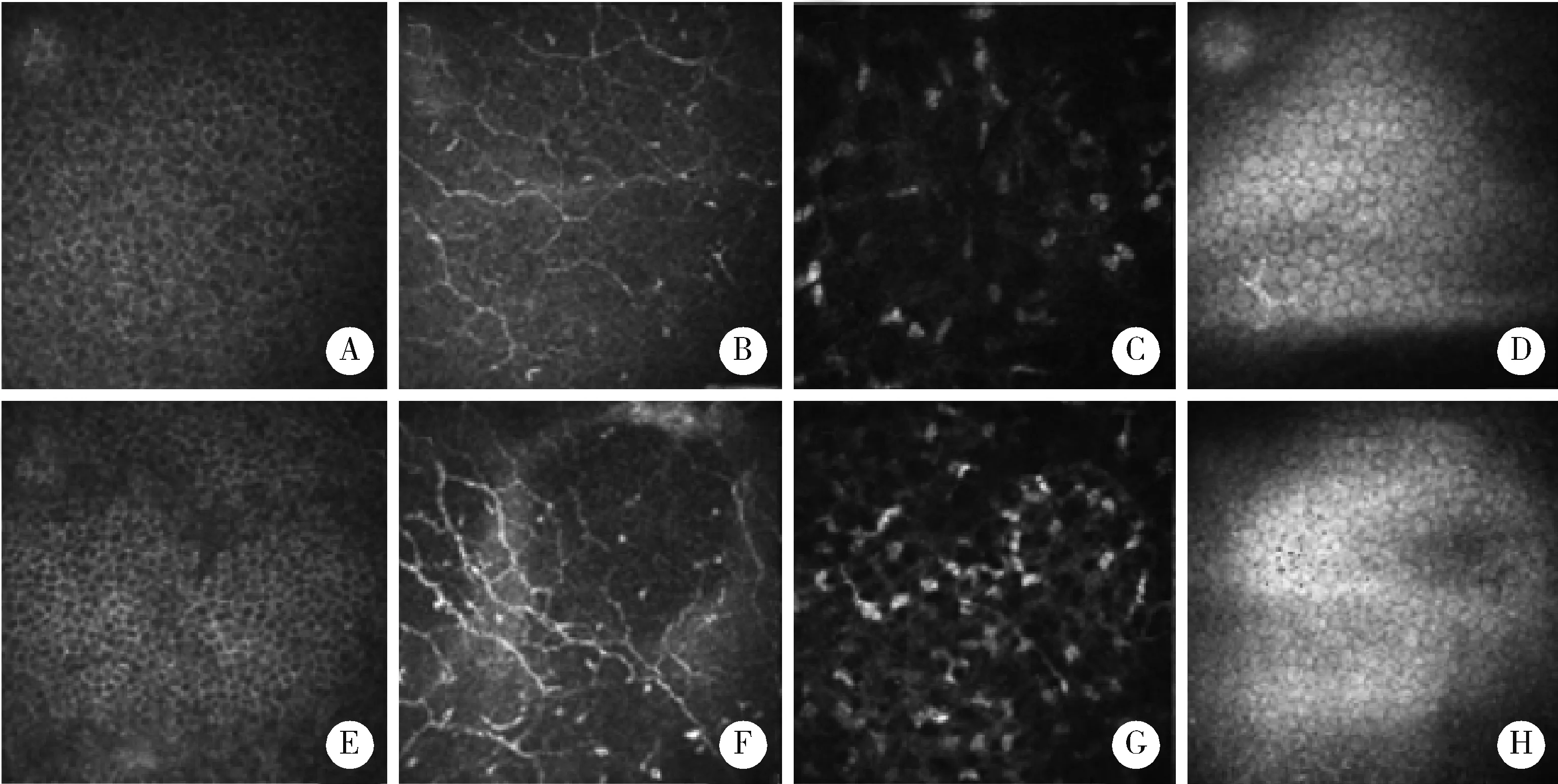
Primary Sjögren’s syndrome related dry eye disease (pSS-DED) patients: A, corneal epithelial pterygium cells; B, corneal subepithelial nerve; C, corneal stromal cells; D, corneal endothelial cell. pSS-DED+HT (hypothyroidism) patients: E, corneal epithelial pterygium cells; F, corneal subepithelial nerve; G, corneal stromal cells; H, corneal endothelial cell.图3 共焦激光角膜显微镜观察Figure 3 Confocal microscopical observation

表2 pSS-DED以及pSS-DED合并HT患者上皮树突状细胞密度与基底下神经丛特征Table 2 Dendritic cell density and characteristics of corneal sub-basal nerve plexus in patients with pSS-DED and pSS-DED+HT
3 讨论
甲状腺相关疾病是原发性干燥综合征的常见并发症,已有研究表明干燥综合征是发生甲状腺相关疾病的重要风险因素(OR=3.29), 特别对于甲状腺功能减退者(OR=3.81)[10]。Sepulveda等[11]对斯堪的纳威亚(Scandinavian)临床中心收治的967名原发性干燥综合征患者,进行近十年随访后发现甲状腺功能减退患者占比逾30%,且多发于女性,其主要原因在于甲状腺与原发性干燥综合征的主要受累器官唾液腺与泪腺存在组织功能学上的相似性,二者具有关联的遗传与环境风险因素,并且在病理生理机制中均表现为淋巴细胞浸润。探讨合并HT后pSS患者眼表情况的变化对于进一步理解pSS-DED的发病机制与指导临床治疗具有重要意义。
眼表与泪液异常是DED最显著的特点,本研究发现pSS-DED+HT患者较pSS-DED患者的BUT、Schirmer试验以及泪河高度结果降低,差异具有统计学意义,提示合并HT后可能会进一步影响pSS-DED患者的泪液分泌,造成泪膜稳定性异常。Jara等[12]提出这可能是由于存在内分泌腺-泪腺相互作用或通过下丘脑-垂体轴介导其他激素(如雄激素),间接调控泪腺功能。在动物实验中也发现类似的现象,Williams等[13]建立了甲状腺功能减退犬模型,发现其Schirmer试验结果远低于正常犬,并且表现出严重的DED。Dias等[14]进一步证实泪腺是甲状腺激素的靶器官,TH导致的长期低甲状腺激素水平可以导致泪腺中甲状腺激素β-1受体(Thrb)形态功能异常,导致泪腺功能障碍,此外, 在角/结膜上皮细胞中也发现Thrb的表达。
正常睑板腺分泌的睑酯是构成泪膜的主要成分,睑板腺功能障碍可导致睑酯分泌或成分异常,影响眼表泪膜稳定性,是造成干眼的重要原因之一。已有研究表明pSS-DED患者常并发睑板腺功能障碍,临床表现为腺体数量减少、分泌降低以及睑酯质量下降,导致pSS-DED通常兼具泪液分泌不足与蒸发过快的特点[15]。激素在睑板腺功能调节中具有重要意义,在睑板腺中已经发现雄激素受体表达,这可解释缺乏雄激素的女性pSS-DED患者睑板腺功能通常更差[16]。本研究亦发现较DED患者,pSS-DED以及pSS-DED+HT患者睑板腺分泌能力评分相对更高,并且pSS-DED+HT患者比例更高,但差异无统计学意义;从睑板腺成像可以看出合并HT的pSS-DED患者腺体分布更为疏松、弯曲度大。类似的睑板腺腺体缺失在甲状腺相关性眼眶病HT患者中亦有报道,提示甲状腺激素或炎症因子可能影响睑板腺功能,但本研究现有结果尚不能明确合并pSS后甲状腺激素对睑板腺的影响,需扩大样本量加以证实[17]。
TSH、TT4与FT4是衡量甲状腺功能与诊断HT的主要指标,TSH反馈调节甲状腺分泌T4激素,未与蛋白结合的T4激素称为FT4,其能直接反映体内甲状腺激素生物活性。已有研究发现高FT4水平是甲状腺相关眼病患者发生干眼的保护因素(OR=0.03),且高TSH与低FT4水平可通过促进结膜鳞状上皮化生进一步影响患者眼表稳态[18]。本研究亦发现TT4与FT4水平呈现出与BUT、Schirmer试验与泪河高度正相关的特点,且FT4相关系数更高,进一步证明了低甲状腺激素水平及其对泪液分泌的影响可能是导致pSS+HT患者眼表状态不佳的重要原因;但TSH水平与眼表状态表现出边缘负相关显著,这可能是由于本研究样本量少,未进一步区分HT分型所致。TGAb与TPOAb是重要的甲状腺自身抗体,其高水平表达可诱导甲状腺细胞凋亡与损伤,影响其生物学功能,研究表明合并pSS后HT患者体内两类抗体水平将进一步升高[19]。在类似桥本甲状腺炎合并DED研究中可以发现患者与健康受试者泪液中两类抗体水平升高是导致干眼的重要因素[20]。然而本研究未发现相关关联,这可能是由于泪液与血清中相关抗体分布差异或样本量少所致,其机制仍需进一步探讨。此外,本研究所选甲状腺功能指标亦未发现与睑板腺分泌功能相关性,与既往研究一致[21],提示甲状腺激素与相关抗体并非直接影响睑板腺功能,其路径需综合更多相关指标探索。
共聚焦显微镜以其无创、高放大倍率等优点已经广泛应用于DED患者角/结膜细胞的形态学观察与病理生理学机制解释。DED患者的共聚焦显微镜观察通常表现为神经退行性变化,如神经纤维密度降低、长度减少,其可解释患者因角膜知觉降低而减少眨眼频率导致干眼[22]。pSS-DED患者通常较DED患者神经退行更为明显,Li等[23]发现较DED患者,pSS-DED患者神经纤维密度较低,二者平均长度类似。但这一结果可能受患者pSS病程与严重程度影响,轻症pSS患者可能因代偿表现为神经密度增长,中度或重症患者则进一步破坏代偿性增长,出现神经密度降低[24]。此外,pSS-DED还可表现出神经弯曲度增加以及树突状细胞浸润等特点,提示其干眼多为炎症性且神经损伤更重[25-26]。本研究发现较pSS-DED,pSS-DED+HT患者表现出更低的神经纤维密度与更高的曲率评分,但树突状细胞密度近似,表明HT能够加剧角膜神经的退行性改变,但不会明显促进pSS-DED的炎症反应。
综上所述,pSS-DED与pSS-DED+HT患者的眼表状态存在一定差异,主要表现为泪液分泌减少、泪膜不稳定性增加、睑板腺分泌能力降低、睑酯性状变差、角膜炎症细胞浸润增加与基底下神经丛形态改变,其可能是因甲状腺激素长期处于低水平,降低泪腺泪液分泌功能所致。受限于本研究为横断面的单中心研究,可能存在样本量少或样本选择偏倚。进一步扩大样本量并结合基础与干预性研究,探讨不同分型HT对pSS-DED患者的影响,同时扩展更多pSS合并症,有助于深入理解pSS-DED的病理生理机制,为后续合理治疗提供针对性建议。
