小麦贵协3号成株期抗条锈病基因的遗传定位
2022-08-08葛昌斌丁延庆辛智海张立异
高 旭,程 斌,高 煜,葛昌斌,丁延庆,曹 宁,辛智海,张立异
(1.贵州省农业科学院旱粮研究所,贵州贵阳 550006; 2.贵州大学农学院,贵州贵阳 550025;3.漯河市农业科学院,河南漯河 462300; 4.贵州大学生命科学学院,贵州贵阳 550025)
迄今为止,已经有34个小麦条锈菌生理小种(CYR1~CYR34)和40多个致病类群(如洛10、杂46、贵农22等)被命名,其中CYR32、CYR33和CYR34为当前中国小麦条锈菌的主要流行小种。截止2020年,全球已有83个抗条锈病基因被正式命名,有40多个抗条锈病基因被暂时命名。但是,贵农22致病类群出现以后,只有少数苗期抗病基因(、、等)对现有的条锈菌仍能保持有效的抗病性。CYR34小种主要分布在中国西南地区和西北甘肃等省份,目前该小种已经扩展至全国大部分麦区,对中国小麦安全生产和抗病育种工作造成严重威胁。因此,必须通过挖掘新的抗条锈病基因来拓宽抗性基因遗传资源。
SNP芯片技术被广泛应用于小麦研究中,是一种高通量、微型、自动化检测SNP的手段。混池转录组测序(BSR-Seq)技术无需检测全基因组,且不涉及重复序列,所以对基因组较大的物种而言,BSR-Seq更为简便有效。Zhang等利用一个RIL群体(SW8588/Thatcher)并结合55K芯片,检测到7个抗叶锈病QTL和6个抗条锈病QTL,其中有4个QTL对两种病害兼具抗性。Jia等利用小麦品种济麦23和泰农18杂交构建的F和F群体进行BSR-Seq,将抗白粉病基因定位在5DS染色体标记YTU3004和Swgi068/Bwm20之间。
贵协3号是利用以色列野生二粒小麦(,AABB,2=28)与光稃野燕麦(L.var.)进行杂交,获得的F代与贵农22回交选育而成的普通小麦材料。2010―2021年,贵协3号在中国多个麦区对条锈病主要流行小种(CYR32、CYR33和CYR34)均表现为近免疫或高抗,充分说明该品种具有较好的持久抗病性,是一个具有利用价值的条锈病抗源。因此,本研究对贵协3号的条锈病抗性进行研究,准确定位其携带的抗条锈病基因,并发掘与抗条锈病基因紧密连锁的分子标记,以期加快贵协3号在小麦抗病育种中的应用,保障中国小麦安全生产。
1 材料与方法
1.1 试验材料
以来自澳大利亚的高感条锈病小麦品种Avocet S为母本,以来自贵州大学张庆勤教授惠赠的高抗条锈病品系贵协3号为父本,杂交得到的F种子自交形成F,F再以单籽粒传法获得227份F代重组自交系(RIL)群体,用于田间成株期条锈病的表型鉴定和基因型分析。感病对照品种为铭贤169。
1.2 成株期条锈病表型鉴定
于小麦成株期,在田间自然条件下对RIL群体及其亲本进行条锈菌混合生理小种的条锈病抗性鉴定。于2018和2019年的10月中旬,将RIL群体及其亲本种植在贵州省农业科学院贵阳基地(26°29′ N,106°39′ E);于2019年11月初,将RIL群体及其亲本种植在四川省成都市双流区试验基地(30°57′ N,103°92′ E),三个环境分别用18GY、19GY和19CD来表示。每个家系种植1行,每行10株,每隔5行种植感病对照品种铭贤169作为诱发行。待铭贤169及感病亲本Avocet S充分发病时,调查并记录条锈病反应型,参照Cheng等的方法,采用0~4级分级标准,其中0~2级为抗病,3~4级为感病。
1.3 混池转录组测序及分析
采用TriZol法分别提取亲本Avocet S和贵协3号的RNA,构建亲本池。根据RIL群体条锈病抗性鉴定结果,从中选取20个抗病家系(反应型为0)建立抗病池(Br),选取20个感病家系(反应型为4)建立感病池(Bs)。每个家系分别取4粒种子播种于花盆中,置于培养箱(温度16~25 ℃,光照16 h,光强22 000 lx)中进行培养,待幼苗长至2叶完全张开时,取每个单株的第二片叶中部(叶长4 cm),采用TriZol法分别提取RNA,等量混合,形成抗、感池。RNA样品检测合格后,用Illumina高通量测序平台NovaSeq 6000进行测序,将得到的各样品的原始数据(raw reads)进行评估,去除测序接头、低质量碱基、空载体等不可信数据后,得到高质量的质控后数据(clean reads),用序列比对软件STAR将其比对到中国春2.0参考基因组上。BSR-Seq数据分析由北京麦美瑞生物科技有限公司合作完成。利用STAR软件将高质量转录组测序数据比对到中国春参考序列上并进行过滤,保留只有唯一比对位置且错配数小于2%的序列比对结果,使用SAM tools软件挖掘可能的变异位点,然后用Perl程序仅保留比对质量大于phred值15、变异质量大于phred值30、只有2种基因型、总深度在6~100 000之间、参考序列基因型深度大于3、变异基因型深度大于3、参考序列基因型深度比例大于5%以及变异基因型深度大于5%的比对结果。
1.4 55K SNP芯片的QTL定位
待RIL群体及其亲本的幼苗长到一叶一心期时,用北京天根生化科技有限公司生产的植物基因组DNA提取试剂盒(DP320)提取DNA。用浓度为1%的琼脂糖凝胶电泳和GelDoxXR凝胶成像系统对提取的DNA进行质量检测,检测合格后的DNA样品利用55K SNP芯片进行基因分型。根据基因型数据的检出率、最小等位基因频率(minor allele frequency,MAF)、杂合率等指标对样品和标记进行基本质控(quality control,QC)。样品QC标准:DQC>0.82,检出率≥85%、杂合率≤10%。标记QC标准:转换类型(Conversion Type)为聚高分辨率(Poly High Resolution)、检出率≥90%、MAF≥4%、杂合率≤10%、等位基因数=2。对经过QC的基因型数据进行标记位点筛选,只保留亲本基因型纯合且有差异的位点。利用JoinMap 4.0的Kosambi函数构建遗传图谱,将遗传重组率相同的标记划分到同一个Bin图谱中。用QTL IciMapping 4.0软件的完备区间作图法(inclusive composite interval mapping,ICIM)进行QTL检测,染色体步长是0.1 cM,逐步回归概率为<0.001,寻找LOD值>2.5的QTL,计算出每个QTL的遗传贡献率和加性效应。
1.5 多态性SSR标记的筛选
根据BSR-Seq的分析结果和小麦55K SNP芯片的检测结果,推断染色体上差异SNP标记分布数目最多、密度最大的区域为贵协3号中抗条锈病基因所在的位置。之后根据Graingenes数据库中目标区域已知的22个SSR标记(https://wheat.pw.usda.gov/)以及利用PrimerServer(http://202.194.139.32/PrimerServer/)在线设计的103个SSR标记进行标记多态性的筛选。SSR标记由南京金斯瑞生物科技有限公司合成。上述标记首先在亲本和抗、感池间进行筛选,获得的多态性标记在RIL群体中进行验证,最终获得6个与目标基因紧密连锁的多态性SSR标记 (表1)。

表1 6个多态性SSR标记的引物信息Table 1 Primer information of six SSR markers
实验采用10.0 μL PCR反应体系,包括模板DNA(80.0 ng·μL)1.0 μL,上、下游引物各(10 μmol·L)1.0 μL,2×Taq pcr mix 5.0 μL,ddHO 2.0 μL。PCR反应程序:94 ℃预变性5 min;94 ℃变性45 s,退火温度视不同引物而定,退火30 s,72℃延伸1 min,35个循环;72 ℃延伸10 min,4 ℃保存。用8.0%非变性聚丙烯酰胺凝胶电泳对扩增产物进行电泳检测,银染显色后观察拍照。
1.6 数据分析
用Excel软件对试验数据进行统计分析,用SPSS软件进行单因素方差分析和相关性分析。定位到的QTL侧翼标记的物理位置和候选基因的相关信息通过小麦多组学网站(http://202.194.139.32)查询;在Graingenes数据库查找已经报道的QTL侧翼标记或基因信息,并与国际小麦基因组测序联盟(IWGSC,http://www.wheatgenome.org/)的中国春参考序列进行比对,获得它们的物理位置;从小麦多组学网站获得中国春的参考基因组注释信息。用基于R语言的绘图包ggplot2(https://ggplot2.tidyverse.org/)和Mapchart 2.32(https://www.wur.nl/en/show/Mapchart.htm)进行QTL峰值示意图和染色体遗传图谱的绘制。
2 结果与分析
2.1 RIL群体及其亲本成株期条锈病抗性的鉴定结果
对227个RIL群体及其亲本在3个环境下进行成株期条锈病抗性鉴定。结果表明,3个环境下RIL群体条锈病表型数据均呈连续分布,群体中抗、感株系的材料个数比值接近1∶1。方差分析结果(表2)显示,环境对条锈病的发生有显著影响。3个环境间的相关系数在 0.337~0.569之间,18GY、19GY与19CD的相关系数均较低,原因可能是四川地区的条锈病小种以CYR34为主,田间流行频率高于贵州地区,病害更严重(表3)。

表2 3个环境下条锈病表型数据的单因素方差分析Table 2 ANOVA for the phenotypic data of stripe rust in RIL population under three environments

表3 3个环境下RIL群体条锈病反应型的相关性分析Table 3 Correlation analysis of stripe rust infection type in RIL population under three environments
2.2 混池转录组测序(BSR-Seq)结果
2.2.1 转录组测序数据质量控制分析
对亲本池和抗、感池分别进行转录组测序,结果(表4)表明,原始数据包含144 240 863个reads,质控后数据有139 976 742个reads,有效率为96.37%~98.11%,GC含量为57.00%~ 58.27%,质量值Q20在98.16%~98.36%之间,Q30在94.41%~94.88%之间。
2.2.2 差异SNP的数目和位置
利用RIL群体的BSR-Seq分析结果,在小麦全基因组中共鉴定到277个与条锈病抗性关联的高置信度SNP或Indel。其中,2AS染色体末端上的SNP数目最多,为258个,占全部SNP总数的93.1%,有8个差异SNP位于2AL、3BL、4BS、5AL和6BS染色体上,有11个差异SNP未被定位在染色体上。因此,推测目标基因位于2AS染色体末端的12.0~59.0 Mb区间。
2.3 遗传图谱构建结果
利用小麦55K SNP芯片对227个RIL群体及其亲本进行全基因组基因分型。对于杂合率大于10%的群体株系进行了过滤,去除了23个样品DNA,剩余有效基因型样本数为204个。在约53 000个SNP中,有16 155个SNP在两个亲本之间具有多态性,过滤后剩余15 559个SNP,其中14 486个SNP有物理位置。利用Joinmap 4.0构建遗传连锁图谱时,剔除不连锁的分子标记,最终用于作图的标记数为6 364个。构建的遗传连锁图谱覆盖了小麦21条染色体(图1和表5),图谱总长度为4 363.9 cM,标记密度为1.5 cM。其中,3A染色体的长度最长(333.0 cM),6A染色体的长度最短(33.5 cM)。2A染色体的标记密度最大,为3.2 cM,其遗传图谱长度为258.3 cM。
从小麦A、B、D三个基因组来看,B基因组上的标记数最多,为2 744个,占总标记数的 43.1%,D基因组上的标记数最少,为1 083个,占总标记数的17.0%;从小麦七个同源群来看,第二同源群的标记数最多,为1 313个,占总标记数的20.6%,第六同源群的标记数最少,为513个,占总标记数的8.1%;从小麦21条染色体看,平均每条染色体上有303个标记,其中2A染色体上的标记数最多,为828个,占总标记数的 13.0%,6A染色体上的标记数最少,为48个,占总标记数的0.7%(表5)。
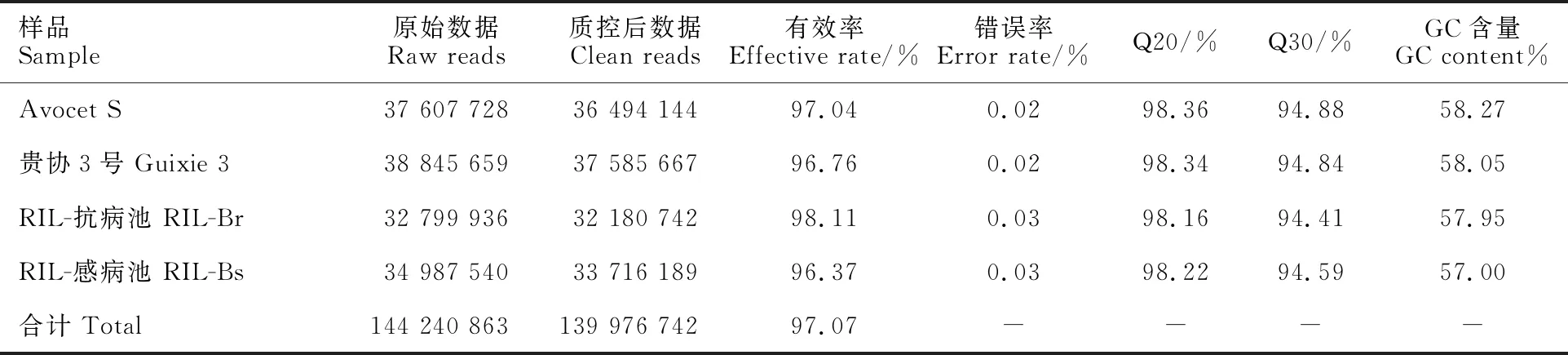
表4 转录组数据产出质量情况Table 4 Quality of RNA-Seq data

每条染色体内的黑、灰色代表标记所在的位置,颜色越深表明该位置的标记数越多;白色代表没有连锁标记的区间。
2.4 抗条锈病QTL的定位结果
根据小麦55K SNP芯片的基因型数据和条锈病表型鉴定数据,利用QTL IciMapping 4.0进行条锈病抗性QTL的定位。结果共检测到7个抗条锈病QTL,分别分布在1B(1)、2A(2)、2D(1)、5A(2)和6B(1)染色体上,其中可在3个环境中被检测到,其位于2AS染色体0.00~2.47 cM的遗传区间内,物理区间为15.87~31.89 Mb(16.02 Mb),其3年的LOD值变化范围为9.79~14.62,标记区间为AX-108824773~AX-111675237,可解释的表型变异率为17.07%~34.59%,是一个稳定的主效QTL(表6)。、、和仅在19CD环境下检测到,LOD值变化范围为2.79~ 6.65,可解释的表型变异率为4.48%~11.58%。仅在18GY环境下检测到,LOD值为 3.62,可解释的表型变异率是5.50%。仅在19GY环境下检测到,LOD值为 3.39,可解释的表型变异率为7.29%。除的加性效应来自母本Avocet S外,其他6个QTL的加性效应均来自父本贵协3号。
2.5 多态性引物的筛选结果
根据QTL定位结果和转录组数据,在2AS染色体的目标区段内设计了103对SSR标记引物,同时从GrainGenes数据库上选择了该区段内已报道的22对SSR标记引物。利用这125对标记引物对亲本和抗、感池进行多态性标记筛选,最终获得6个与抗条锈病位点紧密连锁的SSR标记,分别为Xcfd36、Xwmc382、hls-2A-04、hls-2A-17、hls-2A-18和hls-2A-103,这些SSR标记在亲本和抗、感池中的筛选结果如图2所示。进一步在RIL群体中随机选取40个株系材料进行验证,发现这些标记均能较好地区分抗、感株系(图3),因此可用于进一步的图谱加密。
将6个多态性SSR标记在RIL群体中的基因分型结果与55K SNP芯片检测结果整合,利用QTL IciMapping 4.0软件重新进行连锁分析,并用Mapchart V2.3.0重新绘制2AS染色体的遗传图谱(图5)。综合3个环境的结果表明,被定位到2AS染色体1.70~4.11cM的遗传区间,标记区间为hls-2A-103~AX-108824773,对应的物理区间为15.87~18.91 Mb(3.04 Mb)。说明抗条锈病位点的定位区间从16.02 Mb缩小到3.04 Mb的物理区间内(表7)。
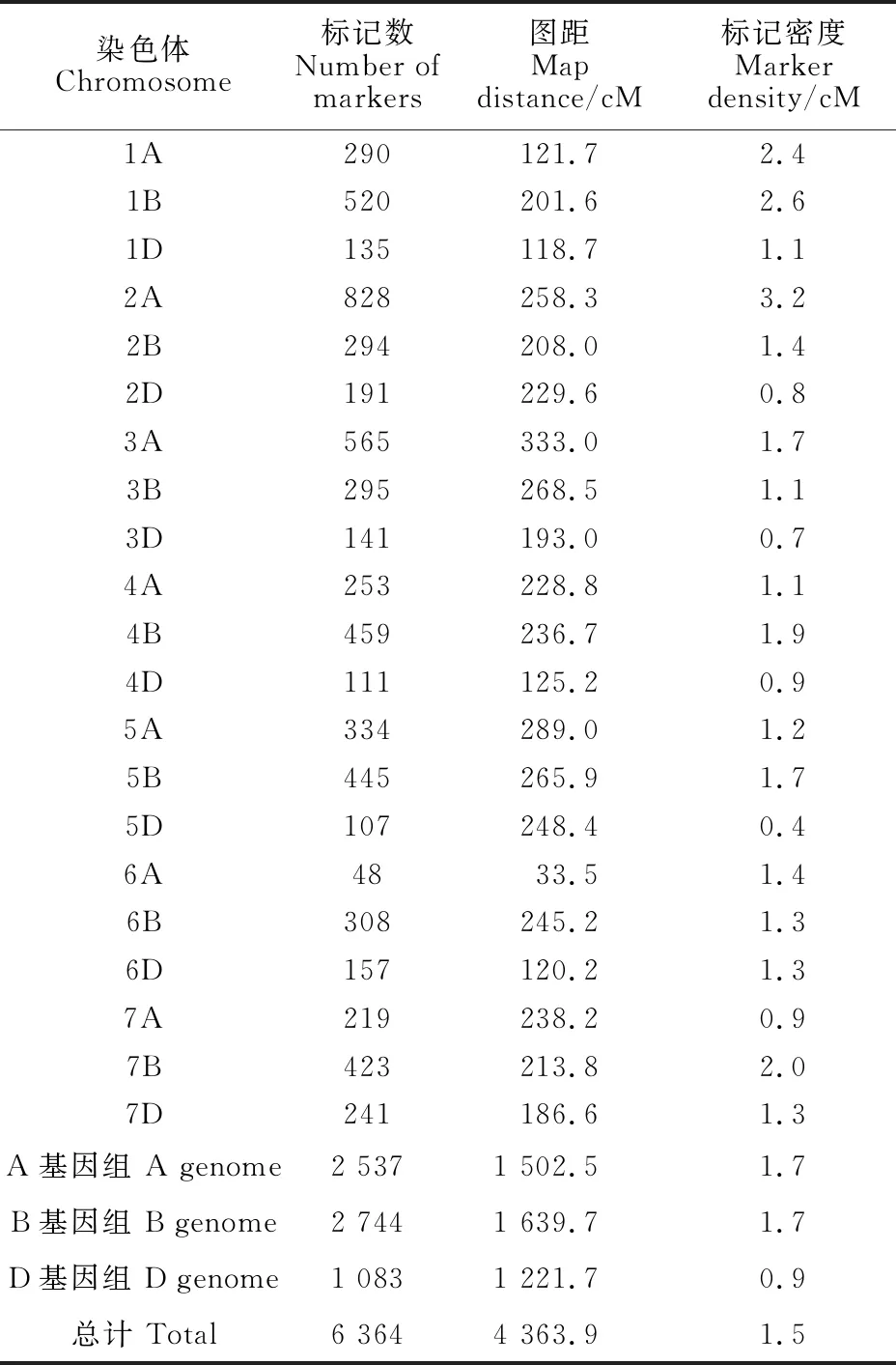
表5 RIL群体的21条染色体图谱长度及SNP标记密度Table 5 Mapping length and SNP marker density on the 21 chromosomes of RIL population
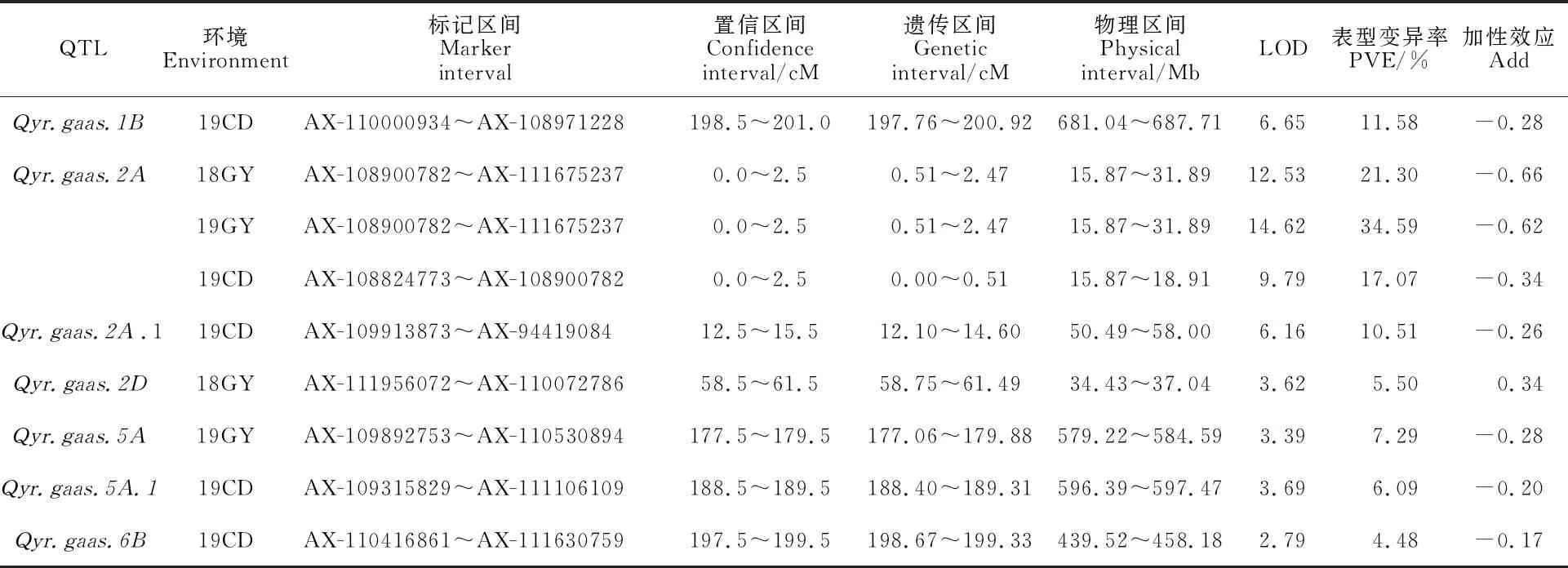
表6 3个环境下检测到的抗条锈病QTLTable 6 QTLs for stripe rust resistance detected under three environments
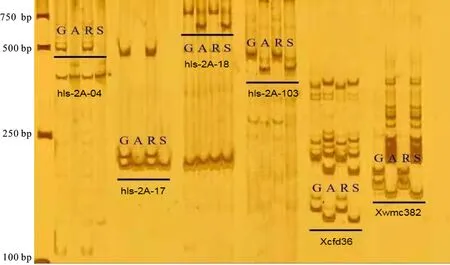
G:贵协3号;A:Avocet S;R:抗病池;S:感病池。
2.6 候选基因预测分析
根据上述结果,贵协3号中的抗条锈病位点被定位于2AS染色体15.87~ 18.91 Mb的物理区间范围内。利用小麦多组学网站与中国春2.0版本进行比对,识别小麦基因ID、注释及相应序列。结果在上述区间内共预测到13个候选基因(表8),其中TraesCS2A02 G042400.1与抗病蛋白(NBS-LRR)相关,TraesCS2A02G040300.1与糖基转移酶相关,TraesCS2A02G041200.1与谷胱甘肽S转移酶相关。
3 讨 论
3.1 抗条锈病基因的遗传定位
本研究利用BSR-seq技术,将贵协3号抗条锈病位点初步定位于2AS染色体12.0~59.0 Mb的物理区间内(约47.0 Mb);而利用小麦55K SNP芯片则将定位到更小的物理区间(约16.02 Mb),该区间包含在BSR-seq的定位区间内,这说明55K SNP芯片技术的定位结果更加精确。
目前,在2AS染色体上已报道的抗条锈病基因有、、、和。其中,来源于硬粒小麦Wollaro,来源于美国软红粒小麦Pioneer 26R61。是从人工小麦渗入系CH7086中定位到的苗期抗条锈病基因,其抗性来源于彭提卡偃麦草。的抗病性来源于普通小麦品种中麦175。推测与、、和不同。来源于偏凸山羊草(),是一个苗期抗病基因,携带该基因的单基因系表现为高感,研究发现,载体品种Trident对CYR34小种表现为高感;但通过田间观察发现,另一个载体品种VPM1对CYR34小种表现为中抗,推测VPM1中可能不仅含有,还含有其他未知的抗条锈病基因。Wang等报道,和也是基因的等位变异。为了明确和之间的差异,我们利用的特定CAPS标记URIC/LN2无法在贵协3号中扩增出标记目标条带,所以推测与不同。为了进一步明确贵协3号中的与上述基因/QTL的相关性,还需要利用等位性检测等手段进行判定。
3.2 候选基因预测分析
目前,已经克隆的多个小麦锈病基因均具有NBS-LRR结构,例如小麦抗条锈病基因和,抗叶锈病基因和,以及抗秆锈病基因和等。本研究根据所在2AS染色体末端 15.87~18.91 Mb的区间范围,共预测到13个候选基因,其中TraesCS2A02G042400.1与抗病蛋白(NBS-LRR)相关,推测其可能是的候选目的基因。TraesCS2A02G040300.1与糖基转移酶相关,糖基转移酶在植物抗病过程中不仅可通过修饰植物激素来调节植物抗病能力,还是植物超敏反应抵御病害的必要因素。前人研究发现,UDP-糖基转移酶(UGT)通过将小麦中的脱氧雪腐镰刀菌烯醇(DON)糖基化为DON-3-葡萄糖苷(D3G),有助于增强赤霉病的抗性。值得注意的是,TraesCS2A02G041200.1与谷胱甘肽S转移酶相关,而小麦抗赤霉病基因可编码一种谷胱甘肽S-转移酶(GST),所以这两个基因也有可能是的候选基因。后期我们将继续开发新的标记,扩大遗传作图群体,构建剩余杂合群体,实现抗条锈病位点的精细定位,进一步缩减目标区段,最终确定目标基因。
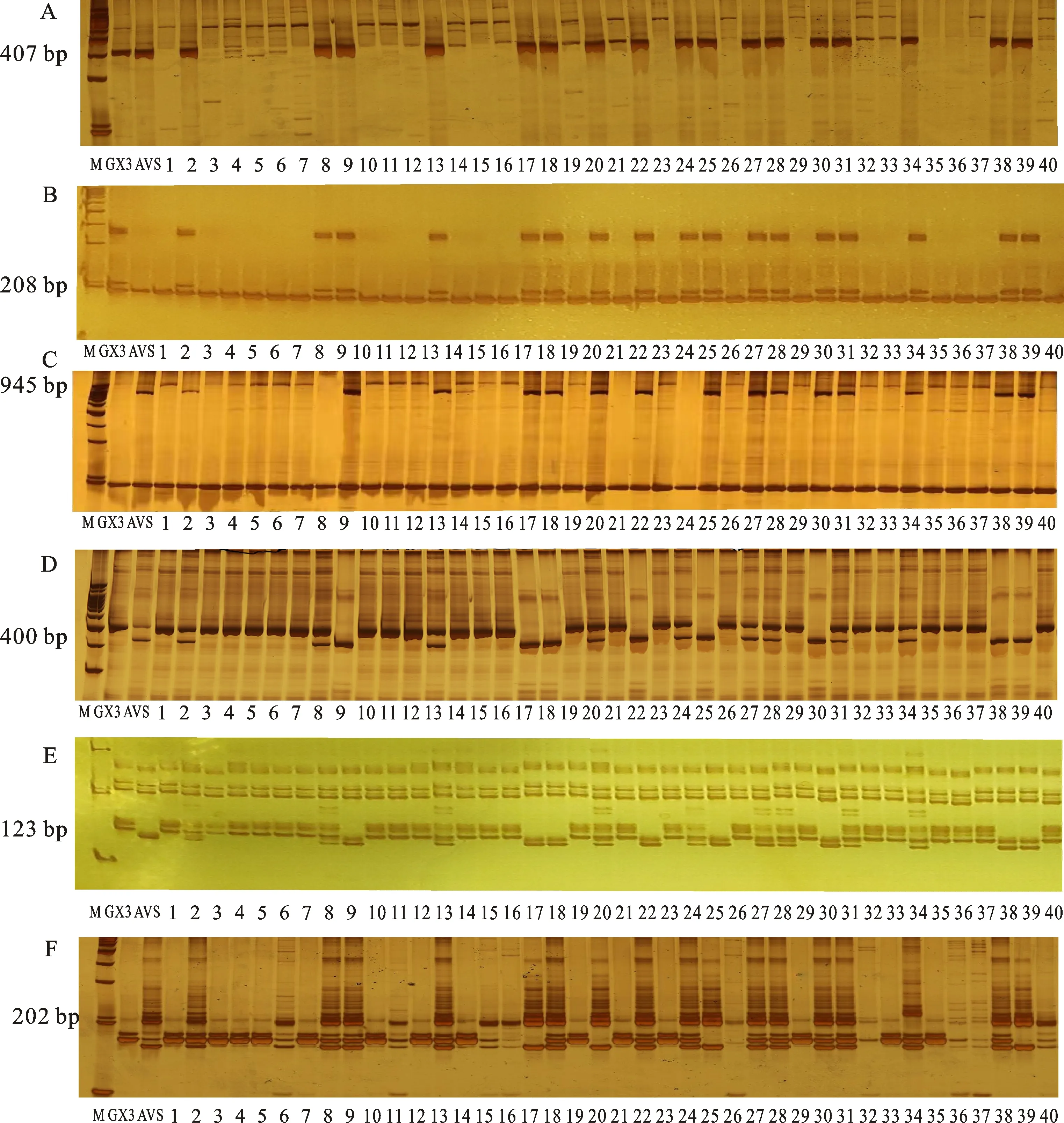
A~F分别代表6个多态性标记hls-2A-04、hls-2A-17、hls-2A-18、hls-2A-103、Xcfd36和Xwmc382,M代表标记DL2000,GX3代表贵协3号,AVS代表Avocet S,1~40代表RIL群体内随机挑选的40个家系。
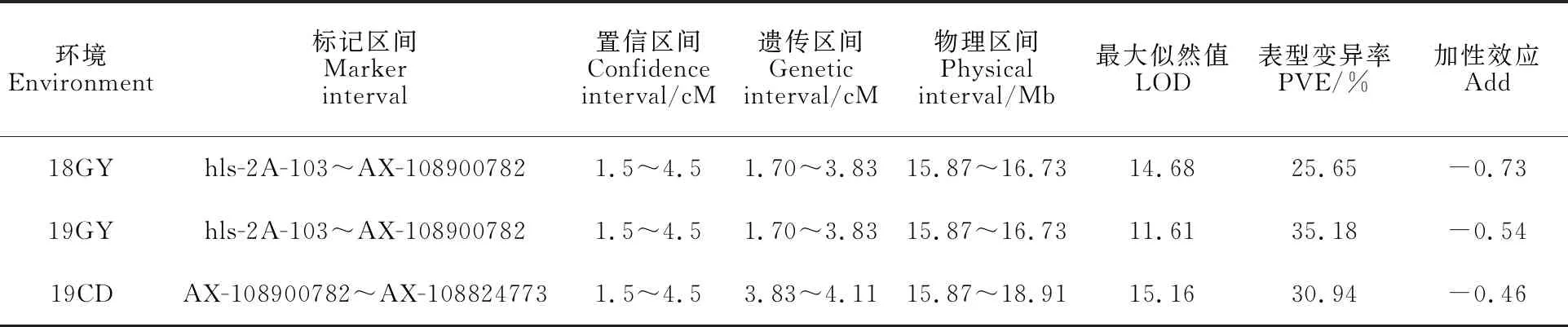
表7 利用开发的SSR标记重新定位 Qyr.gaas.2ATable 7 Relocation of Qyr.gaas.2A using the developed SSR markers
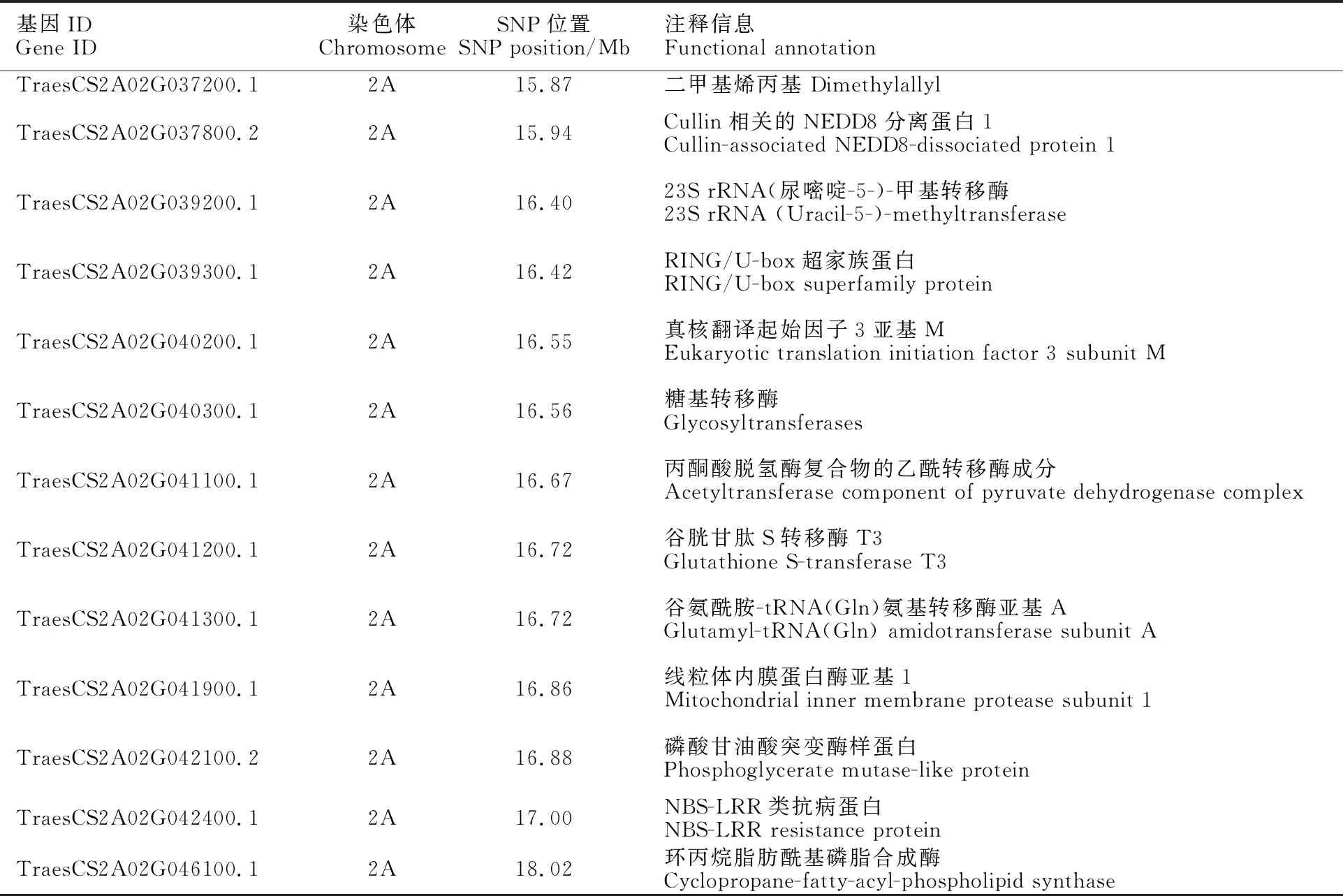
表8 候选区间内差异SNP的小麦基因功能注释Table 8 Functional annotation of wheat genes with differential SNPs in candidate intervals
