视网膜色素上皮细胞 LncRNA MEG3在不同葡萄糖浓度下的表达情况及对VEGF和 TGF-β1表达的影响△
2022-08-07张达宁秦海翔李相军石盛玲王敬怡卢奕安张富程
张达宁 冷 瀛 秦海翔 李相军 白 丹 石盛玲 王敬怡 卢奕安 张富程 陈 艳
视网膜色素上皮(RPE)细胞位于视网膜神经上皮层外,功能复杂,代谢活跃,可以分泌多种细胞因子[1-2],其中血管内皮生长因子(VEGF)、转化生长因子β1(TGF-β1)是糖尿病视网膜病变的主要致病因子[3-4]。过量的生长因子刺激纤维和血管的增生,甚至RPE细胞本身发生间质细胞转化,成为增殖膜的组成部分[5]。目前抗VEGF药物已广泛应用于临床并取得了令人瞩目的疗效,但普遍存在疗效持续时间短,需反复手术行玻璃体内注射等问题。能不能找到RPE细胞在糖尿病状态下生成VEGF、TGF-β1的调控机制,延长治疗效果是目前科研工作者努力的方向。Sun等[6]研究发现,长链非编码RNA母系表达基因3(LncRNA MEG3)通过促进FOXM1泛素化而降低VEGF的表达,可能是调控VEGF的重要因子。那么LncRNA MEG3在RPE细胞中的表达情况,是否参与调控RPE细胞对VEGF、TGF-β1的分泌,继而影响糖尿病视网膜病变的发展呢?本研究在不同葡萄糖浓度条件下培养RPE细胞,模拟糖尿病环境,探讨高血糖对RPE细胞LncRNA MEG3表达的影响,并探讨LncRNA MEG3对VEGF mRNA和VEGF蛋白、TGF-β1 mRNA和TGF-β1蛋白表达的调控作用,希望为糖尿病视网膜病变基因治疗提出新的依据。
1 材料与方法
1.1 材料
1.1.1 细胞系及细胞培养人RPE细胞系(ARPE-19)由上海酶研生物科技公司提供。细胞培养液选用含体积分数10%胎牛血清、0.1 U·L-1青霉素、0.1 g·L-1链霉素的低糖型DMEM培养液(美国Gibco公司),置于37 ℃、体积分数5%CO2的培养箱中进行培养,2~3 d更换新培养液,细胞融合度达80%~90%后进行传代培养。取对数生长期的细胞进行后续实验。
1.1.2 LncRNA MEG3过表达细胞株的建立选用哺乳动物常用质粒PCDNA3.1,将LncRNA MEG3 DNA插入PCDNA3.1质粒得到LncRNA MEG3表达载体(上海吉玛公司)。ARPE-19细胞提前24 h接种于24孔培养板,密度为每孔2×105个,并改换不含抗生素的DMEM培养液,以免降低转染率。培养密度达到60%~80%,保证细胞密度不能过大,给予细胞足够的分裂空间。使用转染试剂LipofectamineTM2000(美国Invitrogen公司)转染PCDNA-MEG3质粒,得到LncRNA MEG3过表达的ARPE-19细胞。同样使用LipofectamineTM2000转染空质粒PCDNA-NC,得到转染空质粒的ARPE-19细胞。其余ARPE-19细胞加入PBS做对照。所得细胞均培养48 h后用于后续实验。
1.2 方法
1.2.1 细胞分组与形态学观察ARPE-19细胞培养至对数生长期,随机分为5 mmol·L-1d-葡萄糖组、15 mmol·L-1d-葡萄糖组、30 mmol·L-1d-葡萄糖组,分别以含相应浓度d-葡萄糖的DMEM培养液培养。各组ARPE-19细胞分别置于6孔板中培养,倒置显微镜下观察ARPE-19细胞形态。
1.2.2 RNA的提取1.2.1中3组ARPE-19细胞分别培养24 h、48 h后,采用Trizol法提取各组细胞中的总RNA。按每10 cm2培养皿面积加入1 mL Trizol试剂(美国Invitrogen公司)计算,细胞充分裂解,加入氯仿抽提,离心后提取水相中的总RNA,氯丙醇沉淀,酒精充分洗涤。以Nanodrop 2000 分光光度计检测RNA纯度及浓度。
1.2.3 实时荧光定量PCR检测RNA的表达1.2.1中3组ARPE-19细胞总RNA提取后,应用实时荧光定量PCR(RT-qPCR)法分别检测各组细胞LncRNA MEG3、VEGF mRNA、TGF-β1 mRNA的相对表达水平。首先Prime Script RT reagent kit反转录试剂盒(日本Takara公司)将RNA反转录合成cDNA。RT-qPCR反应选用SYBR Premix Ex TaqTM套盒(日本Takara公司)。目标RNA为LncRNA MEG3、VEGF mRNA、TGF-β1 mRNA。LncRNA MEG3引物序列:上游引物为5’-GCATTAAGCCCTGACCTTTG-3’;下游引物为5’-TCCAGTTTGCTAGCAGGTGA-3’。VEGF mRNA引物序列:上游引物为5’-AAATGCTTTCTCCGCTCTGA-3’;下游引物为5’-CCCACTGAGGAGTCCAACAT-3’。TGF-β1 mRNA引物序列:上游引物为5’-CCCAGCATCTGCAAAGCTC-3’;下游引物为5’-GTCAATGTACAGCTGCCGCA-3’。以β-actin作为内参基因:上游引物为 5’-GACCTCTATGCCAACACAGT-3’;下游引物为5’-AGTACTTGCGCTCAGGAGGA-3’ 。PCR 反应条件:95 ℃ 30 s,此后95 ℃ 5 s、55 ℃ 30 s、72 ℃ 30 s进行40个循环。使用2-ΔΔCt法计算相对表达量。
1.2.4 Western blot检测各组ARPE-19细胞VEGF、TGF-β1蛋白相对表达情况构建LncRNA MEG3过表达ARPE-19细胞株后,以含30 mmol·L-1d-葡萄糖的DMEM培养液分别培养不同细胞并分组:LncRNA MEG3过表达ARPE-19细胞,设为过表达组(O组);转染空质粒的ARPE-19细胞,设为空质粒组(NC组);加入PBS的正常ARPE-19细胞,设为高糖对照组(G组);同时以含5 mmol·L-1d-葡萄糖的DMEM培养液加入正常ARPE-19细胞,设为低糖对照组(C组)。以上各组细胞培养24 h后,Western blot检测各组细胞中VEGF及TGF-β1蛋白相对表达水平。首先采用RIPA细胞裂解缓冲液(美国Clontech公司)从体外培养的ARPE-19中提取总蛋白。BCA进行蛋白定量,取2份蛋白样本,每份20 μg,分别使用100 g·L-1SDS-PAGE凝胶电泳,电转印至PVDF膜,50 g·L-1脱脂奶粉室温封闭60 min,TBST溶液冲洗后分别加入一抗[兔抗VEGF抗体(稀释度12000,ab46154)、兔抗TGF-β1 抗体(稀释度12000,ab9758)、抗-GAPDH 抗体(稀释度11000,ab9485)(英国Abcam公司)],于4 ℃培养过夜。漂洗后,分别加入二抗[羊抗兔 IgG-HRP(美国Jachson Immuno Research公司)]室温1 h。漂洗后ECL 化学发光显色试剂(美国Thermos fisher science公司)显色。采用ImageJ 软件分析各蛋白相对灰度,以GAPDH作为内参。

2 结果
2.1 不同浓度葡萄糖对ARPE-19细胞LncRNA MEG3表达的影响倒置显微镜下观察可见,5 mmol·L-1d-葡萄糖组与低糖型DMEM培养液葡萄糖浓度相似,在培养过程中ARPE-19细胞形态无明显变化;15 mmol·L-1d-葡萄糖组、30 mmol·L-1d-葡萄糖组ARPE-19细胞在高糖环境中培养48 h,细胞形态也未出现明显变化(图1)。RT-qPCR法检测各组ARPE-19细胞LncRNA MEG3表达情况,结果表明,细胞培养至24 h、48 h,与5 mmol·L-1d-葡萄糖组比较,15 mmol·L-1d-葡萄糖组和30 mmol·L-1d-葡萄糖组ARPE-19细胞LncRNA MEG3相对表达水平均降低,差异均有统计学意义(均为P<0.05);与15 mmol·L-1d-葡萄糖组比较,30 mmol·L-1d-葡萄糖组ARPE-19细胞LncRNA MEG3相对表达水平显著降低,差异有统计学意义(P<0.05)。与培养24 h比较,15 mmol·L-1d-葡萄糖组和30 mmol·L-1d-葡萄糖组培养48 h时的ARPE-19细胞LncRNA MEG3相对表达水平均显著降低,差异均有统计学意义(均为P<0.05)。5 mmol·L-1d-葡萄糖组培养24 h与48 h ARPE-19细胞LncRNA MEG3相对表达水平差异无统计学意义(P>0.05)(图2)。提示随着葡萄糖浓度增高,ARPE-19细胞中LncRNA MEG3相对表达水平下降,并随培养时间延长表达水平显著下降。

图1 不同浓度葡萄糖组培养48 h ARPE-19细胞形态(×100) A:15 mmol·L-1 d-葡萄糖组;B:30 mmol·L-1d-葡萄糖组。
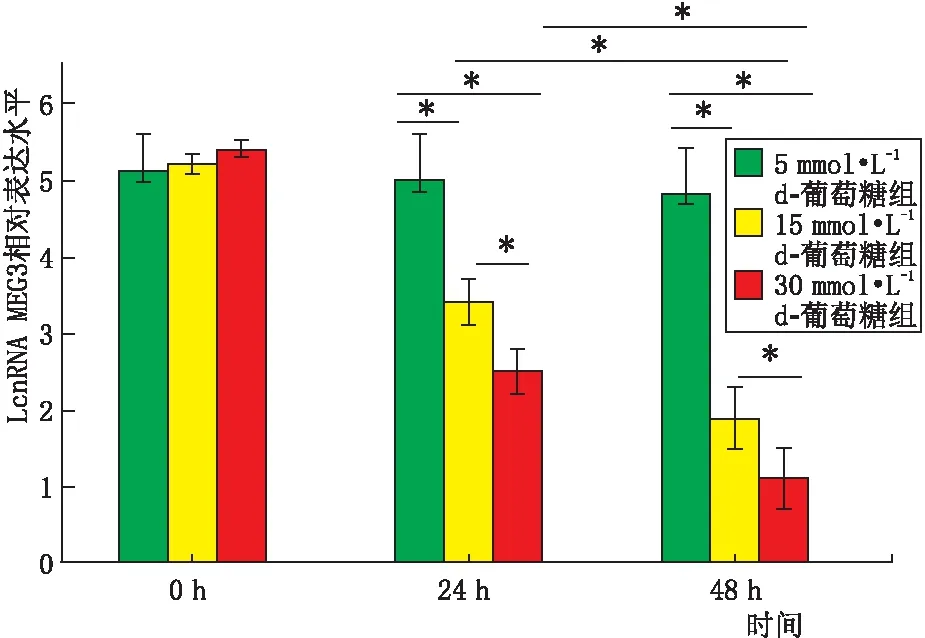
图2 不同浓度葡萄糖组ARPE-19细胞LncRNA MEG3相对表达水平 两组间比较,*P<0.05。
2.2 葡萄糖浓度对ARPE-19细胞VEGF mRNA、TGF-β1 mRNA表达的影响RT-qPCR法检测各组ARPE-19细胞VEGF mRNA和TGF-β1 mRNA表达,结果表明,细胞培养至24 h、48 h,与5 mmol·L-1d-葡萄糖组比较,15 mmol·L-1d-葡萄糖组和30 mmol·L-1d-葡萄糖组ARPE-19细胞VEGF mRNA和TGF-β1 mRNA相对表达水平均升高,差异均有统计学意义(均为P<0.05);与15 mmmol·L-1d-葡萄糖组比较,30 mmol·L-1d-葡萄糖组ARPE-19细胞VEGF mRNA和TGF-β1 mRNA相对表达水平升高更显著,差异均有统计学意义(均为P<0.05)。与培养24 h比较,15 mmol·L-1d-葡萄糖组和30 mmol·L-1d-葡萄糖组ARPE-19细胞培养48 h VEGF mRNA和TGF-β1 mRNA相对表达水平均显著升高,差异均有统计学意义(均为P<0.05)。5 mmol·L-1d-葡萄糖组培养24 h与48 h ARPE-19细胞VEGF mRNA和TGF-β1 mRNA相对表达水平差异均无统计学意义(均为P>0.05)(图3)。提示随着葡萄糖浓度增加,ARPE-19细胞VEGF mRNA、TGF-β1 mRNA相对表达水平均升高,并随培养时间延长相对表达水平显著升高。

图3 不同浓度葡萄糖组ARPE-19细胞VEGF mRNA、TGF-β1 mRNA相对表达水平 A:各组ARPE-19细胞VEGF mRNA相对表达水平;B:各组ARPE-19细胞TGF-β1 mRNA相对表达水平。1组:5 mmol·L-1d-葡萄糖组,2组:15 mmol·L-1d-葡萄糖组,3组:30 mmol·L-1d-葡萄糖组。两组间比较,*P<0.05 。
2.3 LncRNA MEG3过表达对ARPE-19细胞VEGF、TGF-β1表达的影响C组、G组、NC组、O组ARPE-19细胞培养24 h后,RT-qPCR法检测各组ARPE-19细胞VEGF mRNA和TGF-β1 mRNA相对表达水平,结果表明,与C组比较,G组、NC组和O组ARPE-19细胞VEGF mRNA和TGF-β1 mRNA相对表达水平均明显升高,差异均有统计学意义(均为P<0.05);G组和NC组间比较差异无统计学意义(P>0.05);而与G组和NC组比较,O组ARPE-19 VEGF mRNA和TGF-β1 mRNA相对表达水平均降低,差异均有统计学意义(均为P<0.05)(图4A、图5A)。Western blot法检测各组ARPE-19细胞VEGF蛋白和TGF-β1蛋白相对表达水平,结果表明,与C组比较,G组、NC组和O组ARPE-19细胞VEGF蛋白和TGF-β1蛋白相对表达水平均升高,差异均有统计学意义(均为P<0.05);G组和NC组间比较差异无统计学意义(P>0.05);与G组和NC组比较,O组ARPE-19细胞VEGF蛋白、TGF-β1蛋白相对表达水平均降低,差异均有统计学意义(均为P<0.05)(图4B、图4C、图5B、图5C)。以上结果证实,MEG3过表达显著降低了30 mmol·L-1d-葡萄糖诱导的VEGF mRNA和蛋白,以及TGF-β1 mRNA和蛋白相对表达水平的升高。

图4 各组ARPE-19细胞VEGF mRNA及蛋白相对表达水平 A:各组ARPE-19细胞VEGF mRNA相对表达水平;B、C:各组ARPE-19细胞VEGF蛋白相对表达水平。两组间比较,*P<0.05。

图5 各组ARPE-19细胞TGF-β1 mRNA及蛋白相对表达水平 A:各组ARPE-19细胞TGF-β1 mRNA相对表达水平;B、C:各组ARPE-19细胞TGF-β1蛋白相对表达水平。两组间比较,*P<0.05。
3 讨论
在人类基因组中仅有约2%的序列具有编码蛋白质的功能,而剩余没有蛋白质编码功能的区域被称为非编码区域。这些非编码区的转录产物曾被认为是无用的物质,但随着对基因研究的深入,发现这些非编码RNA可能在染色质修饰、转录、细胞分化、蛋白质功能调控等多种生物学过程中起到重要的调节作用[7],其中LncRNA被认为参与人类多种疾病的发展,糖尿病视网膜病变的发生也伴随着视网膜细胞LncRNA基因表达谱及表达水平的变化[8-10]。LncRNA MEG3基因位点位于人类染色体14q32.3,长度约为1700个核苷酸,目前研究表明,LncRNA MEG3在很多正常组织中呈高表达,而在很多肿瘤组织中呈低表达[11-13]。LncRNA MEG3与VEGF、HIF-α等多种因子的调控有关[14]。Liu等[15]在缺血性脑损伤研究中报道,LncRNA MEG3表达水平降低可导致脑血管生成加快。Zhan等[16]研究显示,LncRNA MEG3可调控TGF-β1介导的 P13K/AKT途径。这一系列研究证明,LncRNA MEG3可能是调控VEGF和TGF-β1的关键因子。
VEGF和TGF-β1在糖尿病视网膜病变中同样起着非常重要的作用,促进视网膜新生血管的生成,导致出血和渗出。本研究应用不同葡萄糖浓度的DMEM培养ARPE-19细胞,模拟糖尿病患者视网膜组织的高糖环境,探讨LncRNA MEG3在视网膜组织中的表达情况,结果显示,在各组ARPE-19细胞中均可检出IncRNA MEG3,证明ARPE-19细胞存在LncRNA MEG3的转录。而随着葡萄糖浓度升高,LncRNA MEG3表达水平则明显降低,且呈时间及浓度依赖性,这说明葡萄糖浓度增加下调ARPE-19细胞LncRNA MEG3的转录水平。在糖尿病患者视网膜中RPE细胞可能受到高血糖的影响而导致LncRNA MEG3表达量降低,并随病程延长而加重。
同时我们检测了不同葡萄糖浓度的DMEM培养下ARPE-19细胞VEGF mRNA、TGF-β1 mRNA的相对表达水平,结果显示,随着葡萄糖浓度的升高和培养时间的延长,VEGF mRNA、TGF-β1 mRNA的相对表达水平均升高,与对照组比较,30 mmol·L-1d-葡萄糖培养ARPE-19细胞48 h,VEGF mRNA增加约5倍,TGF-β1 mRNA增加约7倍,证实葡萄糖浓度升高上调ARPE-19细胞VEGF及TGF-β1的表达。高血糖患者视网膜VEGF及TGF-β1表达升高促进视网膜新生血管增殖,这是糖尿病视网膜病变进入增殖期的标志,严重影响患者的视功能。
为进一步探讨LncRNA MEG3与VEGF及TGF-β1之间的调控关系,我们构建了LncRNA MEG3过表达ARPE-19细胞,其结果证实LncRNA MEG3过表达的ARPE-19细胞在高糖环境中VEGF mRNA和VEGF蛋白,TGF-β1 mRNA和TGF-β1蛋白表达水平较普通ARPE细胞明显降低。这一结果提示LncRNA MEG3对RPE细胞VEGF、TGF-β1的表达产生负向调控作用,这与Su等[17]发现的LncRNA MEG3的表达水平与VEGF的表达水平呈负相关相一致。
综上所述,在糖尿病视网膜病变发生发展的过程中,增高的血糖能够诱导RPE细胞LncRNA MEG3的表达水平下调,并随着血糖的升高以及病程的延长下调加重。上调LncRNA MEG3可能通过抑制VEGF和 TGF-β1的表达减轻视网膜新生血管的发生,调控糖尿病视网膜病变的发展进程。本研究使我们加深了对糖尿病视网膜病变发生的基因基础的了解,为早日攻克这一高发的致盲眼病提出了新的思路。
