子宫内膜癌中LRP16的表达及临床病理分析
2022-08-06唐明洋黄园莉张光辉
朱 清,唐明洋,黄园莉,张光辉,赵 艳
子宫内膜癌是女性生殖系统常见的恶性肿瘤,其主要发病原因可能与长期的雌激素刺激有关[1-2],而与雌激素关系紧密的白血病相关蛋白LRP16是从健康成人外周血淋巴细胞中克隆的基因,该基因在人类多种肿瘤细胞中高表达,且与雌二醇的调控有关[3-4]。短发夹RNA(short hairpin RNA, shRNA)是可以克隆到表达载体并表达短的干扰RNA(small interfering RNA, siRNA)的DNA分子,可根据靶向基因LRP16设计shRNA序列,并将其克隆到特定载体上[5]。本文旨在探讨LRP16在子宫内膜癌中的表达及其与临床病理特征的关系;通过RNA干扰下调人子宫内膜癌细胞株(Ishikawa, ISK)中LRP16基因的表达,分析其对子宫内膜癌细胞增殖、侵袭和迁移能力的影响。
1 材料与方法
1.1 临床资料收集2015年1月~2016年12月蚌埠医学院第一附属医院病理科存档的子宫内膜癌组织160例,术后经常规病理组织检查证实均为雌激素依赖型(即子宫内膜样癌);另选取60例正常子宫内膜组织(为子宫内膜活检或其他良性疾病中获取)作对照。本实验经蚌埠医学院第一附属医院伦理委员会批准,患者均知情同意。
1.2 细胞株及主要试剂人子宫内膜癌细胞株ISK、逆转录试剂盒、PCR试剂盒,购自上海吉玛公司。LRP16-shRNA表达载体(Santa Cruz Biotechnology, Inc.sc-149046-SH);DMEM(高)培养液、胎牛血清(Hyclone)、PBS平衡液;LRP16抗体(Abcam公司、ab122688);β-actin抗体(Abcam公司、ab8229)。Lipofectamine 2000、Trizol试剂,购自Invitrogen公司。CCK-8试剂、Transwell小室,购自上海碧云天公司。结合基质胶Matrigel购自BD公司。
1.3 方法
1.3.1免疫组化 标本经10%中性福尔马林固定,连续4 μm厚切片,脱蜡,免疫组化采用EliVision染色。切片在柠檬酸盐溶液中121 ℃ 3 min进行抗原修复,自然冷却后在3%H2O2溶液中静置10 min,添加一抗LRP16兔抗人60 ℃ 1 h,PBS冲洗3次×3 min,二抗37 ℃ 30 min,PBS冲洗后DAB显色,苏木精复染后经梯度乙醇脱水,二甲苯透明,中性树胶封固,镜下观察。结果以胞质或胞核内出现黄色颗粒为阳性信号,对细胞染色强度和阳性细胞百分比进行综合评分[6]。使用Image-Pro Plus软件进行图像分析,以累积光密度(integrated optical density, IOD)/面积值判断LRP16蛋白的表达。
1.3.2细胞培养 在37 ℃、5%CO2培养箱中培养ISK细胞,细胞贴壁生长。每2~3天传代1次。传代时先弃去旧培养基,用PBS洗涤2~3次,加入胰蛋白酶消化细胞,加入培养基吹打细胞,重置细胞液接种于培养瓶。实验选取对数生长期的细胞。
1.3.3shRNA干扰载体构建 shRNA序列:siLRP16组:5′-GATCCCGCAGCGGGAGGAACATTACT TCAAGAGAGTAATGTTCCTCCCGCTGCTTTTTTGGAA A-3′;对照组:5′-AGCTTTTCCAAAAAAGCAGCGG GAGGAACATTACTCTCTTGAAGTAATGTTCCTCCCGC TGCGG-3′。
1.3.4细胞转染及分组 将ISK细胞按3×105个/孔接种于6孔板,待细胞密度达70%~80%时按Lipofectamine 2000试剂说明书进行转染,孵育48 h,将siLRP16(50 nmol/L)转染入ISK细胞。转染4 h后换完全培养基继续培养24 h。实验分组:实验组(转染siLRP16)、阴性对照组(转染无序RNA)、空白对照组(不转染)。
1.3.5Western blot法 转染后48 h收集各组细胞提取的蛋白,经10%聚丙烯胺凝胶分离。制备分离胶和积层胶,每孔加入等量蛋白样本电泳和封闭。将膜置于一抗(LRP16稀释比为1 ∶200;β-actin稀释比为1 ∶500)中,振荡2 h后放置4 ℃冰箱过夜;放入TBST溶液中洗膜3次×10 min,在二抗(辣根过氧化物酶标记的羊抗兔IgG,稀释比为1 ∶2 000)中温和振荡2 h,置于TBST溶液中洗膜3次×10 min。加入化学发光底物A+B,用凝胶成像仪扫描入计算机,结果用Quantity One软件分析,以LRP16蛋白与β-actin蛋白条带平均值的比值表示,实验重复3次。
1.3.6RT-PCR 细胞转染后48 h,用Trizol试剂提取各组细胞总RNA,用紫外分光光度计定量。逆转录反应取5 μg总RNA进行。LRP16基因引物序列:上游5′-CCGCAGCGACATCACCAAGC-3′,下游5′-TCCGGCACTCGTCGGTAAGC-3′;β-actin引物序列:上游5′-AAAGACCTGTACGCCAACAC-3′,下游5′-GTCATACTCCTGCTTGCTGAT-3′。PCR扩增反应后取5 μL PCR产物进行凝胶电泳30 min,在紫外灯下观察DNA条带,并用凝胶图像处理系统进行拍照、灰度值分析。
1.3.7CCK-8实验 选取对数生长期的细胞,将细胞密度调整为每毫升5×104个细胞,接种于96孔板中,每孔中放置150 μL细胞液孵育24 h后转染,分别于24、48、72、96、120 h向各孔内加入20 μL的CCK-8试剂继续培养6 h。在450 nm处用酶标仪测定各孔的光密度(optical density, OD)值,实验重复3次。
1.3.8Transwell细胞侵袭和迁移实验 侵袭实验:将每孔50 μL结合基质胶均匀地铺在Transwell小室膜上,各组细胞转染48 h后将细胞消化成细胞悬液,细胞密度调整为每毫升4×105个细胞,将Transwell小室中200 μL细胞悬液置于24孔板培养基中,24 h后取出Transwell小室,用棉签擦拭滤膜上层细胞经甲醇固定20 min,0.1%结晶紫溶液染色20 min,于显微镜下计数每膜15个随机视野下透过膜的细胞数平均值,每组设3个小室,实验重复3次。迁移实验Transwell小室膜上不铺结合基质胶,其余步骤同侵袭实验。

2 结果
2.1 子宫内膜癌和正常子宫内膜组织中LRP16蛋白的表达LRP16蛋白主要定位于细胞质或细胞核。免疫组化结果显示,正常子宫内膜组织中细胞质或细胞核内阳性减弱甚至阴性,子宫内膜癌组织中细胞质或细胞核呈阳性,正常子宫内膜组织中LRP16蛋白阳性率为13.33%(8/60),子宫内膜癌组织中LRP16蛋白的阳性率为86.25%(138/160),两组相比差异有显著性(P<0.01,图1)。

图1 A.LRP16在正常子宫内膜组织中呈阴性,EliVision法;B.LRP16在子宫内膜癌组织中呈阳性,EliVision法
2.2 子宫内膜癌中LRP16表达与临床病理特征的关系本组结果显示:子宫内膜癌中LRP16表达与组织学分级、FIGO分期、肌层浸润和淋巴结转移密切相关(P<0.05):FIGO分期越晚(Ⅰ+Ⅱ:79.45%、Ⅲ+Ⅳ:91.95%)、肌层浸润越深(≤1/2肌层:80.00%、>1/2肌层:91.11%)、有淋巴结转移(无淋巴结转移:76.00%、有淋巴结转移:90.91%)的子宫内膜癌中LRP16蛋白的阳性率越高;LRP16表达与患者年龄无关(表1)。
2.3 Western blot法检测LRP16蛋白表达与正常子宫内膜组织相比,子宫内膜癌中LRP16蛋白表达明显增高(图2),两组相比差异有显著性(P<0.01)。细胞转染后48 h,实验组与空白对照组和阴性对照组相比,LRP16蛋白表达明显增加,组间差异有统计学意义(F=15.38,P<0.01,图3)。
2.4 RT-PCR检测LRP16 mRNA表达细胞转染后48 h,实验组LRP16 mRNA表达水平与阴性对照组和空白对照组比较均明显降低,各组间差异有统计学意义(F=521.36,P<0.01,图4)。
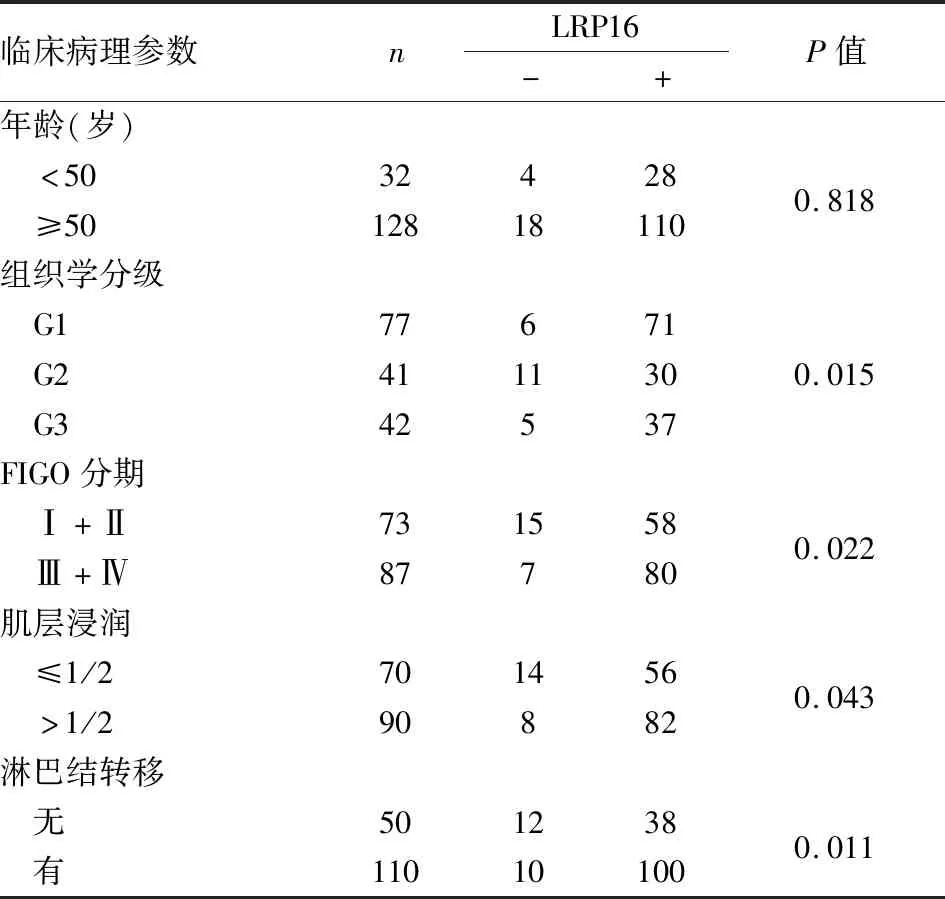
表1 子宫内膜癌中LRP16表达与临床病理特征的关系

图2 Western blot法检测LRP16蛋白在不同子宫内膜组织中的表达
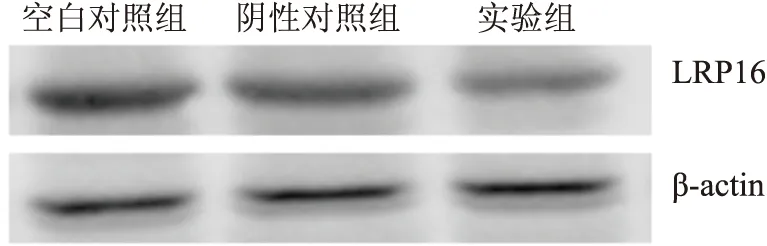
图3 Western blot法检测ISK细胞转染前后LRP16蛋白的表达

图4 RT-PCR检测LRP16 mRNA的表达:与实验组比较,**P<0.01
2.5 转染siLRP16对子宫内膜癌细胞增殖的影响CCK-8检测结果显示,ISK细胞siLRP16转染后24、48、72、96、120 h的抑制率分别为4.8%、16.4%、38.1%、44.5%和 52.6%,与阴性对照组相比,实验组细胞增殖减慢,差异有统计学意义(P<0.05,图5)。
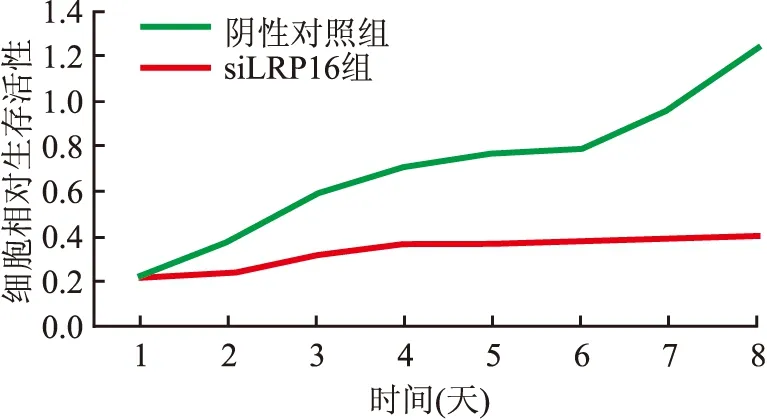
图5 CCK-8实验检测转染siLRP16对ISK细胞增殖的影响
2.6 转染siLRP16对子宫内膜癌细胞侵袭和迁移的影响Transwell小室实验显示,实验组与空白对照组和阴性对照组相比,细胞的侵袭和迁移能力均明显降低。侵袭实验结果显示,实验组穿过基膜的细胞数量为41.0±6.5,与空白对照组(115.2±6.9)和阴性对照组(117.3±5.4)相比,差异有统计学意义(P<0.05,图6)。迁移实验结果显示,实验组穿过基膜的细胞数量为54.3±6.9,与空白对照组(176.2±5.6)和阴性对照组(125.8±2.6)相比,差异有统计学意义(P<0.05,图6)。
3 讨论
将子宫内膜癌根据与雌激素受体的关系分为两种类型[7]:(1)非雌激素依赖性,常发生于萎缩的内膜上,多见于老年绝经后女性;(2)雌激素依赖性,常发生于年轻、围绝经期妇女,长期无拮抗的雌激素刺激可能是其主要发病因素,常由不典型增生发展而来[8]。因此,寻找新的雌激素相关靶基因及其生物学功能的研究,在分子水平上对子宫内膜癌的研究具有重要的诊断和治疗价值。
LRP16基因是1999年解放军总医院采用限制性标记基因组扫描及cDNA末端快速扩增技术发现的新的人类基因[9-10]。该基因cDNA全长980 bp。基因表达的高通量序列分析表明,该基因在人类多种肿瘤细胞中的表达水平明显高于其正常组织,尤其是雌激素依赖性肿瘤中高表达。研究发现LRP16基因是雌激素信号通路上的核蛋白因子应答基因,与雌激素依赖性肿瘤的发生、发展相关[11]。虽然LRP16的组成序列己经明确,但在其功能调控以及在人体的作用研究尚少,本实验着重探讨LRP16基因调控子宫内膜癌增殖和侵袭、转移的规律,以促进肿瘤病因学的发展。
为探讨LRP16对子宫内膜癌生物学功能是否具有调控作用,本实验检测LRP16在子宫内膜癌及正常子宫内膜组织中的表达。免疫组化检测结果显示:LRP16蛋白在子宫内膜癌中的表达(86.25%)明显高于正常子宫内膜组织(13.33%),两者相比差异有显著性(P<0.01),提示LRP16蛋白的阳性率随着子宫内膜组织向癌组织进展明显增加。本组还采用Western blot及RT-PCR检测验证了该结果;且LRP16表达与子宫内膜癌组织学分级、FIGO分期、肌层浸润及淋巴结转移密切相关(P<0.05),也提示LRP16 mRNA与子宫内膜癌的发生、发展明显相关。CCK-8检测LRP16 mRNA被干扰前、后子宫内膜癌细胞的增殖情况,结果显示与阴性对照组相比较,LRP16 mRNA被干扰后子宫内膜癌细胞倍增时间明显延长。Transwell小室实验能模拟肿瘤细胞消化基质,并穿越屏障侵袭迁移的过程。实验结果显示LRP16 mRNA被干扰后,能够穿越屏障的实验组细胞与阴性对照组相比较明显减少,这表明子宫内膜癌细胞侵袭和迁移能力受到抑制,说明LRP16 mRNA与子宫内膜癌细胞的增殖和侵袭、转移密切相关。

图6 转染siLRP16对ISK细胞侵袭和迁移能力的影响
本组发现LRP16基因表达与子宫内膜癌的发生、发展密切相关,围绕LRP16基因的各种基因检测、干预方法将成为强有力的生物学检测工具,对子宫内膜癌高危人群的筛查、合理治疗、预后评估及随访有指导意义。LRP16基因相关靶基因和信号通路影响子宫内膜癌发生、发展的确切机制,还有待进一步研究。
