乳腺浸润性癌中促纤维增生反应的组织学分类及其临床意义
2022-08-06秦东梅周文斌钱影臣刘善荷黄文斌
秦东梅,周文斌,仇 玮,钱影臣,刘善荷,李 明,黄文斌
根据国家癌症中心2021年发布的全国癌症报告显示,乳腺癌居我国女性恶性肿瘤发病首位[1]。长期以来乳腺癌的临床治疗和预后评估主要集中于对肿瘤细胞的评估,如肿瘤TNM分期、组织学类型、病理分级等。近年,研究发现肿瘤微环境和肿瘤的临床生物学行为及疗效密切相关。肿瘤微环境内的纤维性间质数量及其排列方式,与肿瘤的进展和治疗反应有关[2-4]。促纤维增生反应(desmoplastic reaction, DR)是由肿瘤性病变引起的纤维或结缔组织的增生,其特征为癌细胞浸润和伴淋巴细胞、巨噬细胞和中性粒细胞等炎细胞浸润、募集新生的血管内皮细胞和成纤维细胞[5]。DR组织学分类在结直肠癌、口腔鳞状细胞癌、胰腺导管腺癌和食管鳞状细胞癌等实体肿瘤中已有报道,并发现DR组织学分类与肿瘤临床生物学行为及预后有关[6-9]。目前,乳腺癌中DR组织学分类的临床意义报道较少,且检测方法及分析对象尚不一致,其在乳腺癌中的临床意义尚不清楚。本文分析187例乳腺浸润性导管癌(invasive ductal carcinoma, IDC)中DR组织学类型与临床病理学特征的相关性,旨在探讨乳腺癌中DR的临床意义,为乳腺癌患者的临床生物学行为和预后评估提供参考。
1 材料与方法
1.1 临床资料收集2017年1月~2020年12月南京医科大学附属南京医院和南京医科大学附属江宁医院行手术切除的212例乳腺IDC,通过电子病历系统收集病理资料,剔除资料不完整及术前行辅助治疗的患者,最终收集187例IDC进行检测。187例乳腺癌患者平均年龄55.7岁(31~90岁);肿瘤平均最大直径2.35 cm(0.15~9.8 cm)。组织学分级:Ⅰ级8例,Ⅱ级100例,Ⅲ级79例。脉管侵犯37例,神经侵犯20例。有淋巴结转移者73例,无淋巴结转移者106例,8例未送检淋巴结。根据AJCC(第8版)进行pTNM分期:Ⅰ期61例,Ⅱ期87例,Ⅲ期31例。
1.2 方法
1.2.1免疫组化 标本均采用10%中性福尔马林固定,常规石蜡包埋,4 μm厚连续切片,分别行HE和免疫组化EnVision法染色。一抗ER、PR、HER-2和Ki-67均为即用型抗体,购自北京中杉金桥公司。采用全自动免疫组化仪(Dako AutoLink 48)进行染色,具体操作步骤严格按照试剂盒说明书进行。
1.2.2荧光原位杂交 组织切片经二甲苯脱蜡,胃酶处理,2×SSC洗涤缓冲液,烤片,在玻片上加入探针,恒温过夜杂交,室温下置于0.1%NP-40/2×SSC漂洗,暗处自然干燥,DAPI复染剂滴加于玻片杂交区域,暗处放置10~20 min后,在荧光显微镜下选用合适的滤片组观察玻片。HER-2荧光原位杂交探针,购自北京金普嘉公司。
1.3 结果判读
1.3.1DR 根据文献报道组织学分类标准将DR分为成熟型、中间型和未成熟型[10]。DR评估及分类由两位高年资病理医师完成,且判读结果不一致者在双人共揽显微镜下会诊,共同判断。
1.3.2免疫组化 ER、PR阳性定位于细胞核,HER-2阳性定位于细胞膜。ER、PR阳性参考《乳腺癌雌、孕激素受体免疫组织化学检测指南》,将细胞核着色≥1%定义为阳性[11]。HER-2结果判断参考《乳腺癌HER-2检测指南(2019版)》[12],即无着色或≤10%的浸润癌细胞呈不完整的、微弱的细胞膜染色为0;>10%的浸润癌细胞呈不完整的、微弱的细胞膜染色为1+;>10%的浸润癌细胞呈弱~中等强度的完整细胞膜染色或≤10%的浸润癌细胞呈强而完整的细胞膜染色为2+;>10%的浸润癌细胞呈强而完整且均匀的细胞膜染色为3+。Ki-67增殖指数以20%为临界值,<20%为低表达和≥20%为高表达。
1.3.3FISH 免疫组化检测HER-2为2+者,将进行HER-2 FISH检测,FISH判读标准根据《乳腺癌HER-2检测指南(2019版)进行[12]。
1.3.4乳腺癌分子分型 根据WHO(2019)乳腺肿瘤分类将乳腺癌分为4种分子分型[13]:(1)Luminal A型:ER阳性,PR阳性≥20%,HER-2阴性且Ki-67增殖指数<20%;(2)Luminal B型:ER阳性,HER-2阴性,Ki-67增殖指数≥20%或PR阳性<20%;另一种为ER阳性,HER-2阳性,Ki-67增殖指数及PR阳性可以任何水平;(3)HER-2过表达型:ER及PR阴性,HER-2阳性;(4)三阴型:ER、PR及HER-2均阴性。
1.3.5肿瘤浸润性淋巴细胞(tumor infiltrating lymphocytes, TIL) 根据WHO(2019)乳腺肿瘤分类将TIL分为3组:<10%为低度/无浸润;10%~39%为中度浸润;40%~90%为高度浸润[13]。
1.4 统计学分析采用SPSS 23.0软件进行统计学分析,DR组织学分类与IDC临床病理学特征、分子分型、TIL的相关性分析采用χ2检验或Fisher精确概率法,以P<0.05为差异有统计学意义。
2 结果
2.1 DR组织学分类与乳腺IDC临床病理特征的关系187例乳腺IDC中成熟型DR 15例,中间型DR 83例,未成熟型DR 89例。成熟型DR:间质由细而长的纤维和纤维细胞分成多层(图1);中间型DR:间质由宽而明亮的嗜酸性玻璃样变胶原纤维和成纤维细胞组成(图2);未成熟型DR:纤维母细胞散乱排列于黏液样基质内(图3)。DR组织学分类与乳腺IDC病理分级呈负相关(χ2=19.150,P=0.001),即具有成熟型DR的IDC病理分级高,而未成熟型DR的IDC则病理分级低。DR组织学分类与IDC患者年龄、肿瘤部位、肿瘤大小、脉管和神经侵犯、淋巴结转移和pTNM分期等均无明显相关性(P>0.05,表1)。
2.2 DR组织学分类与乳腺IDC中ER、PR、HER-2和Ki-67表达的关系ER和PR阳性定位于细胞核,HER-2阳性定位于细胞膜(图4~6)。DR组织学分类与IDC中ER、PR阳性具有相关性,未成熟型DR在ER/PR阳性的乳腺IDC中高于ER/PR阴性者(χ2=21.601,P<0.001;χ2=21.952,P<0.001,表2)。DR组织学分类与乳腺癌HER-2、Ki-67阳性无明显相关性(χ2=3.176,P=0.204;χ2=2.286,P=0.319)。
2.3 DR组织学分类与乳腺癌分子分型的关系187例乳腺IDC中Luminal A型68例,Luminal B型79例,HER-2过表达型13例,三阴型27例。DR组织学分类与乳腺癌分子分型密切相关,其中管腔型IDC具有较高比例的未成熟型DR(41.6%,37/89),而三阴型乳腺癌多为成熟型DR(53.3%,8/15)(P<0.001,表3)。
2.4 DR组织学分类与乳腺IDC中TIL的相关性IDC中TIL具有不同程度浸润(图7~9):DR组织学分类与TIL的浸润程度具有相关性,成熟型DR的IDC具有高度的TIL(60%,9/15),而未成熟型DR者TIL则为低度/无浸润(66.3%,59/89)(P<0.001,表3)。
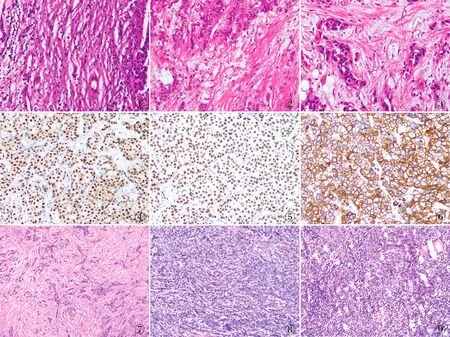
图1 成熟型DR:间质由细而长的纤维和纤维细胞分成多层 图2 中间型DR:间质由宽而明亮的嗜酸性玻璃样变胶原纤维和成纤维细胞组成 图3 未成熟型DR:黏液样间质内胶原纤维束杂乱无章地分布 图4 肿瘤细胞ER呈弥漫阳性,EnVision法 图5 肿瘤细胞PR呈弥漫阳性,EnVision法 图6 肿瘤细胞呈HER-2(3+),EnVision法 图7 TIL低度浸润 图8 TIL中度浸润 图9 TIL高度浸润
3 讨论
乳腺癌是女性最常见的恶性肿瘤,位居女性恶性肿瘤病死率的首位。乳腺癌的临床治疗和预后评估主要根据肿瘤大小(T)、淋巴结转移(N)和远处转移(M)的TNM分期进行,但临床发现具有相同临床分期或病理组织学参数相同的患者却常有不同的肿瘤转归,提示肿瘤细胞并不能完全预测乳腺癌患者的治疗反应及预后。以往研究报道,使用基因工程的方法增加小鼠乳腺间质内I型胶原的含量后,可使其乳腺癌患病率提高3倍,发生肺转移的几率也提高3倍[14]。有文献报道肿瘤间质百分比对三阴型和淋巴结阳性乳腺癌患者具有重要预后价值[15-16];提示肿瘤间质即肿瘤微环境可能通过多种机制,包括细胞外基质的重塑、炎症细胞的招募、基质调控通路的连接等促进肿瘤的增殖和扩散。
研究发现随着恶性肿瘤的进展,肿瘤周围的微环境可发生动态改变,其中最主要的变化为DR。Ueno等[17]对DR进行组织学分类并将其应用于直肠癌的研究中,他们根据胶原纤维的宽度和间质是否伴黏液样变将DR分为成熟型、中间型和未成熟型,结果显示成熟型DR的直肠癌Dukes分期低,而未成熟型DR则Dukes分期高,DR组织学分类与患者5年生存期明显相关。卢梅等[18]对胰腺导管腺癌肿瘤间质进行研究发现,肿瘤间质成熟度与胰腺癌组织学分级、淋巴结转移有相关性。本组对食管鳞状细胞癌中肿瘤间质分析发现,具有未成熟型间质的食管鳞状细胞癌有较高的pT分期、神经和脉管侵犯、淋巴结转移和较晚的pTNM分期,且与食管癌患者的无进展生存率有关[19]。Ahn等[4]根据乳腺癌间质的主要成分将乳腺癌间质分为三种主要类型:胶原为主型、成纤维细胞为主型和淋巴细胞为主型,研究结果显示主要间质类型与乳腺癌临床病理参数及激素受体状态和HER-2表达有关,胶原为主型和成纤维细胞为主型与ER表达密切相关,生存分析显示间质类型与无瘤生存期(disease-free survival, DFS)密切相关,胶原为主型预后相对差,表明肿瘤微环境内的间质不仅影响乳腺癌细胞的生物学行为,且不同的间质类型具有不同的生物学行为。新近研究发现,在乳腺癌中采用靶向肿瘤微环境的策略,使用针对赖氨酰氧化酶类似物2(一种介导胶原纤维交联的酶)的抗体后,肿瘤间质发生重构,间质胶原的密度显著降低,肿瘤体积缩小,从而有助于乳腺癌的治疗[14]。因此,对于间质不成熟的乳腺癌患者,通过靶向肿瘤微环境使间质重构,抑制肿瘤的生长和侵袭转移,其有可能成为辅助治疗策略。
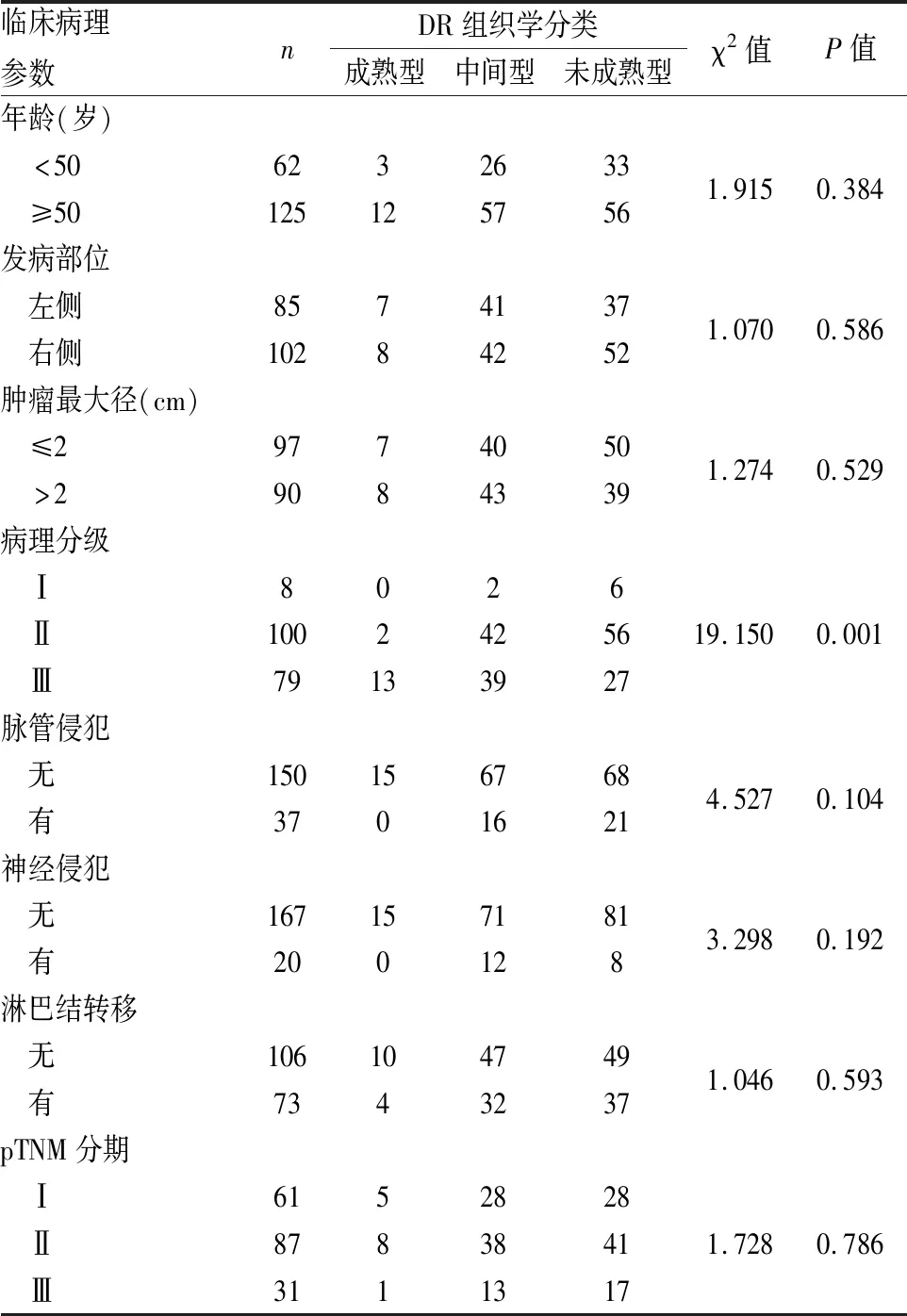
表1 DR组织学分类与乳腺IDC临床病理特征的关系
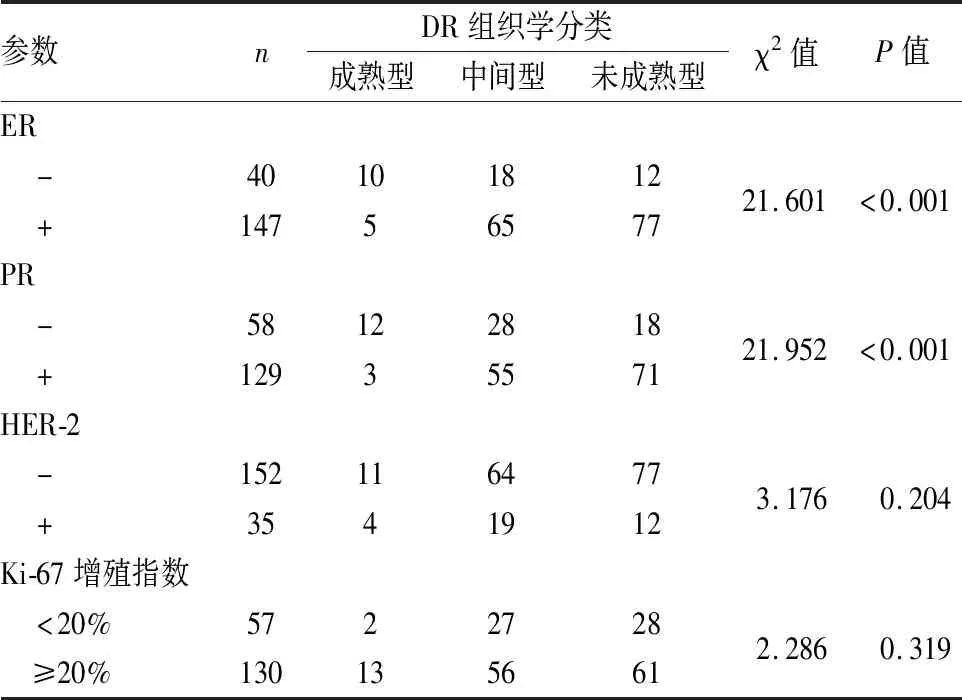
表2 DR组织学分类与乳腺IDC中ER、PR、HER-2和Ki-67增殖指数的关系
本组发现DR组织学分类仅与病理分级有关,即具有成熟型DR的IDC,其病理分级高;而未成熟型DR的IDC则病理分级低。进一步分析发现,DR组织学分类与ER、PR阳性密切相关,ER/PR阳性乳腺癌组织中DR组织学分类多为未成熟型,而与HER-2阳性无关,提示激素受体阳性乳腺癌细胞可能影响肿瘤微环境中相关成分的改变而发挥促进肿瘤进展的作用。分子分型显示未成熟型DR多见于管腔型IDC,而成熟型DR多为三阴型IDC,提示DR的组织学分类与乳腺癌的分子分型及预后有关,通过观察评估DR组织学形态不仅能反映乳腺癌微环境的特点,还能有助于乳腺癌的分子分型预测。
TIL是机体对肿瘤细胞的一种反应,也是免疫治疗疗效预测的组织学特征。文献虽未报道TIL水平与乳腺癌患者的总生存率和无瘤生存率有关,但几项大型系统复习和荟萃分析证实,仅在三阴型和HER-2阳性乳腺癌中,TIL高与更好地DFS和总生存期相关[16,20]。本组DR组织学分类和TIL呈负相关,即成熟型DR伴高度TIL,而不成熟型DR伴低度TIL;提示DR可能通过分泌一些细胞因子招募TIL,也有可能是TIL分泌的细胞因子重塑DR,具体机制还需要进一步深入分析。
综上所述,浸润性乳腺癌中浸润前沿DR具有不同的组织学形态,DR组织学分类与乳腺癌的分子分型和TIL密切相关,观察DR的形态学特征并进行组织学分类,可有助于评估和预测乳腺癌的临床生物学行为及分子类型,为乳腺癌患者的治疗及预后提供参考。

表3 DR组织学分类与乳腺癌分子分型、间质TIL的关系
