超声联合细针穿刺诊断乳腺癌腋窝淋巴结转移假阴性的多因素分析
2022-08-06詹维伟贾晓红姚洁洁张齐蓉
朱 樱,詹维伟,贾晓红,姚洁洁,周 伟,张齐蓉
(上海交通大学医学院附属瑞金医院:1.超声诊断科;2.乳腺疾病诊治中心 200025)
淋巴结转移是乳腺癌患者判断预后最重要的因素,亦是决定术前新辅助或术后辅助性治疗的重要依据。目前腋窝超声(AUS)是国内外临床术前评估乳腺癌腋窝淋巴结状态首选的诊断方法。超声影像结合穿刺细胞病理学检查诊断乳腺癌腋窝淋巴结转移(axillary lymph nodal metastasis,ALNM)的特异度高达99.5%以上[1],可有效避免部分淋巴结阳性病例接受不必要的前哨淋巴结活检(sentinel lymph node biopsy,SLBN),降低SLBN的假阴性率,也有研究报道15%~40% 伴ALNM的患者术前影像学检查未检出[2-4]。本研究旨在探讨术前AUS 联合超声引导下淋巴结细针穿刺细胞学检查(US-FNAC)诊断乳腺癌ALNM的假阴性率,分析各项临床、病理及超声影像学因素与假阴性率的相关性。
1 资料与方法
1.1 一般资料
选取2018年1月至2019年3月在本院住院的早期乳腺癌患者,术前AUS阴性或因术前AUS有可疑淋巴结而行US-FNAC为阴性的患者共338例,均为女性,年龄28~88岁,平均(56.0±12.3)岁。乳腺肿块直径4~50 mm,平均(22.0±8.1)mm。排除术前曾有放化疗史、原发肿瘤>50 mm。本研究经本院伦理委员会审批,患者签署知情同意书。
1.2 方法
采用百胜Mylab 60彩色超声仪,8~12 MHz宽频线阵探头。患者取仰卧位,双臂上举略外展,使乳房及腋窝充分暴露,对双乳行常规切面的二维及彩色超声扫查,若发现肿块,则在同侧乳腺沿腋部大血管走行依次仔细寻找超声表现最为可疑的淋巴结。在超声检查所见最为可疑腋窝淋巴结的最大切面观察淋巴结皮质、淋巴门结构及淋巴结血供模式,测量皮质最大厚度及淋巴门宽度。综合评估淋巴结超声特征并分为4类[5]:(1)高度可疑,淋巴门消失或呈偏心狭窄型;(2)中等可疑,皮质最大厚度大于淋巴门宽度,或皮质最大厚度>4 mm,或皮质最大厚度为3~4 mm且存在非淋巴门型血流,或皮质不规则增厚且皮质最大厚度>3 mm;(3)低度可疑,皮质均匀增厚,最大厚度为3~4 mm;(4)正常,皮质最大厚度≤3 mm。常规超声探及可疑淋巴结(包括低度、中度或高度可疑淋巴结)为超声阳性,其余为超声阴性。
当AUS阳性,超声医生即刻对最可疑淋巴结的异常部位在超声引导下采用10 mL注射器配7号针行穿刺活检,每个淋巴结穿刺2~3次。将取材标本细胞学诊断分为5类[6]:取材不充足、良性、非典型可能良性、可疑恶性及恶性。可疑恶性及恶性归为US-FNAC阳性,其余归为US-FNAC阴性。
术前综合评估AUS及US-FNAC结果,将常规超声阳性且细胞学检查阳性归为临床腋窝阳性,其余归为临床腋窝阴性。
1.3 统计学处理
2 结 果
2.1 淋巴结转移情况
本组338例患者均行SLBN或腋窝淋巴结清扫术(axillary lymph node dissection,ALND),术后石蜡病理证实90例患者存在ALNM,淋巴结转移数目1~10个,平均(2.03±1.67)个,其中淋巴结转移数目>3个患者14例(15.6%)。术前AUS联合US-FNAC诊断假阴性率为26.6%(90/338)。
2.2 单因素分析
单因素分析显示,假阴性率与肿瘤大小(P=0.008)、淋巴管癌栓(P=0.030)、肿瘤分子分型(P=0.004)和淋巴结超声分类(P<0.001)有关,见表1。AUS阳性/US-FNAC阴性患者的假阴性率明显高于术前AUS阴性患者(P<0.05),但不同可疑程度AUS阳性/US-FNAC阴性患者间假阴性率无明显差异(P>0.05),见表2。
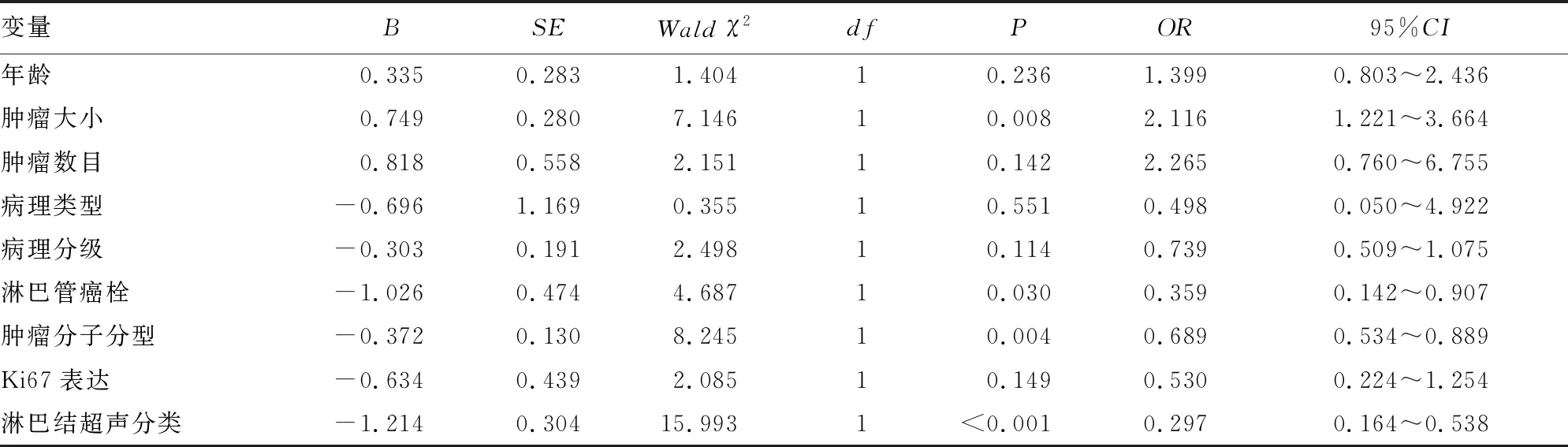
表1 影响AUS联合US-FNAC诊断假阴性率logistic回归的单因素分析

表2 AUS联合US-FNAC诊断与AUS诊断的关系
2.3 多因素分析
多因素分析显示,肿瘤大小(P=0.001)、淋巴管癌栓(P=0.015)和淋巴结超声分类(P<0.001)为术前AUS联合US-FNAC诊断假阴性率的独立影响因素,见表3。
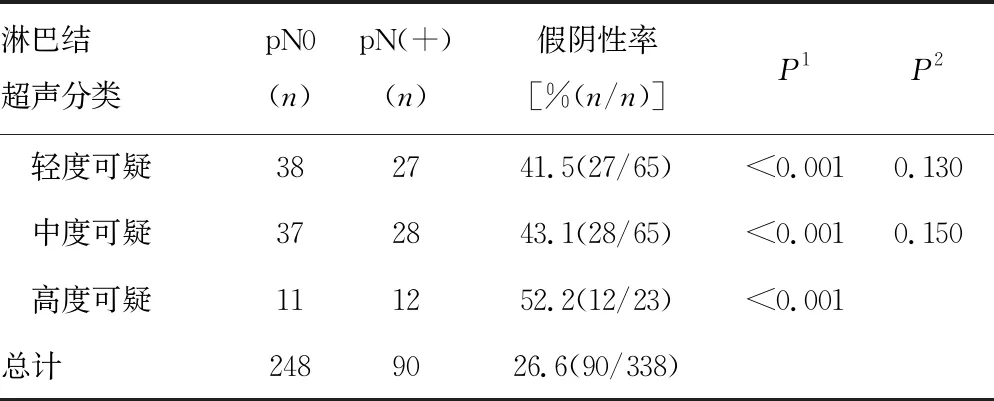
续表2 AUS联合US-FNAC诊断与AUS诊断的关系

表3 影响AUS联合US-FNAC诊断假阴性率logistic回归的多因素分析
3 讨 论
对于乳腺癌患者而言,腋窝淋巴结的转移状态评估对于确定临床分期、制订治疗方案及预后判断至关重要。超声检查是目前临床判断淋巴结转移状态最常见的方法之一,不仅可通过观察淋巴结形态、皮质厚度、有无淋巴门等情况反映淋巴结转移状况,同时具备实时动态监测的能力,能引导穿刺活检获得样本进行细胞学或病理学检查,为后续腋窝手术方案的选择提供依据。
由于US-FNAC穿刺指征、穿刺次数、纳入患者ALNM负荷等不同,目前关于超声联合US-FNAC术前诊断ALNM临床价值的报道并不一致[2-4]。在剔除行新辅助及晚期乳腺癌患者后,本研究纳入了338例术前临床腋窝阴性的早期浸润性乳腺癌患者,术前AUS联合US-FNAC诊断假阴性率为26.6%。
淋巴结的形态学改变是超声判断淋巴结有无转移的重要途径。研究发现肿瘤细胞最先侵犯腋窝淋巴结皮质部使其过度增殖,逐步生长侵蚀整个淋巴结,使淋巴门逐渐变小至消失。本研究纳入了185例AUS阴性及153例AUS阳性/US-FNAC阴性患者,发现AUS阳性/US-FNAC阴性患者术后淋巴结转移率明显大于AUS阴性患者,提示对于存在其他ALNM高危因素的AUS阳性/US-FNAC阴性患者可考虑再次行US-FNAC。有研究发现US-FNAC假阴性与淋巴结内转移灶大小密切相关,腋窝淋巴结转移灶≥5 mm患者的US-FNAC假阴性率明显低于淋巴结转移灶<5 mm的患者[7]。此外CHO等[8]发现US-FNAC的假阴性亦可能是由穿刺活检的淋巴结选择错误造成的。他们对184例浸润性乳腺癌超声最为可疑的腋窝淋巴结术前行超声引导下淋巴结构针定位,并对定位淋巴结及其他腋窝清扫淋巴结分别做病理检查,发现54例患者存在腋窝淋巴结转移灶,其中13例患者的转移淋巴结并非超声最可疑的淋巴结。因此,再次US-FNAC检查时,不仅需增加最可疑淋巴结的穿刺次数,同时需增加穿刺淋巴结数目,以达到降低术前诊断的假阴性率。另外,本研究发现形态学上不同可疑程度患者的淋巴结转移率间并不存在差异,提示淋巴结异常超声表现不仅可由乳腺癌转移引起,亦可由淋巴结反应性增生[9-10],甚至部分淋巴结两种病理表现可并存。
有研究发现引起AUS联合US-FNAC诊断假阴性的因素包括:浸润性小叶癌、原发肿瘤体积较大、多灶性及存在淋巴管癌栓[11-13]。本研究单因素及多因素统计分析结果显示,假阴性率与肿瘤大小(P=0.001)及淋巴管癌栓(P=0.015)有关,即当原发乳腺肿瘤最大径>2 cm或存在淋巴管癌栓时,术前AUS联合US-FNAC诊断假阴性率明显升高,这与相关研究一致[14-15]。但本研究并没有发现假阴性率与原发肿瘤的病理类型、多灶性有关,这可能是由于本组病例中浸润性小叶癌及多灶性病例数过少造成的。
综上所述,术前AUS联合US-FNAC是评估浸润性乳腺癌有无ALNM的一种可靠的影像学检查方法,其诊断假阴性率与淋巴结超声分类、肿瘤最大径>2 cm及存在淋巴管癌栓有关。对于AUS阳性病例规范US-FNAC操作流程、增加高危ALNM病例穿刺活检次数及穿刺活检淋巴结数目是降低术前AUS联合US-FNAC诊断假阴性率的有效措施。
