氧化石墨烯辅助乙醇提取荞麦壳中总黄酮的工艺研究
2022-08-06苏学军裘可范文赟
苏学军,裘可,范文赟
(泰州职业技术学院药学院,江苏泰州 225300)
荞麦壳是加工荞麦粉时产生的主要副产品,约占荞麦总重量的1/3(张岚等,2016)。长久以来,荞麦壳除少量用作土壤基肥、辅助饲料及枕芯填充物外(印鑫等,2018),其余被视为农业废弃物而遭抛弃。研究发现,荞麦壳中含有多种生物活性物质,作为主要成分之一的荞麦壳黄酮(FOBH)具有预防和治疗糖尿病、清除自由基、调节脂肪代谢、诱导癌细胞凋亡、改善微循环等功效(李鹏程等,2017;王昱儒等,2017;路静静等,2016;Ren等,2003)。在畜牧业生产中,黄酮是一种多功能性饲料添加剂,可以促进动物生长和生产,增强机体免疫及抗氧化能力,提高畜禽繁殖性能(刘瑞雪等,2021;刘帅等,2021)。研究表明,在AA 肉仔鸡日粮中添加750 mg/kg 艾蒿黄酮,喂饲22~ 42 d,能极显著提高肉仔鸡的平均日增重,降低料重比,改善肉品质(江阳等,2021);给肉仔鸡饲喂适量的黄芪黄酮,可以改善肠道的微生物菌群,促进肠道健康(梁英等,2012);甘草黄酮可作为替抗产品用于产气荚膜梭菌引起的鸡坏死性肠炎的治疗(刘宗争等,2019);妊娠母猪饲料中添加200 mg/kg大豆黄酮可显著增加仔猪的初生窝重和窝健仔数,显著提高妊娠母猪的血清IgG 含量及SOD 活性,增强母猪的抗氧化能力(张琦琦等,2019)。因此,探索一种安全高效的FOBH 提取技术,对于饲料工业的发展具有积极意义。氧化石墨烯(GO)是具有二维片层结构的氧化碳化合物,作为一种新型催化剂,应用于天然活性成分提取时能够催化水解植物细胞壁,降低纤维素的结晶度及晶粒尺寸,提高目标组分的浸出速率和提取效率(王博文等,2017;王欣,2015)。目前,关于GO 辅助乙醇提取FOBH 的研究鲜见报道,因而本试验设计单因素及正交试验对提取工艺条件进行优化,旨在提供一种FOBH 提取新技术,亦为荞麦壳资源的开发利用提供参考依据。
1 材料与方法
1.1 材料与试剂 甜荞麦壳,泰州市永安洲;芦丁标准品,上海源叶生物科技有限公司;单层氧化石墨烯,苏州恒球科技有限公司;醋酸钠、三氯化铝与无水乙醇均为市售分析纯。
1.2 主要试验仪器 BJ-150 多功能粉碎机(德清拜杰电器有限公司);TDL-60B 离心机(上海安亭科学仪器厂);TU-1810 紫外可见分光光度计(北京普析仪器有限公司);HH-S1 数显恒温水浴锅(金坛市医疗仪器厂);LRH-250F 型生化培养箱(上海一恒科技有限公司)。
1.3 试验方法
1.3.1 FOBH 的提取 取60 ℃下鼓风烘干后的荞麦壳若干,粉碎过40 目筛,干粉密封于干燥器内备用。称取4 g 荞麦壳粉末放入三口烧瓶内,加入一定量的提取溶剂及GO,在预设温度下,水浴回流提取一定时间。完成提取后,以4000 r/min 离心分离15 min,得到含FOBH 的上清液,收集后待测。
1.3.2 FOBH 提取量的测定 参考曾俊等(2020)采用的AlCL3比色法测定FOBH 的提取量。精密移取质量浓度为201 μg/mL 的芦丁标准品溶液0.5、1.0、1.5、2.0、2.5 mL 于25 mL 比色管中,再分别移入1.5%的AlCL3溶液4 mL,1 mol/L NaAc 溶液4 mL,继续添加质量分数50%的乙醇至刻度,显色反应20 min,在415 nm 处测定系列显色液的吸光度,得吸光度A 与芦丁浓度C 之间的回归方程为A=0.0301C+0.0411,R2=0.9995。精密移取1 mL 荞麦壳提取液,按前述步骤加入显色剂显色,测定吸光度,根据回归方程计算提取液中FOBH 浓度,并按下式计算FOBH 提取量。

式中:Y 为FOBH 提取量,mg/g;K 为稀释倍数;C 为计算求出的提取液中FOBH 的浓度,μg/mL;V 为提取剂的体积,mL;m 为荞麦壳干粉的质量,g。
1.3.3 GO 辅助乙醇提取FOBH 的单因素试验以FOBH 的提取量为指标,研究提取时间(0.5、1.0、1.5、2.0、2.5 h)、提取温度(50、60、70、80、90℃)、GO 添加量(0、0.4、0.8、1.2、1.6 mg/g)、乙醇质量分数(30%、40%、50%、60%、70%)和料液比(1:10、1:15、1:20、1:25、1:30 g/mL)对提取量的影响。
1.3.4 正交试验设计 选取提取温度、GO 添加量、乙醇质量分数、料液比作为四因素,基于L9(34)正交试验设计表设计试验方案并优化提取工艺条件,因素与水平设计见表1。
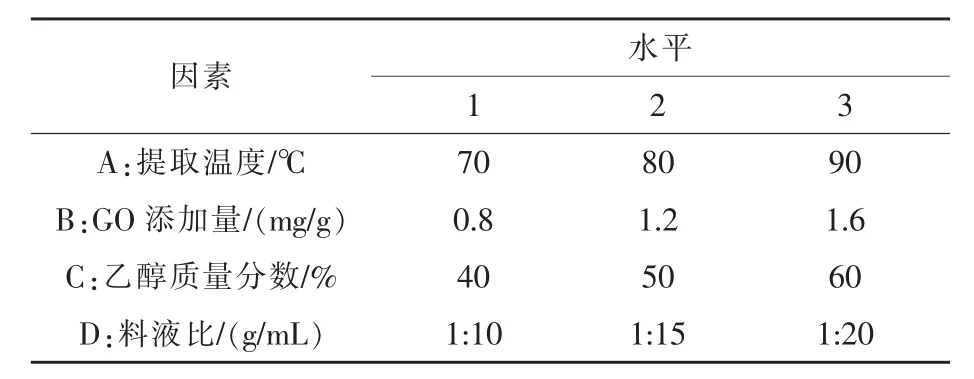
表1 试验因素与水平
1.4 统计分析 通过Excel 2017 进行试验数据整理,使用SPSS 22.0 软件进行方差分析,Duncan’s 法进行多重比较。
2 结果与分析
2.1 提取方法对比 采用水提(WE )、GO 辅助水提(GOWE )、醇提(ET)、GO 辅助醇提(GOET)4种方法提取FOBH。提取溶剂为蒸馏水和质量分数为50%乙醇,料液比1:20 g/mL,GO 添加量0.4 mg/g,70 ℃水浴回流提取1.5 h。由图1 可知,乙醇用作提取剂更利于FOBH 的溶出,且在提取剂中添加GO后,水提和醇提获得的黄酮提取量均有一定程度的增加,但以GOET 法效果最好。因此,采用GOET 法提取FOBH,进一步优化提取工艺条件。
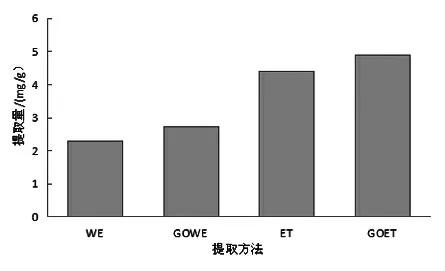
图1 不同提取方法对比
2.2 单因素试验
2.2.1 提取时间对FOBH 提取量的影响 由图2可知,随着提取时间的延长,在1.5 h 之前提取量上升较快,至1.5 h 后趋于平缓。这是因为提取初期黄酮在细胞壁内外有较大的浓度差,扩散速度快,但当提取达一定时间后,提取剂中FOBH 的浓度趋于饱和,提取量就变化不大,综合考虑选择1.5 h 比较经济。

图2 提取时间对FOBH 提取量的影响
2.2.2 提取温度对FOBH 提取量的影响 由图3可知,提取量随着温度的升高而增大,当温度到达80 ℃后,提取量有所减小。升高温度可增大传质扩散系数,降低相际传质阻力,使得黄酮更易增溶于提取剂中。但若提取温度过高,非目标组分的溶出增多,且有可能会影响黄酮的稳定性,故适宜的提取温度选为80 ℃。

图3 提取温度对FOBH 提取量的影响
2.2.3 GO 添加量对FOBH 提取量的影响 图4表明,随着GO 添加量的增多,FOBH 的提取量先增大后减小,其最大值出现在GO 添加量为1.2 mg/g时,说明GO 能在一定浓度范围内提高目标物的得率。这可能是由于热回流提取时,GO 片状结构的锋利侧边会不断切割、刺入细胞壁(涂育松等,2016),而遭到物理破坏的细胞壁则容易被提取剂穿透。同时,GO 表面大量的酸性基团,能使细胞壁的骨架成分纤维素发生水解(王博文等,2017),溶出阻力大大降低,加快了细胞内黄酮的释放。但GO 的比表面积大,提取时若GO 量过多,会造成GO 对FOBH 的吸附量增加,导致提取量降低,故GO 添加量选择1.2 mg/g 为宜。

图4 GO 添加量对FOBH 提取量的影响
2.2.4 乙醇质量分数对FOBH 提取量的影响 图5 表明,FOBH 的提取量随乙醇质量分数的增大而增大,在50%时达到最大值,之后提取量降低。这可能是由于质量分数为50%乙醇溶液的极性与FOBH 的极性最为相似,黄酮在此浓度下更易溶出。因此,选择质量分数为50%的乙醇提取较为合适。
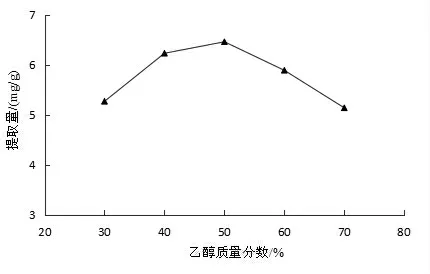
图5 乙醇质量分数对FOBH 提取量的影响
2.2.5 料液比对FOBH 提取量的影响 由图6 可见,当料液比为1:10~1:15 g/mL时,提取量呈上升趋势。料液比增大后,荞麦壳粉与提取剂之间的接触更充分,有利于FOBH 的溶出。但料液比的增大,会使提取剂中GO 浓度降低,从而削弱GO的催化作用,提取量又表现出下降趋势,故料液比选择1:15 g/mL 较适宜。

图6 料液比对FOBH 提取量的影响
2.3 正交试验结果 由表2 可以看出,各因素对FOBH 提取量的影响大小顺序为A(提取温度)>D(料液比)>B(GO 添加量)>C(乙醇质量分数)。由表3 可知,4 个因素对提取量的影响均表现为极显著。本试验优化得到的最佳工艺组合为A3B2C1D3,即提取温度90 ℃,GO 添加量1.2 mg/g,乙醇质量分数40%,料液比1:20 g/mL。

表2 正交试验结果

表3 方差分析结果
2.4 验证试验 为了验证提取工艺的稳定性,在最佳工艺组合A3B2C1D3条件下进行3 次平行试验,得到FOBH 提取量的平均值为(7.39±0.02)mg/g,RSD 为0.33%,表明该工艺稳定可行。在上述最优提取工艺条件下,若不添加GO,进行3 次乙醇回流提取,提取量平均值为(6.20±0.03)mg/g,GO 辅助醇提取后提取量增大了1.19 mg/g。
3 结论
本试验结果表明,氧化石墨烯辅助乙醇提取FOBH 的最优工艺条件为:提取温度90 ℃,GO 添加量1.2 mg/g,乙醇质量分数40%,料液比1:20 g/mL,提取时间1.5 h。此条件下,FOBH 的提取量为7.39 mg/g,比乙醇回流提取提高了1.19 mg/g,表明GO 辅助乙醇提取FOBH 工艺的高效性。本工艺研究为FOBH 开发成饲料添加剂提供了可能,同时为荞麦壳资源的综合利用提供了一定的理论依据。
