光化学衍生法测定玉米及玉米制品中的黄曲霉毒素B1
2022-08-06刘梦佳任肖峰郑大威林太凤张萍王惠琴
刘梦佳,任肖峰,郑大威,林太凤,张萍,王惠琴
(1.北京工业大学环境与生命学部,北京 100124;2.北京开课吧科技有限公司,北京 100193)
黄曲霉毒素(AFT)是由曲霉属中的黄曲霉和寄生曲霉等某些菌株产生的具有致癌性和免疫抑制作用的次生代谢产物,常存在于发霉的大豆、稻谷、玉米等农产品中,是食品污染的一个重要来源(Chen等,2021)。它们是一类结构相似的化合物的总称,基本结构都是二氢呋喃氧杂萘邻酮,有黄曲霉毒素B1(AFB1)、黄曲霉毒素B2(AFB2)、黄曲霉毒素M1(AFM1)等20种,大多难溶于水,易溶于有机溶剂(如氯仿、丙酮、甲醇和乙醇等),熔点为200~ 300 ℃,耐高温,常规的加热处理难以将其分解。其中,AFB1毒性最强,是砒霜的68倍,被列为一类致癌物(Tan等,2019;Wu等,2018;上海飞测生物科技有限公司,2017;Rejeb等,2009)。当人体摄入被黄曲霉毒素污染的食品时,会发生急性中毒(导致肝脏出血、坏死)或慢性中毒(导致肝功损害),甚至发生癌变(王喜萍,2004)。我国严格限制规定食品中AFB1的量,《食品安全国家标准食品中真菌毒素限量》(GB 2761-2017)规定,玉米、玉米面(渣、片)及玉米制品AFB1不超过20 μg/kg(国家卫生和计划生育委员会等,2017)。
目前,检测粮食中AFB1的方法主要有薄层色谱(TLC)法(Sassahara等,2005;环境科学丛刊,1980)、酶联免疫吸附(ELISA)法(王彩云,2007)、高效液相色谱(HPLC)法(王艳红等,2019;Shuib等,2017;Campone等,2016)等。近些年也有新方法不断被开发利用,例如荧光原位杂交(FISH)法(许琳,2018)、生物传感器法(张军鹏,2020;Zhu等,2020)和高效液相色谱荧光检测器(HPLCFL)法(Ketney等,2017)等。HPLC-FL 法具有灵敏度高、准确性好、重现性好等众多优点,近年来在黄曲霉毒素的检测中应用越来越广泛。由于AFB1在遇水后会发生荧光淬灭,因此液相色谱法在检测时通常需要衍生,其中光化学柱后衍生法简单方便(朱鹏飞等,2016)。
玉米作为我国的高产粮食作物,是畜牧业、养殖业、水产养殖业等的重要饲料来源,也是食品、医疗卫生、轻工业、化工业等不可或缺的原料之一,玉米和玉米制品在我国的国计民生和经济发展中发挥着巨大的作用。但是,由于储藏条件的问题,玉米和玉米制品经常会受到真菌污染,其中黄曲霉毒素污染普遍,且以AFB1为主。本文结合免疫亲和柱对样品进行富集净化,采用高效液相色谱-荧光检测器-光化学柱后衍生法,测定玉米和玉米制品中的AFB1,以期为玉米和玉米制品中AFB1的检测提供准确灵敏的检测方法。
1 材料与方法
1.1 主要材料与试剂 玉米及玉米制品(玉米粒和玉米片,市售);甲醇(色谱纯,上海麦克林生化科技有限公司);AFB1标准品(购于国家标准物质研究中心):纯度≥99%,带标准证书;实验用水均为Millipore(Direct-Q 8UV-R)所制超纯水(18.2 mΩ);AFB1免疫亲和柱(3 mL,北京百灵威科技有限公司);玻璃纤维滤纸(青岛普瑞邦生物工程有限公司)。
1.2 主要仪器与设备 LC-100 高效液相色谱仪(配荧光检测器,);AL204分析天平(Mettler Toledd 公司);旋涡混合器;干式氮吹仪;PHREDHMC 光化学衍生器(220 V,50 Hz,8 W)。
1.3 实验方法
1.3.1 色谱条件 色谱柱:XDB-C18 柱(5 μm×4.6 mm×250 mm);流动相:甲醇-水溶液(V:V,45:55);流速:1.0 mL/min;柱温:40 ℃;荧光检测器检测波长:激发波长360 nm,发射波长440 nm;进样量:20.0 μL;分析时间:15 min。
1.3.2 黄曲霉毒素B1标准溶液的配制 用分析天平称取黄曲霉毒素B1粉末1.0 mg,用100 mL 色谱甲醇充分溶解后,全部转移至1000 mL 容量瓶中,用色谱甲醇定容至刻度,得到1.0 mg/L 的AFB1标准溶液,然后依次用色谱甲醇稀释得到0.1、0.2、0.3、0.4、0.5 mg/L 的AFB1溶液。在设定的色谱条件下,浓度由低到高进行进样,采用外标法定量,作峰面积-质量浓度标准曲线,得到标准曲线回归方程。
1.3.3 试样的制备与净化 将玉米及玉米制品粉碎,称取均匀的玉米及玉米制品粉末50.00 g 于250 mL 具塞锥形瓶中,加入100 mL 甲醇-水(55:45,V/V)溶液,涡旋混匀,10000 r/min 下均质3 min,再在10000 r/min 下离心5 min,取上清液备用。
使用30 mL 超纯水稀释15 mL 上清液,再用玻璃纤维滤纸进行过滤,移取15 mL 稀释液,过免疫亲和柱净化,将流速控制在1.0 mL/min 以内,使黄曲霉毒素B1被完全吸附。取10 mL水,分两次淋洗免疫亲和柱,将小柱抽干,弃去流出液。加入3 mL 甲醇对样品进行洗脱,收集全部流出液,并用N2吹干。加入1 mL 色谱级甲醇复溶样品,过0.22 μm 的滤膜,供HPLC 分析。
2 结果与分析
2.1 高效液相色谱图 在1.3.1 的条件下,分别用高效液相色谱测定甲醇(色谱纯)和色谱甲醇溶解的AFB1溶液,得到两者的高效液相色谱图见图1,确保色谱甲醇不会对AFB1的测定造成影响。从图1 可见,使用高效液相色谱法测定黄曲霉毒素时,甲醇不会对AFB1的测定造成影响,AFB1的保留时间为8.2 min。
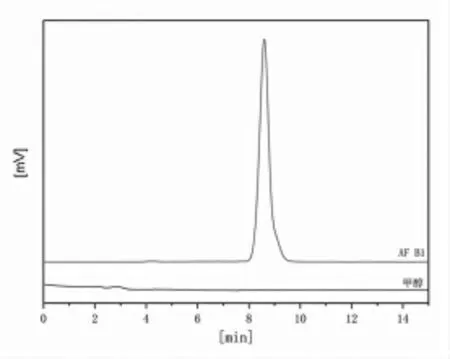
图1 黄曲霉毒素B1 的高效液相色谱图
再将配制的0.1~ 0.5 mg/L AFB1溶液进行测定,结果见图2。可见AFB1的浓度在0.1~0.5 mg/L时,其峰面积是逐渐增大的,且保留时间一致,表明没有受到其他因素的影响。
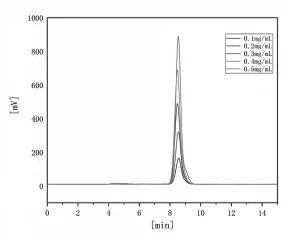
图2 0.1~ 0.5 mg/L 黄曲霉毒素B1 的高效液相色谱图
2.2 标准曲线及检出限 本实验采用外标法,配制成“1.3.2”标准系列溶液,进行检测分析。以标准样品浓度为横坐标X,峰面积为纵坐标Y 进行线性关系分析,得到AFB1的峰面积与质量浓度的线性关系,拟合回归方程式,详见图3。以S/N=3 和S/N=10 确定最低检出限和定量检出限。结果表明,该方法在0.1~ 0.5 mg/L 内线性关系良好,且检出限低,可以用于试样中AFB1的分析检测,详见表1。本研究方法中,以0.1~ 0.5 mg/L 作为标准曲线线性范围,与国标相比(国家市场监督管理总局等,2018;国家卫生和计划生育委员会等,2016),线性范围较窄,方法的检出限和定量限更有优越性。

图3 黄曲霉毒素B1 标准曲线

表1 黄曲霉毒素B1 的标准曲线和检出限
2.3 加标回收率和重复性 在玉米和玉米制品样品中分别加入标准AFB1溶液,使其在样品中的含量分别为5、10 μg/kg,按照1.3.3 中的操作步骤进行处理,对每个水平做5 次平行实验,计算AFB1的平均回收率和RSD值,结果见表2。
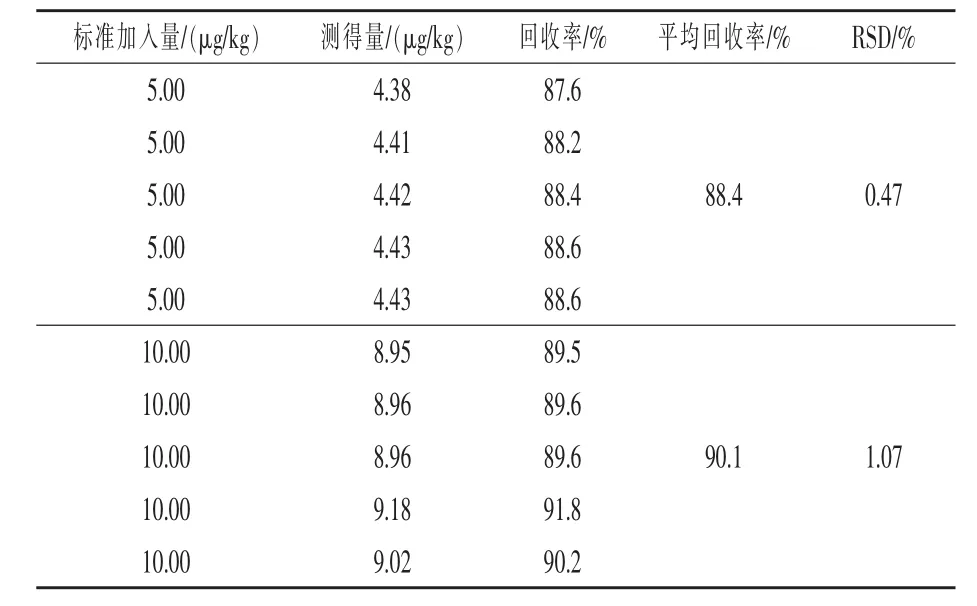
表2 黄曲霉毒素B1 的加标回收率和重复性
结果表明,用该方法得到的色谱图,AFB1的保留时间是恒定的。AFB1的回收率在85%以上,平均回收率为88.4%~ 90.1%,RSD 值为0.47%~1.07%,方法准确度高,符合AFB1分析检测要求。
2.4 市售玉米和玉米制品中黄曲霉毒素B1测定在农产品市场购买玉米粒和玉米片各三份分别用于测定。按照1.3.3 中的方法进行样品处理,按照1.3.1中的色谱条件进行测定。测定结果如表3 所示。购买的三份玉米粒和三份玉米片中均未检出AFB1,反映出市场管控情况较好。

表3 市售玉米和玉米制品中黄曲霉毒素B1 测定结果
3 结论
本研究采用免疫亲和柱净化-高效液相色谱-柱后光化学衍生-荧光检测的方法测定玉米和玉米制品中AFB1的含量。与国家标准方法相比,该方法采用了光化学衍生器进行柱后衍生,既增强了AFB1的检测灵敏度,又避免了化学衍生过程带来的试剂污染;另一方面改进了AFB1的提取和固相萃取洗脱过程,使得AFB1的回收率为88.4%~ 90.1%,RSD 为0.47%~ 1.07%。本研究所建立的方法回收率高、适应性强,可为玉米等谷物中AFB1污染的监测提供可靠的依据。
