锦鸡儿属植物功能性状与根际土壤细菌群落结构的关系
2022-08-05李媛媛徐婷婷艾喆周兆娜马飞
李媛媛,徐婷婷,艾喆,周兆娜,马飞
(1. 宁夏大学西北土地退化与生态恢复国家重点实验室培育基地,宁夏 银川 750021;2. 宁夏大学生态环境学院,宁夏 银川 750021;3. 宁夏大学地理科学与规划学院,宁夏 银川 750021;4. 宁夏大学生命科学学院,宁夏 银川 750021)
土壤细菌是土壤微生物的重要组成部分,在土壤养分转换、吸收、有机质分解和腐殖质形成等过程中扮演着重要角色[1]。根际是植物与微生物相互作用的场所,植物可通过根系分泌物改变根际土壤属性,影响微生物多样性和群落组成[2]。同时,根际土壤微生物能够促进植物生长及应对环境胁迫,如根际促生细菌和菌根真菌的协同作用,对植物抗逆性发挥积极作用[3]。在我国北方半干旱地区,水分和养分是限制植物生长的关键环境因子,其变化不仅影响植物形态和生理特征,对土壤微生物多样性和群落组成具有重要影响。已有研究表明,土壤pH、水分及养分含量[4-6]能够明显影响根际土壤细菌多样性和群落结构。因而,探究半干旱地区植物根际土壤细菌群落结构的地理变异特征及其影响因素,对于深入理解植物适应干旱环境机理具有重要意义。
植物功能性状是植物在长期进化过程中与环境相互作用形成的适应特征[7],如植物通过增加植株高度以获取更多光能,叶片大小直接影响植物对光截取和碳获取能力[8],比叶面积与植物的光拦截效率和碳获取策略有关[9],叶片碳、氮、磷对植物生长及其生理机能调节具有重要作用,其含量变化与比值能够揭示植物的养分利用策略[10]。植物功能性状与土壤过程和生态系统功能关系密切,在一定程度上能够指示生态系统功能的变化[11],建立植物功能性状与土壤微生物群落结构的关系,可以深入理解植物功能性状适应环境的变化规律[12]。虽然已有学者关注两者的关系,但是研究结果并不一致,如Delgado-Baquerizo 等[13]和Wang 等[14]研究表明植物功能性状与土壤微生物多样性及群落结构存在明显的相关性,而Leff 等[15]研究则认为植物功能性状与土壤微生物群落多样性联系微弱。因而,植物功能性状与根际土壤微生物群落多样性的关系仍需进一步研究。
锦鸡儿属(Caragana)隶属豆科,多年生落叶灌木,主要分布在我国东北、华北及西北等草原和干旱荒漠区,因其根系发达,抗旱、耐贫瘠,具根瘤,能有效改善土壤养分情况,已逐渐成为我国北方干旱半干旱地区植被恢复、防风固沙和水土保持的先锋树种,同时也是优良的饲料牧草,生态和经济价值突出[16]。因而,近年来学者对锦鸡儿属植物的解剖形态、生理生态特征及遗传多样性等方面进行了广泛研究[16-18]。虽然关于该属植物根际土壤微生物群落多样性及其与环境变化的关系已有报道,如Na 等[4,19]研究了锦鸡儿属植物根际土壤细菌多样性和群落结构的变化特征,发现不同生境下锦鸡儿属植物根际土壤细菌群落结构存在显著差异,且在干旱和半干旱地区,土壤属性,特别是土壤pH 对根际土壤细菌群落多样性的构建起着关键作用。尽管如此,锦鸡儿属植物根际土壤微生物群落结构与植物功能性状的关系却鲜见报道,而这些研究对于理解该属植物适应干旱环境具有重要意义。因此,本研究以锦鸡儿属替代分布的近缘种-中间锦鸡儿(Caragana liouana)和小叶锦鸡儿(Caragana microphylla)为研究对象,通过分析2 种锦鸡儿不同地理种群根际土壤细菌多样性与群落结构变化特征及物种间差异,研究根际土壤细菌群落多样性与植物功能性状的关系,为探讨锦鸡儿属植物适应干旱环境微生物学机制提供数据支持,同时为荒漠植物土壤微生物多样性的研究、保护和开发提供相关的基础资料。
1 材料与方法
1.1 采样地点
研究区位于我国北方半干旱地区(37°49′-43°38′N,107°27′-122°17′E),中部和西部属于温带大陆性气候,东部属于温带季风气候,气候干燥,降水稀少,蒸发强烈,年均降水量249~417 mm,年均气温变化范围为1.8~8.5 ℃。伴生种有沙蒿(Artemisia desertorum)、狗尾草(Setaria viridis)、老瓜头(Cynanchum komarovii)和猪毛蒿(Artemisia scoparia)等。具体样点信息见表1。
1.2 土壤样本采集
于2018 年8 月采集中间锦鸡儿和小叶锦鸡儿根际土壤样点共计21 个,其中,中间锦鸡儿11 个,小叶锦鸡儿10 个。每个采样点选择3 块20 m×20 m 的样方,各样方之间距离至少20 m。在每个样方内选择4 株长势一致的植物,每株间隔5 m 以上以减少亲缘关系的影响,挖取植株根,使用无菌剪刀剪下直径小于2 mm 的根,抖去浮土,转至5 mL 无菌离心管中,每个样方内所取得的根混合成1 个样本,即每个采样点3 个重复,共计63 个根样,置于液氮中备用[4]。向盛有新鲜根样的离心管内加入2.5 mL 无菌0.9% NaCl,4 ℃下,12377.30 r·min-1离心10 min,弃去上清液,收集离心管底部根际土壤,此步重复3 次[4]。
1.3 植物样品采集与测定
在每个样方内,取根际土壤样本时,同时测定每株植物的株高(plant height,pheight)、冠幅(crown width,CW)。选取植株向阳中上部5 片健康、完全伸展的叶片,利用游标卡尺(91511,世达,中国上海)分别测量叶长(leaf length,LL)和叶宽(leaf width,LW),采用厚度仪(64200,麦德斯,中国上海)测量叶厚度(leaf thickness,LT),然后将叶片放入蒸馏水中浸泡24 h,取出后用吸水纸将表面水分吸干,测其饱和鲜重。利用扫描仪(CanoScan LiDE110,中国北京)和Image J 软件扫描计算叶面积,置于烘箱内65 ℃烘48 h 至恒重,称干重。根据测量结果分别计算出叶干物质含量(leaf dry matter content,LDMC)=叶干重/叶饱和鲜重,比叶面积(specific leaf area,SLA)=平均叶面积/平均叶干重。叶片碳含量(leaf carbon content,LC)和叶片氮含量(leaf nitrogen content,LN)采用元素分析仪(Elementar Vario Micro cube,德国)测定,叶片磷含量(leaf phosphorus content,LP)采用钼锑抗比色法测定[20]。
1.4 土壤细菌DNA 提取、PCR 扩增和测序
采用中国Magen 公司HiPure Soil DNA Kit 试剂盒提取土壤样本DNA,方法参考试剂盒操作说明。使用Qubit® dsDNA HS Assay Kit 检测样品DNA 浓度。采用16S rDNA 的CCTACGGRRBGCASCAGKVRVGAAT和引物GGACTACNVGGGTWTCTAATCC 对V3+V4 可变区进行PCR 扩增。PCR 扩增反应体系和条件参照文献[21],将PCR 扩增产物用1.5%琼脂糖凝胶电泳检测。由金唯智生物科技有限公司进行后续样品的测序。
1.5 数据处理
双向测序得到的正反向reads 首先进行两两组装连接,过滤拼接结果中含有N 的序列,保留序列长度大于200 bp 的序列。使用CUTADAPT v1.9.1 软件对原始序列进行质量过滤,得到高质量数据,通过UCHIME v4.2软件去除嵌合体序列,得到最终有效数据。使用VSEARCH v1.9.6 软件对序列数据在97%的相似度水平进行聚类。利用RDP classifier 对分类操作单元(operational taxonomic units,OTU)的代表序列进行物种分类学分析。采用QIIME 软件计算菌群多样性指数。利用SPSS 22.0 进行单因素方差分析,分析2 种锦鸡儿不同地理种群植物功能性状差异及土壤细菌优势菌群相对丰度差异;采用Pearson 进行植物功能性状与土壤细菌多样性指数和优势门的相关性分析。利用R(v.3.4.3)绘制土壤细菌优势属结构热图;采用Vegan 数据包进行细菌群落结构的主坐标分析(principal coordinate analysis,PCoA);利用相似性分析(analysis of similarities,ANOSIM)表征2 种植物根际土壤细菌群落结构的差异性;使用Mantel test 分析方法计算土壤细菌群落结构与植物功能性状的相关性。采用Canoco 5.0 进行植物功能性状与土壤细菌群落结构的冗余分析(redundancy analysis,RDA)。
2 结果与分析
2.1 中间锦鸡儿和小叶锦鸡儿植物功能性状特征分析
由表2 可知,中间锦鸡儿不同地理种群的叶长均值为10.54 mm(8.95~11.85 mm),叶宽均值为5.41 mm(4.46~6.06 mm),叶厚度均值为0.25 mm(0.21~0.27 mm),株高均值为174.66 cm(142.58~202.25 cm),冠幅均值为247.42 cm2(199.67~247.42 cm2),比叶面积均值为142.38 cm2·g-1(118.44~172.18 cm2·g-1),叶干物质含量均值为0.29 mg·g-1(0.25~0.34 mg·g-1),叶片碳含量均值为453.83 mg·g-1(447.81~460.63 mg·g-1),叶片氮含量均值为39.92 mg·g-1(31.50~44.33 mg·g-1)和叶片磷含量均值为3.02 mg·g-1(2.12~3.73 mg·g-1)。不同地理种群间叶长、叶宽、叶厚度、株高、冠幅、比叶面积、叶干物质含量、叶片氮含量和叶片磷含量的差异均达到显著水平(P<0.05)。

表2 中间锦鸡儿和小叶锦鸡儿不同地理种群植物功能性状Table 2 The plant functional traits of C.liouana and C.microphylla across different geographical populations
小叶锦鸡儿不同地理种群的叶长均值为9.01 mm(8.06~9.57 mm),叶宽均值为5.52 mm(4.49~6.29 mm),叶厚度均值为0.24 mm(0.23~0.25 mm),株高均值为102.85 cm(33.00~191.83 cm),冠幅均值为237.77 cm2(136.58~325.13 cm2),比叶面积均值为147.88 cm2·g-1(113.16~187.02 cm2·g-1),叶干物质含量均值为0.32 mg·g-1(0.26~0.36 mg·g-1),叶片碳含量均值为450.85 mg·g-1(437.79~458.55 mg·g-1),叶片氮含量均值为40.63 mg·g-1(30.93~50.57 mg·g-1)和叶片磷含量均值为2.85 mg·g-1(2.37~3.47 mg·g-1),且叶长、叶宽、叶厚度、株高、冠幅、比叶面积、叶干物质含量、叶片碳含量和叶片氮含量在不同地理种群间差异均达到显著水平(P<0.01)。
2.2 中间锦鸡儿和小叶锦鸡儿根际土壤细菌多样性
通过Illumina HiSeq 高通量测序,共得到有效序列5185117 条,质量过滤和去除嵌合体后得到4457344 条优质序列,聚类共得到1536 个OTUs。各样品文库的覆盖度均在99.4%以上,说明测序数据合理,能够真实反映出土壤细菌群落的信息。由表3 可知,中间锦鸡儿和小叶锦鸡儿根际土壤细菌Chao1 指数、ACE 指数、香农指数和辛普森指数均无显著差异(P>0.05)。
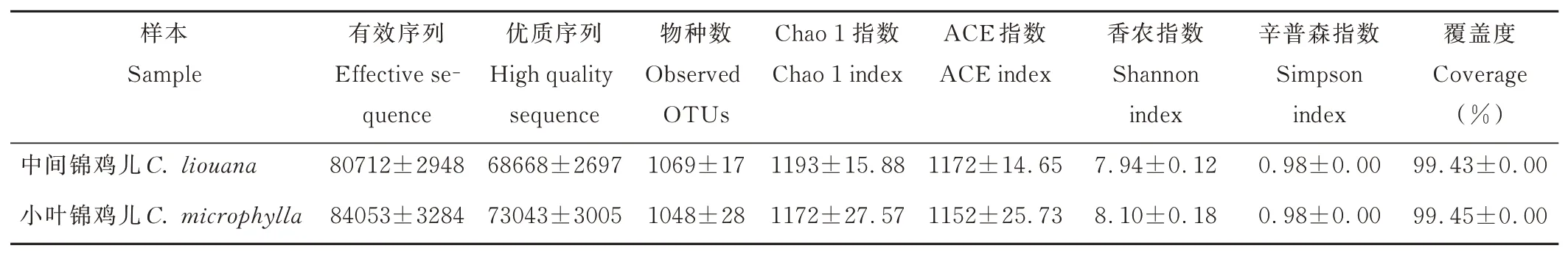
表3 中间锦鸡儿和小叶锦鸡儿根际土壤样品序列数统计和多样性指数Table 3 Sample sequence number statistics and diversity index in rhizosphere soil of C.liouana and C.microphylla
主坐标分析(PCoA)表明(图1),中间锦鸡儿和小叶锦鸡儿根际土壤细菌群落结构组成有明显差异,其中,第一主成分解释了细菌群落总变异的20.92%,第二主成分解释了细菌群落总变异的12.67%。通过相似性分析(ANOSIM)发现,2 种锦鸡儿根际土壤细菌群落结构组成差异显著(R=0.376,P=0.001)。
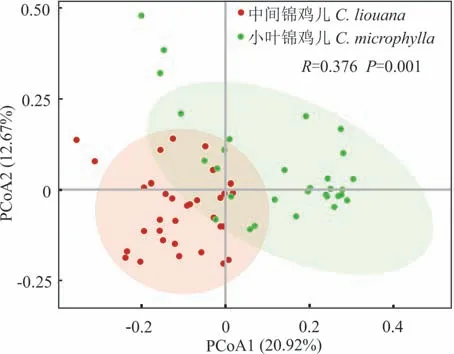
图1 中间锦鸡儿和小叶锦鸡儿根际土壤细菌群落结构的主坐标分析Fig. 1 Principal coordinate analysis of soil bacterial community composition in rhizosphere of C. liouana and C. microphylla
2.3 中间锦鸡儿和小叶锦鸡儿根际土壤细菌优势类群分析
所有样本共检测到细菌22 门62 纲131 目185 科304 属。在门水平上,中间锦鸡儿和小叶锦鸡儿根际土壤细菌均以变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、Patescibacteria、厚壁菌门(Firmicutes)、芽单胞菌门(Gemmatimonadetes)和绿弯菌门(Chloroflexi)为主要类群。土壤细菌群落组成的差异分析表明(表4),中间锦鸡儿根际土壤中变形菌门和拟杆菌门相对丰度显著高于小叶锦鸡儿(P<0.01),而酸杆菌门、放线菌门和芽单胞菌门相对丰度显著低于小叶锦鸡儿(P<0.01)。Patescibacteria、厚壁菌门和绿弯菌门相对丰度在2 种锦鸡儿根际土壤细菌群落中差异不显著(P>0.05)。

表4 门和属水平上中间锦鸡儿和小叶锦鸡儿根际土壤细菌的丰度变化Table 4 Changes in relative bacterial abundance at phyla and genera levels in the rhizosphere soil of C. liouana and C.microphylla
在属水平上,根据注释结果发现(图2),主要优势属为根瘤菌属(Rhizobium)、鞘氨醇单胞菌属(Sphingomonas)、RB41、芽 孢 杆 菌 属(Bacillus)、类 固 醇 杆 菌 属(Steroidobacter)、芽 单 胞 菌 科 未 分 类 的 属(Unclassified_f_Gemmatimonadaceae)、鞘氨醇菌属(Chitinophaga)、不可培养细菌科未分类的属(Unclassified_f_uncultured_bacterium)和中慢生根瘤菌属(Mesorhizobium),且未分类(Unclassified)菌属相对丰度占比最高(16.10%~29.35%)。由表4 可知,根瘤菌属、鞘氨醇单胞菌属、溶杆菌属(Lysobacter)、RB41、红色杆菌属(Rubrobacter)、链霉菌属(Streptomyces)、芽孢杆菌属(Bacillus)和芽单胞菌科未分类的属的相对丰度在2 种锦鸡儿根际土壤中存在显著差异(P<0.05)。其中,小叶锦鸡儿根际土壤中根瘤菌属和溶杆菌属相对丰度显著低于中间锦鸡儿(P<0.05),而鞘氨醇单胞菌属、芽孢杆菌属、RB41、红色杆菌属、链霉菌属和芽单胞菌科未分类的属的相对丰度显著高于中间锦鸡儿(P<0.05)。
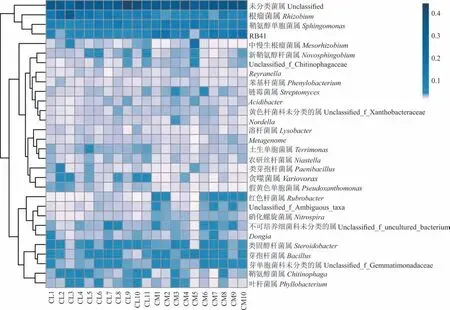
图2 属水平上中间锦鸡儿和小叶锦鸡儿根际土壤细菌群落结构热图Fig.2 Heat map of bacterial community composition in rhizosphere soil of C. liouana and C. microphylla at level of genus
2.4 植物功能性状与土壤细菌群落的关系
如图3 所示,Mantel 检验分析结果表明,细菌群落结构与植物功能性状之间存在显著相关性(P<0.01),说明中间锦鸡儿和小叶锦鸡儿植物功能性状对其根际土壤细菌群落结构有显著影响。
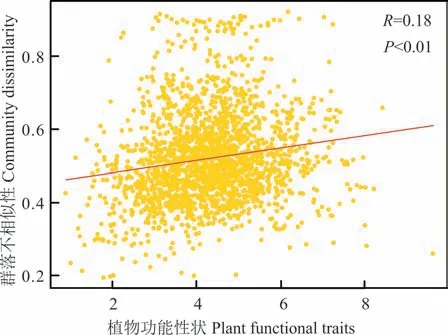
图3 中间锦鸡儿和小叶锦鸡儿土壤细菌群落结构与植物功能性状的关系Fig. 3 The relationship between soil bacterial community composition and plant functional traits of C. liouana and C.microphylla
冗余分析(RDA)表明(图4),第一、二排序轴分别解释了土壤细菌群落结构变化的13.35%和9.11%。蒙特卡罗检验结果显示(表5),株高(F=4.2,P=0.002)、叶干物质含量(F=3.8,P=0.002)、比叶面积(F=3.3,P=0.022)、叶厚度(F=3.4,P=0.008)和叶长(F=2.6,P=0.016)是影响中间锦鸡儿和小叶锦鸡儿根际土壤细菌群落结构变化的主要因子。

表5 植物功能性状对土壤细菌群落结构的影响Table 5 Effects of plant functional traits on soil bacterial community composition
中间锦鸡儿和小叶锦鸡儿根际土壤细菌多样性与植物功能性状的相关性分析表明(表6),叶厚度与Chao1 指数、ACE 指数、香农指数和辛普森指数显著正相关(P<0.05),株高与香农指数显著负相关(P<0.01),叶片碳含量与ACE 指数和香农指数显著负相关(P<0.05),叶片氮含量与香农指数显著正相关(P<0.05)。通过分析优势门与植物功能性状的相关性发现,变形菌门和拟杆菌门与叶长和株高显著正相关(P<0.05);酸杆菌门、放线菌门和芽单胞菌门与叶长和株高显著负相关(P<0.01),与叶片氮含量显著正相关(P<0.05);厚壁菌门与叶片磷含量显著负相关(P<0.05);绿弯菌门与叶厚度显著正相关(P<0.05)。
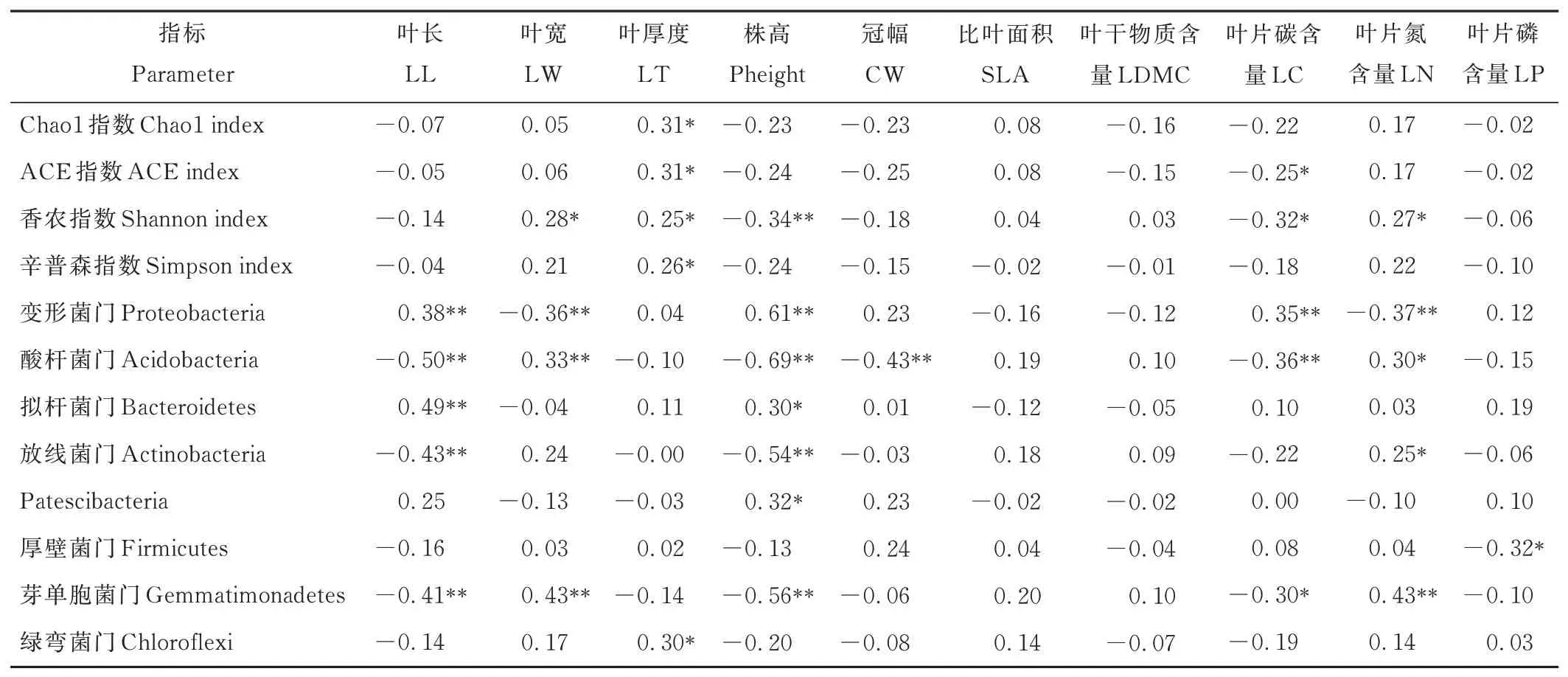
表6 土壤细菌多样性指数、优势种群相对丰度与植物功能性状的相关性Table 6 Correlation of soil bacterial diversity indices and the relative abundance of dominant taxa with plant functional traits
3 讨论
3.1 植物功能性状对根际土壤细菌多样性和群落结构的影响
植物和土壤微生物间复杂的相互作用显著影响陆地生物多样性及生态系统功能和服务[22]。研究发现不同树种根系对根际土壤微生物群落结构影响不同[5],且植物群落多样性与土壤微生物群落多样性呈正相关[23]。植物功能性状反映了植物对环境的适应能力与权衡策略,能够直接或间接影响土壤微生物群落结构[11],如株高和冠幅改变了光照条件和植物的光合作用[24],直接影响土壤微生物生长和微生物群落间的竞争关系,进而影响土壤细菌群落结构。此外,植物功能性状会影响凋落物和腐殖质的数量和质量,通过改变土壤养分含量,从而使土壤微生物群落结构发生变化[13]。如Wang 等[14]对温带沙漠土壤细菌的研究发现叶片碳氮比可以直接影响土壤细菌群落结构变化,Delgado-Baquerizo 等[13]通过对比研究澳大利亚和英国温带草原植物土壤微生物,发现叶片氮含量和比叶面积是驱动土壤细菌群落结构变化的关键因子。本研究结果表明植物功能性状与根际土壤细菌群落结构存在显著的相关性(图3),且株高、叶干物质含量、比叶面积、叶厚度和叶长对根际细菌群落结构具有显著性影响(图4),说明在半干旱区,豆科植物根际土壤细菌群落多样性变化受植物功能性状的影响。然而,Leff 等[15]研究英格兰英格伯勒国家自然保护区土壤微生物时认为其与植物功能性状关系微弱,而与植物物种显著相关,原因可能与研究区域的空间尺度不同有关。

图4 中间锦鸡儿和小叶锦鸡儿根际土壤细菌群落结构与植物功能性状的冗余分析Fig. 4 Redundancy analysis of bacterial community composition and plant functional traits in rhizosphere soil of C. liouana and C. microphylla
植物通过调节其功能性状以适应环境变化,进而影响土壤过程和土壤微生物群落[13]。本研究中土壤细菌多样性与叶厚度呈显著正相关(表6),这是因为在半干旱地区,锦鸡儿属植物通过增加叶厚度的资源投资,减少了植物内部水分和养分的流失[7],有利于提高资源利用效率和光合作用效率[25],作为光合作用产物的根系分泌物随之发生改变,进而影响根际土壤细菌多样性。Millard 等[26]研究发现株高的增加,能够提高土壤微生境资源异质性,促进土壤细菌的生长,然而本研究与其结果不一致,可能是由于锦鸡儿属植物生境中土壤营养物质贫瘠,植株高度的增加,有助于避免其遭受沙埋威胁,但同时也降低了叶片凋落物的数量和地下生物量的投入,导致根际土壤细菌多样性的减少。此外,本研究发现植物叶片氮含量与土壤细菌多样性显著正相关,这与Delgado-Baquerizo等[13]的研究结果一致,原因是叶片作为光合作用的主要场所,积累了大量有机质且能合成蛋白质、核酸等多种化合物[27],通过影响叶片凋落物氮含量及碳氮比,改变凋落物的分解速率,进而影响根际土壤细菌多样性。同时,较高的氮水平有利于维持高光合作用,为植物根系分配更多的光合物质,提高了根际土壤中有机质含量[28],使根际土壤细菌多样性增加。
3.2 中间锦鸡儿和小叶锦鸡儿根际土壤细菌多样性及群落结构差异
土壤细菌的种类和数量对土壤养分转化、植物生长及抗胁迫能力有直接影响,能够反映土壤质量及环境胁迫[29]。丁新景等[5]研究发现黄河三角洲4 种人工林根际土壤细菌多样性存在差异,刘方春等[30-31]研究指出,随着干旱强度的增加,核桃(Juglans regia)根际土壤微生物多样性指数显著降低,樱桃(Cerasus pseudocerasus)根际土壤细菌的数量先增加后减小。在本研究中,中间锦鸡儿和小叶锦鸡儿根际土壤细菌多样性指数间无显著差异,原因可能与植物种类及植物在不同采样点受干旱胁迫强度不同有关。
从群落结构的角度分析,中间锦鸡儿和小叶锦鸡儿根际土壤细菌群落存在显著差异(图1)。在根际土壤中,根系分泌物在介导植物与周围细菌的相互作用中起关键作用[28]。已有研究表明,根系分泌物对根际土壤细菌群落结构具有选择塑造作用,环境条件的改变会影响根系分泌物成分变化[32],这可能是造成2 种锦鸡儿根际土壤细菌群落结构产生差异的原因。本研究中,2 种锦鸡儿根际土壤细菌均以变形菌门、酸杆菌门、拟杆菌门和放线菌门为主要类群,这些优势菌群具有一定的耐旱性,能够适应极端干旱环境。其中,变形菌门是细菌中最大的菌门,包含多种代谢种类的细菌,土壤有机质含量越高,其生长越好,且能够增强土壤的固氮能力[33]。拟杆菌门中的菌株作为有机碳的主要矿化者,可以增加土壤有机碳的含量,并为微生物生长及土壤酶活性提供能量[34]。研究发现中间锦鸡儿根际土壤中变形菌门和拟杆菌门相对丰度显著高于小叶锦鸡儿,这是由于中间锦鸡儿较小叶锦鸡儿更适应干旱环境[35],植物生长状况较好(表2),通过影响凋落物和根系分泌物的输入,改变了地下土壤有机碳含量[28],有机碳的累积为变形菌门和拟杆菌门中的菌株生长繁殖提供了有利条件,且变形菌门和拟杆菌门属于富营养细菌,能有效利用土壤中碳、磷营养元素,从而促进两类优势菌的生长。小叶锦鸡儿根际土壤中酸杆菌门、放线菌门和芽单胞菌门相对丰度显著高于中间锦鸡儿。已有研究表明,酸杆菌门中的菌株是一类新划分出的细菌类群,目前已知酸杆菌门属于寡营养型细菌,具有较强的抗逆性,能够在土壤养分匮乏的环境中生存,并对该条件下的纤维素降解起到重要作用[36]。刘方春等[31]研究指出,水分含量会影响植物根系的生长和活力,从而影响植物根系分泌物的含量,中间锦鸡儿生长环境较干旱,导致根际土壤中放线菌门的相对丰度降低,且放线菌门中的菌株具有共生固氮和解磷作用[37],在土壤氮素循环中发挥着重要作用。在属水平上,根瘤菌属是2 种锦鸡儿土壤中已分类菌群中的优势属(1.61%~22.11%),且中间锦鸡儿根际土壤中根瘤菌属的相对丰度显著高于小叶锦鸡儿。根瘤菌属于革兰氏阴性细菌,能与豆科植物形成共生固氮体系[38],提高土壤中氮素含量,使土壤肥力得到改善。同时,豆科植物中根瘤菌具有解磷机制[39],能够利用难溶性磷,使植物在低磷土壤上正常生长,Li 等[40]研究柠条锦鸡儿(Caragana korshinskii)根瘤菌遗传多样性时发现,土壤中速效磷含量是影响根瘤菌分布的主要因子。这些研究有助于解释中间锦鸡儿相对于小叶锦鸡儿更能适应干旱和养分匮乏的环境。此外,本研究发现,在属分类水平上未分类菌群占细菌总数的16.10%~29.35%,说明2 种锦鸡儿根际土壤中还存在未被挖掘利用的微生物资源,需要进一步探索。
4 结论
中间锦鸡儿和小叶锦鸡儿根际土壤细菌以变形菌门、酸杆菌门、拟杆菌门和放线菌门为主要类群,且中间锦鸡儿根际土壤中变形菌门和拟杆菌门的相对丰度显著高于小叶锦鸡儿(P<0.01),酸杆菌门、放线菌门和芽单胞菌门的相对丰度显著低于小叶锦鸡儿(P<0.01)。而且2 种锦鸡儿根际土壤细菌群落结构与植物功能性状之间存在显著相关性(P<0.01),且冗余分析结果表明,株高、叶干物质含量、比叶面积、叶厚度和叶长是影响土壤细菌群落结构构建的主要因素。本研究验证了植物功能性状能够影响土壤微生物群落结构,为进一步探究荒漠地区植物土壤微生物群落多样性与环境因子的相关性提供了理论基础。
