非小细胞肺癌c⁃MET、BRAF、ROS1基因突变与临床特征的关系
2022-08-05周荣根王燕陈基升董森森
周荣根 王燕 陈基升 董森森
肺癌是临床常见的一种恶性肿瘤,有着较高发病率和死亡率,其中以非小细胞肺癌(non⁃small cell lung cancer,NSCLC)最为常见,其占所有肺癌类型的80%~85%,包括腺癌、鳞癌、腺鳞癌等。早期诊治有助于控制病情发展,延长患者生存期[1]。近年来,随着对肺癌发病机制及其生物学行为研究的不断深入,临床日益聚焦以特异性高、副作用小为特征的基因分子靶向治疗。靶向基因测序是一种很有前景的检测方法和手段,可为基因检测降低材料使用和减少检测时间。常规检测ALK、ROS1基因突变在晚期NSCLC 诊治中已成为诊断共识。研究发现,除这些基因突变外,c⁃MET基因突变也是NSCLC 发生及对EGFR⁃TKI 药物耐药的一个机制[2]。本研究通过检测确诊为NSCLC 患者病灶组织中c⁃MET、BRAF、ROS1基因突变表现,并与临床病理特征的关系,为临床靶向诊治提供潜在新靶点和依据,现报告如下。
1 资料与方法
1.1 一般资料
选取南阳市第二人民医院胸外科2019年1月至2022年2月诊治的82 例NSCLC 初诊患者,均为经影像学、病理学检查等确诊,符合《肺癌筛查与管理中国专家共识》相关诊断标准[3]。其中,男性44例,女性38 例;平均年龄(56.9±5.6)岁;病理类型:腺癌69 例,鳞癌13 例;肿瘤分期:Ⅰ期14 例,Ⅱ期23 例,Ⅲ期35 例,Ⅳ期10 期;吸烟史:有48 例,无34 例;淋巴转移:有39 例,无43 例;肿瘤侵润深度:T1 14 例,T2 20 例,T3 30 例,T4 18 例。纳入标准:①年龄≥18 岁;②肺癌TNM 分期为Ⅰ~Ⅳ期;③均接受手术或病理检查;④临床依从性良好;⑤所有患者对研究知情并同意。排除标准:①伴精神障碍或意识不清楚者;②预计生存期<3 个月者;③临床资料不全者;④有药物过敏史者。收集所有患者手术切除或穿刺活检石蜡包埋病灶组织切片标本。收集所有患者手术切除或穿刺活检石蜡包埋病灶组织切片标本。本研究经院伦理委员会批准。
1.2 方法
①提取:根据试剂盒说明书,使用QIAamp DNA微量核酸提取试剂盒(Qiagen, Heidelberg, Germa⁃ny)和QIAamp DNA FFPE 组织试剂盒(Qiagen,Heidelberg, Germany)从冷冻组织和FFPE 样本中提取DNA。 使用NanoDrop1000 分光光度计(NanodropTechnologies,Wilmington,USA)和Qubit量子荧光计(Invitrogen,Carlsbad,USA)对DNA 浓度进行定量。利用安捷伦2100 生物分析仪(Agi⁃lent,Saint Clara, USA)使用高灵敏度DNA 试剂评估碎片状态,以产生DNA 完整性数(DIN)。此外,还进行了质量控制(QC)步骤,以通过多重聚合酶链反应(PCR)评估FFPE DNA 的完整性。②针对靶向基因测序,定制了一个由23 个肿瘤相关基因组成的panel。通过E220 聚焦超声仪Covaris(Covaris,Woburn,MA,USA)对每个样本中的300纳克gDNA 进行机械破碎和片段化。DNA 片段的目标大小在150 到200 bp 之间。然后,使用KAPA文库制备试剂盒(KAPA Biosystems Inc.,Wilming⁃ton,USA)将10⁃100 ng DNA 用于文库构建,按照该试剂盒制造商的说明,通过末端修复、加A 拖尾和接头连接构建。最后,使用xGen 锁定探针池(IDT 技术)捕获NGS 文库,并使用1×KAPA HiFi热启动Ready Mix 通过12⁃13 个PCR 周期扩增捕获的DNA 片段。然后在Illumina Nova 测序仪上使用150PE 模式对文库产物进行测序。以>3000×的平均覆盖率对FFPE 样本和>200×的平均覆盖率对配对的样本进行测序,并记录相关数据。
1.3 统计学方法
采用SPSS 20.0 软件包进行数据分析;计数资料以n(%)表示,通过卡方检验、Fisher 精确检验对各基因与临床病理特征进行组间比较;以P<0.05表示差异有统计学意义。
2 结果
2.1 患者c⁃MET、BRAF、ROS1 基因突变情况
病理HE 染色见图1,可见肿瘤细胞呈簇状、片状或散在排列,胞核染色质粗糙、核仁清晰,胞质丰富。c⁃MET基因突变占比36.59%,BRAF基因突变占比15.85%,ROS1基因突变占比6.10%;c⁃MET与ROS1基因突变共存有1 例,占比1.22%。见表1。
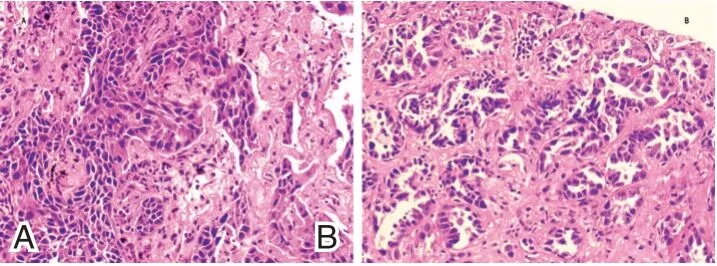
图1 NSCLS 病灶组织HE 染色图(HE 染色,×400)Figure 1 HE staining of NSCLS focal tissues(HE staining,×400)

表1 NSCLS患者c⁃MET、BRAF、ROS1基因突变比例[n(%)]Table 1 Proportion of c⁃MET,BRAF and ROS1 gene mutations in NSCLS patients[n(%)]
2.2 c⁃MET 基因突变与临床病理特征的关系
c⁃MET基因突变型与野生型在性别、年龄、肿瘤分期、病理类型方面比较,差异有统计学意义(P<0.05)。见表2。
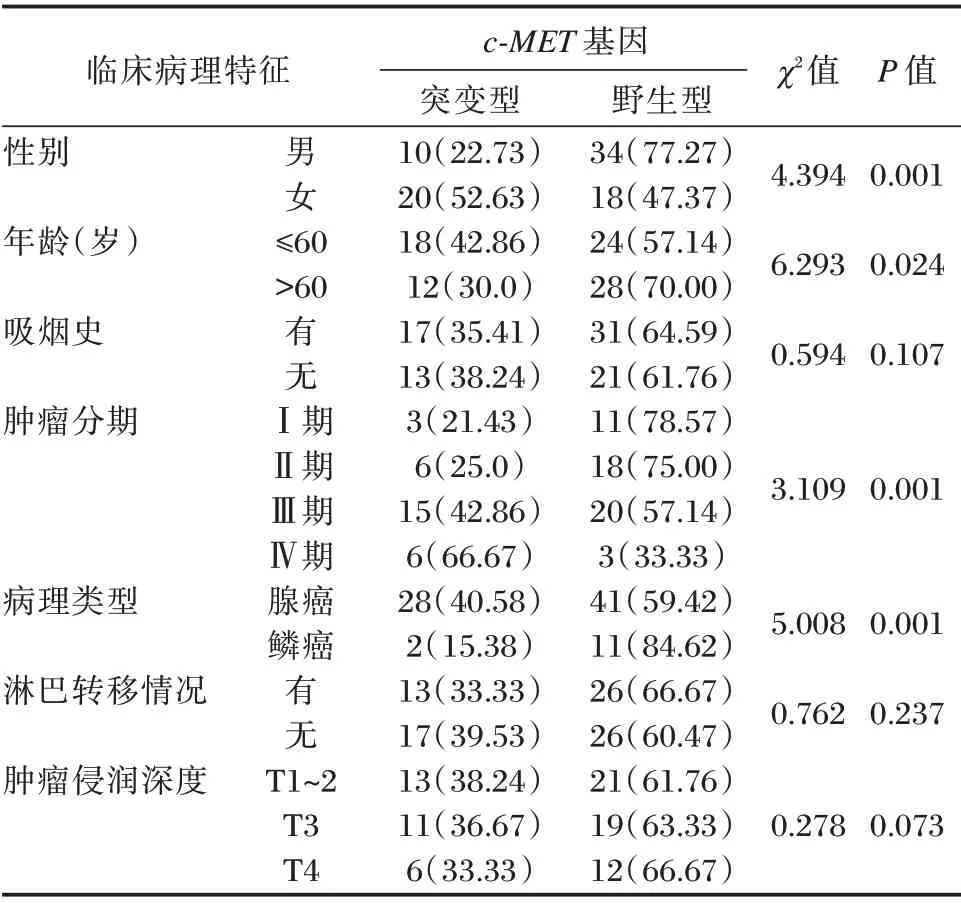
表2 c⁃MET 基因突变和NSCLC 病理特征的关系[n(%)]Table 2 Relationship between c⁃MET gene mutation and PATHOLOGICAL features of NSCLC[n(%)]
2.3 BRAF 基因突变与临床病理特征的关系
BRAF基因突变型的肿瘤侵润深度整体低于野生型,差异有统计学意义(P<0.05)。见表3。

表3 BRAF 基因突变和NSCLC 病理特征的关系[n(%)]Table 3 Relationship between BRAF gene mutation and PATHOLOGICAL features of NSCLC[n(%)]
2.4 ROS1 基因突与临床病理特征的关系
ROS1基因突变型的男性占比、年龄、有吸烟史占比、鳞癌及腺癌及临床Ⅲ期、Ⅳ期占比均低于野生型,差异有统计学意义(P<0.05)。见表4。

表4 ROS1基因突变与NSCLC临床病理特征的关系[n(%)]Table 4 Relationship between ROS1 gene mutation and clinicopathological features of NSCLC[n(%)]
3 讨论
当前,临床采取的个体化靶向治疗主要是针对EGFR突变型的NSCLC,此种NSCLC 有着明确的基因靶点及相关检测技术、靶向药物,临床治疗效果提升。之后在肺癌中越来越多驱动基因被发现,包括ROS1、c⁃MET、BRAF等。
ROS1是一种酪氨酸激酶胰岛素受体基因,已在数种肿瘤细胞株中检测出高表达[4⁃5]。其染色体重排是NSCLC 一个新亚型,为独特的受体酪氨酸激酶,在进化上和ALK 有着密切关系[6]。有研究表明[7],小分子酪氨酸激酶抑制剂对ROS1基因重排具有较显著的的抗肿瘤活性,ROS1能够作为潜在的靶向治疗分子。本研究结果表明女性、年龄≤60 岁、吸烟者、晚期腺癌患者的ROS1基因突变率较高。从临床病例看,ROS1突变患者多见于年轻患者,与文献报道基本一致[8]。
目前,c⁃MET基因已成为NSCLC 靶向治疗的新热点[9]。在NSCLC 中,c⁃MET蛋白异常活化可通过多种机制发生。临床研究认为c⁃MET基因突变与NSCLC 患者的性别、年龄、吸烟状态、肿瘤组织类型和临床分期无相关性[10],但本研究发现c⁃MET基因突变与患者与性别、年龄、肿瘤分期、病理类型有关。但c⁃MET基因的突变、扩增、表达等概率较低,研究显示[11],c⁃MET基因发生14外显子跳跃性突变与扩增概率仅2%~6%与1%~5%。
BRAF基因作为RAF基因家族中重要一员,其基因突变类型以V600E 常见,在BRAF突变中可占大约90%[12]。本研究发现,BRAF基因在肿瘤浸润深度T3、T4 患者中突变率较高。相关研究表明[13],BRAF基因突变型NSCLC 患者无法从抗EGFR 单抗治疗中获益,且BRAF基因突变的转移性NSCLCD 预后差,突变患者无进展生存期和总生存期较野生型的患者明显缩短。有研究对NSCLC 患者进行基因检测,发现BRAF与ALK双基因突变发生率约0.3%[14]。
一般认为,同一患者中ROS1融合基因突变与c⁃MET基因突变不共存,但近期随着ROS1基因与c⁃MET基因检测的推广及检测人群增加,相继出现两者基因突变共存个案报道,大部分为女性,无吸烟史,病理类型大部分为腺癌较年轻患者。本研究中,c⁃MET与ROS1基因突变共存为1.22%,与相关报道相符。与传统观点认为ROS1融合基因会导致c⁃MET突变患者对酪氨酸激酶抑制剂耐药不同,研究显示对c⁃MET和ROS1共存突变患者加用相应抑制剂治疗,可提高患者的总体生存率。本研究结果意味着部分NSCLC 患者可用靶向药克唑替尼治疗。
综上,c⁃MET基因突变易发生于女性、年龄≤60岁以及不吸烟及腺癌的患者,ROS1基因突变好发于腺癌患者,BRAF可能与肿瘤侵润深度有关。
