水体pH对尼罗罗非鱼生长、营养组成和肉质的影响
2022-08-04顾亭亭吕宏波王月杜震宇乔芳
顾亭亭 吕宏波 王月 杜震宇 乔芳
(华东师范大学生命科学学院,水生动物营养与环境健康实验室,上海 200241)
在水产养殖中,水体富营养化、氨氮排放及水中溶氧等因素均会引起水体pH的变化,而水体pH的变化可能会导致鱼体酸碱平衡、离子调节和氨排泄的紊乱[1]。因此,水体pH是养殖水体重要的理化参数之一,对水生动物体内稳态的维持起着非常重要的作用。但是,不同鱼类对水体pH变化的耐受力不同,研究认为4.5—9.0是大多数鱼类可以生存的水体环境pH范围[2],然而部分耐酸性鱼类如斜齿鳊(Rutilus rutilus)、珠星三块鱼(Tribolodon hakonensis)和宝莲灯鱼(Cheirodon axelrodi)可以在pH小于4的水体环境中存活[3]。更有研究进一步指出,在pH为4—8的范围内大盖巨脂鲤(Colossoma macropomum)的体重和生长率与pH的增加成反比,说明其在酸性水体中反而表现出更好的生长性能[4]。水体pH对鱼类的生长和健康状况有重要影响,研究表明偏离最适范围的水体pH对一些鱼类的生长和健康不利[5,6]。嗜酸性的大盖巨脂鲤如果长时间暴露于碱性水体中,其血液生化指标会发生显著变化,并且生长受到抑制[4]。而低pH水体环境则会导致溪红点鲑(Salvelinus fontinalis)的孵化率显著降低,并造成幼鱼行动迟缓[7]。
养殖水体的参数如盐度、水温和pH等也会影响养殖鱼类肌肉的营养组成及品质[8]。研究发现,随着水体盐度的提升,大菱鲆幼鱼(Scophthal musmaximus)[9]、虹鳟(Salmo gairdnerii)[10]和樱鳟(Oncoryhnchus masou)[11]肌肉中PUFA尤其是EPA和DHA的含量会出现显著上升,鱼肉的营养价值得到提升。也有研究表明,水体温度的增高会导致鲫鱼肌肉中脂肪含量显著降低[12]。王双耀等[5]还指出随着水体pH的升高,大菱鲆的全鱼脂肪含量整体呈现下降趋势,而全鱼蛋白含量呈先升后降的变化趋势。但是,目前水体pH对于鱼类肌肉营养成分的影响仅涉及少量的几个指标,尚未有研究深入探讨水体pH对鱼类肌肉营养品质和质构特性的影响。
尼罗罗非鱼(Oreochromis niloticus)是最受欢迎的水产养殖鱼类之一,因为它们对恶劣的环境条件具有较高的耐受性,而且生长速度快、肌肉质地较好[13,14]。已有诸多文献指出,水体pH会对尼罗罗非鱼的生长和健康状况有所影响,Moshood等[15]指出当水体pH<6时,尼罗罗非鱼的死亡率会随着pH降低而增高,并在pH=3时达到100%。Nobre等[16]发现用Na2CO3+CaCl2配伍中和酸性养殖水体时,养殖尼罗罗非鱼幼鱼生长最好,并且在水体pH为5—6的偏酸性水域中也能很好地适应。Rebouças等[17]进一步指出尼罗罗非鱼在偏酸性的水体环境中(pH为4、5、6)比在偏碱性的水体环境中(pH为8)表现出更好的生长性能。随着人们生活水平的不断提高,消费者对于水产品的营养价值及品质的要求也越来越高。因此,水产从业者不仅要考虑养殖动物的生长性能,还要关注其肉质及营养品质。而水体环境尤其是pH,对于罗非鱼肌肉营养成分及肌肉品质的影响尚未见报道。
因此,本实验设置低(pH=4)、中(pH=7.2)、高(pH=8.5)3个水体pH梯度,投喂初重为(1.9± 0.1) g的尼罗罗非鱼10周,并测定其生长性能、血清生化指标、肌肉营养成分和肉质相关指标,以期探讨水体pH对尼罗罗非鱼生长、肌肉的营养组成和肉质的影响。
1 材料与方法
1.1 实验设计
实验所用罗非鱼购自广东添发鱼苗公司,鱼苗运送至本实验室后暂养2周直至稳定。挑选状态良好,并且体重在(1.9± 0.1) g的鱼均匀分到9个容积为256 L的养殖缸中,每个养殖缸中30条鱼。实验期间使用配制纯化饲料(蛋白含量35.79%,脂肪含量5.98%;表 1和表 2),如前所述[8]制作直径为1 mm的颗粒饲料,自封袋包装后放于-20℃ 冰箱中备用。设置低(pH=4)、中(pH=7.2)、高(pH=8.5)3个水体pH梯度(即3个处理组),每个处理组3个平行,每天投喂量为体质量的4%,投喂后半小时收集残饵,烘干后称重以准确计算摄食率,每2周称1次重量以调整投喂量。实验用水分别由曝气水和盐酸或氢氧化钠配置而成,具体配置方法参照El-Sherif等[6]的研究,每日换水1次,换水量为30%,水体pH通过1 mol/L的HCl和1 mol/L NaOH 溶液进行调节,用pH计(LC-pHB-1A,上海力辰邦西仪器科技有限公司)对水体pH每天早晚各进行一次校正,pH日变化幅度不超过±0.2。养殖实验在华东师范大学生物实验站进行,保证水温恒定在(28.5±0.8)℃,溶解氧含量(6.9±0.5) mg/L,共历时10周。

表1 实验饲料配方Tab.1 Formulation of the experimental diets
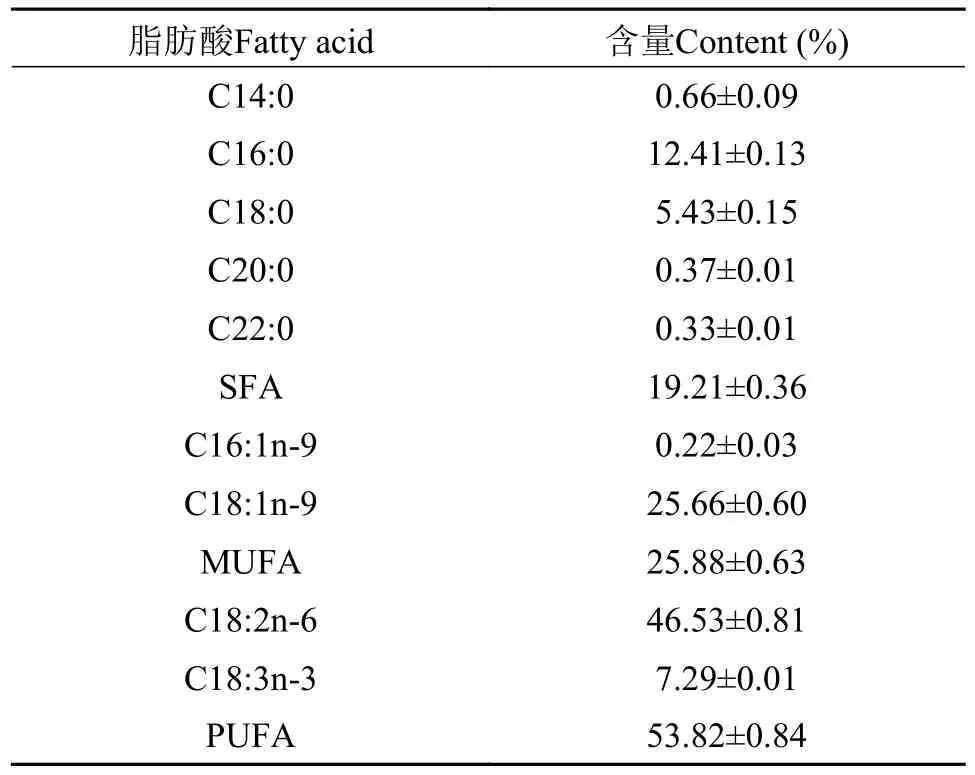
表2 实验饲料脂肪酸组成Tab.2 Fatty acid composition of experimental feed
1.2 样品采集和生长指标测定
在10周实验结束后,从每个缸内随机取2条(即每组6条鱼),用麻醉剂 MS-222麻醉后置于-20℃ 冰箱,以供全鱼成分分析。另外,每个处理组内随机取8尾鱼用于抽血及血清提取。将鱼用麻醉剂 MS-222麻醉后,用无菌注射器抽取1 mL 血液至离心管中,4℃ 静置12h,3000 r/min 离心10min,取100 μL上层血清置于 2.0 mL 离心管中,储存于-80℃ 冰箱中待测。另外,再从每个处理组内随机取8尾鱼,采用相同方式麻醉后称重,测体长,取内脏团、肝脏和腹腔脂肪称重并保存至-80℃ 冰箱做进一步分析。去皮后切下背部白肌,其中一侧背肌用作肉质分析,另一侧背肌保存于-80℃ 冰箱用于后续生化实验。10周增重率、饲料系数、肝体比、脂体比和脏体比的计算如下:
增重率(WGR,%)=(Wt-W0)/W0×100
饲料系数(FCR)=Wf/(Wt-W0)
脏体比(VSI,%)=Wv/W×100
肥满度(CF,g/cm3)=W/L3×100
肝体比(HSI,%)=Wh/W×100
脂体比(MFI,%)=Wm/W×100
式中,Wt为终末体质量 (g),W0为初始体质量 (g),Wf为摄入饲料量 (g),Wv为鱼内脏重 (g),W为鱼体质量 (g),L为鱼体长 (cm),Wh为鱼肝脏重 (g),Wm为鱼腹腔脂肪重(g)。
肝脏和肌肉组织中的糖原、乳酸及甘油三酯等生化成分的含量均采用南京建成生物工程研究所生产的相关试剂盒测定,称取一定重量组织后加入9倍的生理盐水,组织研磨仪(上海净信,型号Tissuelyser-24)充分匀浆,其余操作均按试剂盒说明书进行;血清中的谷草转氨酶和谷丙转氨酶的活性,及血糖、甘油三酯、乳酸和胆固醇的含量也用相应试剂盒测试,每个指标均进行8个重复。
新生儿肺透明膜病伴羊水吸入性肺炎死亡法医解剖附1例报告 …………陈嘉妮,陈继樑,杨文仲,杨开明(82)
1.3 肌肉的理化特性及营养成分分析
常规生化指标的测定将存放于冰箱内的全鱼和肌肉组织取出后,解冻并进行常规营养成分分析。全鱼及肌肉常规成分分析采用相同的实验方法,以下指标均参照国际标准法 AOAC[18],水分采用 105℃ 烘干法,粗蛋白采用凯氏定氮法 (FOSS Kjeltec 8200,瑞典),灰分采用 550℃ 灼烧法至恒重。全鱼及肌肉的粗脂肪提取采用氯仿-甲醇法,取0.4 g烘干的样品粉末于试管中,加入6 mL的氯仿甲醇(氯仿∶甲醇=2∶1),振荡后于4℃冰箱中静置过夜,再加入1 mL 0.37 mol/mL的氯化钾溶液振荡离心,取下层油相后进行真空干燥,即得到粗脂肪。肌肉中提取出的脂肪保存于-20℃冰箱中用于后续的脂肪酸分析。全鱼营养成分的测定为每组6个重复,肌肉营养成分的测定为每组8个重复。
离心失水率与蒸煮损失测定本实验中离心失水率和蒸煮损失率的测试均参考以往的实验方法[8],每个处理设置8个重复。
肌肉脂肪酸成分分析脂肪酸采用气相色谱法(GC)分析[19]。取保存于-20℃冰箱的肌肉脂肪,冷却至室温后进行脂肪酸检测。将2 mg脂质溶解在氯仿/甲醇(2∶1,v/v)中,向样品中加入1 mL甲醇KOH(0.5 mol/L),并在65℃下保持30min。加入1 mL 14%BF3-CH3OH后,将混合液在75℃下加热30min。然后在离心(2000 r/min,5min)之前加入1 mL己烷(色谱纯,>95%)和1 mL ddH2O。将上清液移至新的试管中,并用氮气真空干燥,然后加入200 μL己烷(色谱纯,>95%)进行分析。该分析使用气相色谱仪(Shimadzu 2010 Plus,日本)进行,高纯氮气(99.99%)用作载气,流速为7.8 mL/min。柱温以4℃/min的速度从120℃上升到240℃,并在240℃下保持30min。喷射器和探测器的温度分别设置为280和300℃。脂肪酸种类的鉴定通过与标准混合物(Supelco37 Component FAME Mix in Dichloromethane,USA)的保留时间进行比较来确定,并通过峰面积的比值计算得到各种脂肪酸的相对含量。
1.4 肌肉质构特性测定
根据已有报道[20],肉类质地通常用TPA (Texture Profile Analysis) 特性来表征。本研究中利用Brookfield CT3质构仪(Brookfield Engineering Laboratories,INC.Middleboro Massachusetts,USA)对罗非鱼肌肉的质构指标进行测定,相关参数包括:硬度、弹性、黏聚性和咀嚼度。探头类型为TA3/100,测试速度为0.5 mm/s,目标值为0.5 mm,循环次数为2。
1.5 数据分析及处理
使用SPSS 20.0(IBM,armonk,USA)进行单因素方差分析(ANOVA),结果用(mean±SE)表示。显著性差异设为P<0.05,极显著性差异设为P<0.01。所有表格均使用Excel制作。
2 结果
2.1 水体pH对尼罗罗非鱼生长的影响
如表 3所示,相比于对照组,低pH和高pH的水体环境都显著降低了尼罗罗非鱼的增重率(P<0.05),但是3组的肥满度之间并未出现显著差异;高pH组尼罗罗非鱼的脏体比显著低于低pH组和对照组(P<0.05);然而脂体比和脏体比与其余两组并无显著差异;低pH组尼罗罗非鱼的饲料系数和脏体比均显著高于其余两组(P<0.05)。以上结果显示,不论是低pH还是高pH处理对尼罗罗非鱼的生长都会产生不利影响,并且低pH处理使尼罗罗非鱼的饲料系数和脏体比显著增高,高pH处理会使尼罗罗非鱼的脏体比减小。
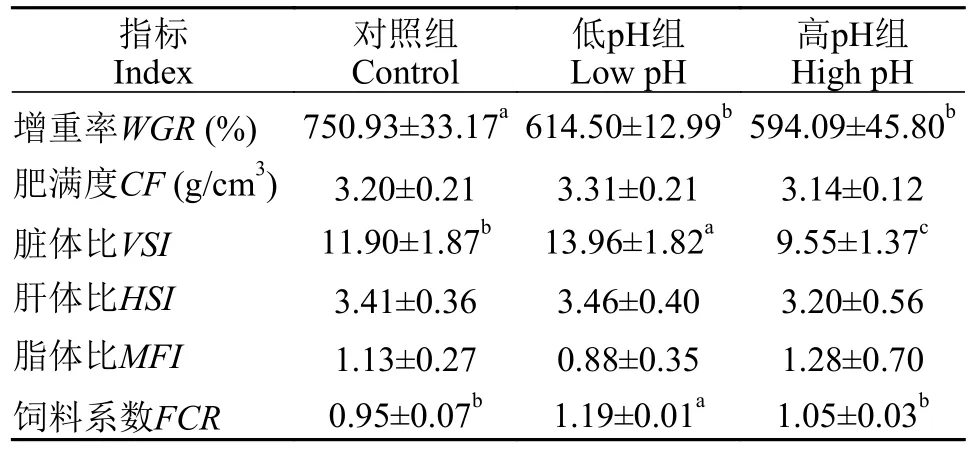
表3 水体pH对尼罗罗非鱼生长性能的影响Tab.3 Effects of water pH on growth performance of Oreochromis niloticus
2.2 水体pH对尼罗罗非鱼体成分和肝脏代谢的影响
如表 4所示,相比于对照组,低pH和高pH的水环境都显著提高了尼罗罗非鱼肝脏的糖原含量(P<0.05);然而水体pH对于全鱼的蛋白质、脂质、灰分、水分含量以及肝脏乳酸和甘油三酯的含量均无显著影响(P>0.05)。以上结果显示,低pH和高pH的水体环境可能会对尼罗罗非鱼的糖代谢产生影响,而对其体成分并无显著影响。
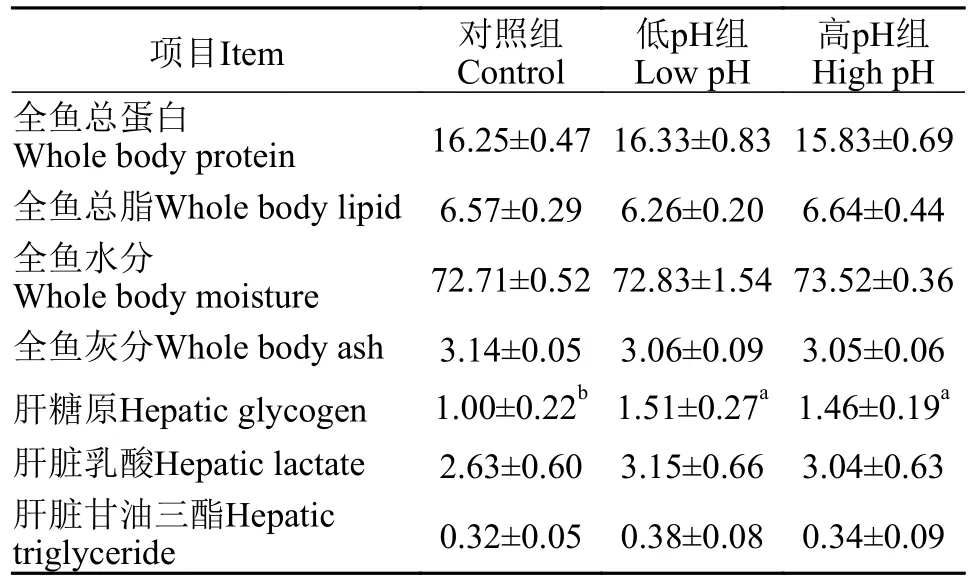
表4 水体pH对尼罗罗非鱼体成分和肝脏代谢的影响Tab.4 Effects of water pH on body composition and liver metabolismof Oreochromis niloticus
2.3 水体pH对尼罗罗非鱼血清生化的影响

表5 水体pH对尼罗罗非鱼血清生化的影响Tab.5 Effects of water pH on biochemical indexes of Oreochromis niloticus
2.4 水体pH对尼罗罗非鱼肌肉营养品质的影响
如表 6所示,相比于对照组,低pH和高pH组的尼罗罗非鱼肌肉乳酸的含量均出现了上升,且高pH组表现出显著性差异(P<0.05);但是低或高pH水环境对于尼罗罗非鱼的肌肉总蛋白、总脂肪,水分、糖原含量及甘油三酯的含量均没有影响(P<0.05)。以上结果表明,水体pH的变化会导致尼罗罗非鱼肌肉乳酸的富集,但是对肌肉营养成分无影响。
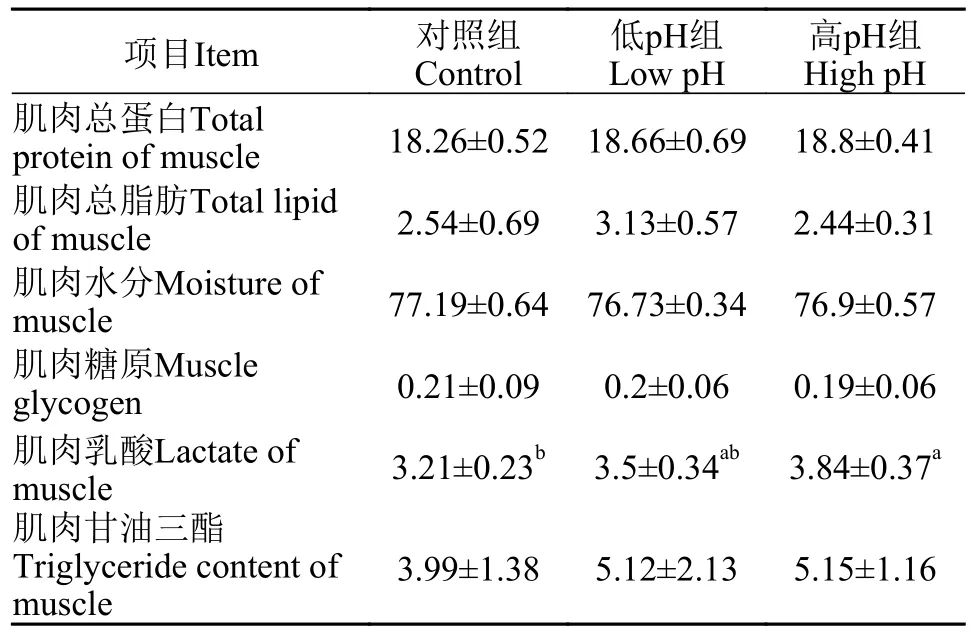
表6 水体pH对尼罗罗非鱼肌肉成分的影响Tab.6 Effects of water pH on muscle composition of Oreochromis niloticus
从表 7中可以看出,相对于对照组,高pH的水体环境显著降低了尼罗罗非鱼肌肉中的饱和脂肪酸(SFA)的相对含量,而提高了多不饱和脂肪酸(PUFA),特别是n-3PUFA的相对含量 (P<0.05)。以上结果表明水体pH会影响尼罗罗非鱼肌肉脂肪酸的组成,高pH的养殖水环境会提高肌肉中PUFA的相对含量,特别是n-3PUFA的含量,从而提高尼罗罗非鱼肌肉脂肪酸营养价值。

表7 水体pH对尼罗罗非鱼肌肉脂肪酸组成的影响Tab.7 Effects of water pH on fatty acid composition in the muscle of Oreochromis niloticus
2.5 水体pH对尼罗罗非鱼肌肉物理特性的影响
从表 8可以看出,高pH组罗非鱼肌肉的蒸煮损失率显著高于对照组,而黏性显著降低(P<0.05)。低pH组罗非鱼肌肉的弹性显著低于其余两组(P<0.05)。高低pH水环境对于肌肉的离心失水率、硬度和咀嚼指数均没有影响。以上结果表明,高pH水环境会降低罗非鱼肌肉的保水能力和黏性,而低pH水环境会降低罗非鱼肌肉的弹性。
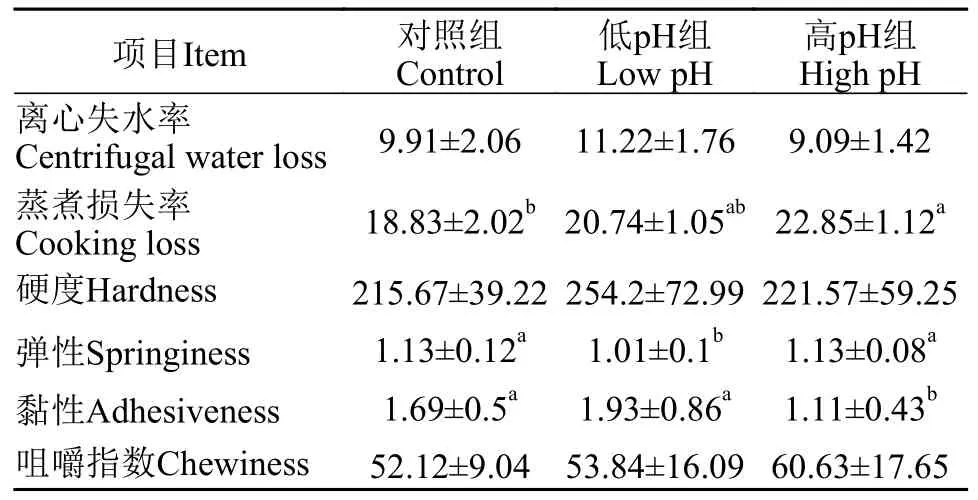
表8 水体pH对尼罗罗非鱼肌肉物理特性的影响Tab.8 Effects of water pH on physical properties of muscle of Oreochromis niloticus
3 讨论
3.1 水体pH对尼罗罗非鱼生长的影响
尽管淡水鱼对于水体pH的变化具有一定的耐受力,但是不适宜的水体pH仍会对鱼类产生代谢压力进而影响生长[21]。有研究指出,过高pH的水体环境会造成鳃对Na+和Cl-的通透性降低,影响鱼类的渗透调节,而Na+和Cl-离子在渗透调节和细胞内外pH控制中发挥着重要作用,因此鱼类必须将部分用于机体发展的能量转移到应对渗透压的变化中,最终影响鱼类的生长和生存[22]。El-Sherif等[6]的研究表明尼罗罗非鱼养殖的最佳水体pH在7—8,低于或者高于该范围的水体pH都会对尼罗罗非鱼的生长造成抑制。在本研究中,相比于对照组(pH 7.2),pH分别为4和8.5的水环境均造成尼罗罗非鱼的增重率显著下降,表明过高或者过低pH水体环境均抑制尼罗罗非鱼的生长,该结果与El-Sherif等[6]的报道一致。研究显示低pH水体环境会通过H+的渗透和吸收影响鱼体血液的pH,从而破坏其输氧功能,造成呼吸困难,对饲料的利用率降低[23]。Rebouças等[17]指出pH为4的水体环境提高了尼罗罗非鱼的饲料系数,饲料效率降低,这与本实验的结果是一致的。在本研究中,相比于对照组,低pH组尼罗罗非鱼的饲料系数显著提高,但是高pH组与对照组并无显著差异,这表明在低pH的环境下,尼罗罗非鱼需要摄入更多的食物以提供更多的能量来应对恶劣环境以维持自身生长。另外,在本研究中,相较于对照组,低pH组尼罗罗非鱼的脏体比显著升高,而增重率显著降低,间接说明在低pH水环境中尼罗罗非鱼的内脏占比上升,从而降低了可食用部分的比率。但本研究也发现,高pH处理则导致脏体比下降,表明内脏器官重量占比下降,提示可食用部分比率的上升。
3.2 水体pH对尼罗罗非鱼体成分和代谢的影响
在面对胁迫时,鱼类的代谢功能会发生变化,并利用自身贮存的脂肪、蛋白质和糖类等来提供能量以应对胁迫[24]。例如,王双耀等[5]发现由于大菱鲆在碱性环境下代谢水平比酸性环境下高,鱼体需要分解大量脂肪以维持正常代谢,因此随着水体pH的升高,大菱鲆的全鱼脂肪含量整体呈现下降趋势。然而在本实验中,3个处理组的尼罗罗非鱼全鱼水分、灰分、蛋白和脂肪含量均无差异,表明本实验中设置的水体pH还并未对尼罗罗非鱼整体营养成分造成显著影响。
已有诸多研究表明,水体pH会对鱼类血清的生化指标产生影响[25]。乳酸主要是肌肉在供氧不足的情况下通过糖酵解产生,一般认为糖酵解发生的主要目的在于迅速提供能量[26]。在低pH水体中时,为了减少内源性氨的产生和积累,石斑鱼会使用糖原作为能量来促进新陈代谢[27]。而且有研究[28]发现,酸性或碱性的水体环境会通过厌氧途径诱导银鲶(Rhamdia quelen)使用乳酸作为糖异生的底物,造成肝脏和肌肉中乳酸显著增加。在本实验中,低pH和高pH组尼罗罗非鱼肌肉和血清中的乳酸含量均出现了上升,并且高pH组呈显著性上升,而各组的全鱼蛋白和脂肪含量并无显著差异。以上结果表明在高低pH胁迫下,尼罗罗非鱼主要利用糖供能,却很难动用脂肪和蛋白质,而且在高pH的胁迫下,尼罗罗非鱼需要消耗更多的能量以维持生长而产生大量乳酸或者是通过乳酸累积维持酸碱平衡。Bolner等[28]指出高低pH条件都会导致银鲶鱼的代谢紊乱,导致其肝糖原很难被利用,而转用肌糖原来迅速分解能量。在本实验中,低pH和高pH组尼罗罗非鱼血清和肌肉的糖原含量出现了下降,但是肝脏糖原出现了显著上升,表明尼罗罗非鱼在面对水体pH变化的胁迫时可能并非首先动用肝糖原作为供能物质,而是首先利用肌肉糖原供能,这与Bolner等[28]的研究结果较为一致。
谷草转氨酶和谷丙转氨酶主要分布在肝细胞中,只有肝细胞受损时才会被释放到血清中,研究表明两种酶在血清中活性升高程度与肝细胞受损程度一致[29]。例如,当水体pH上升至9.0或下降至5.0时,会导致日本沼虾(Macrobrachium nipponense)出现病变,其体内谷草转氨酶和谷丙转氨酶活性显著增高,并通过阻碍蛋白质代谢影响肝的正常功能[30]。在本研究中,相比于对照组,高低pH组尼罗罗非鱼血清谷草转氨酶和谷丙转氨酶活性均显著升高,表明高低pH的水环境均会对尼罗罗非鱼肝脏造成损伤。
3.3 水体pH对尼罗罗非鱼肌肉品质的影响
与陆生动物相比,鱼肉因富含优质蛋白质和多不饱和脂肪酸而被认为对人体健康十分有益[31]。已有诸多研究表明,水体环境如盐度、水温和溶氧等对于鱼类肌肉营养成分和脂肪酸成分具有重要影响[32]。例如,提高水体的盐度会降低吉富罗非鱼(GIFTOreochromis niloticus)肌肉的水分含量,并增加脂肪、蛋白质及氨基酸的含量,在一定程度上提升罗非鱼肌肉的营养价值[32]。随着水体温度越高,鲫的新陈代谢越强,而作为能源物质的脂肪被消耗的越多,造成肌肉中脂肪含量降低[12]。而在本实验中,高低pH的水体环境并未改变尼罗罗非鱼肌肉的脂肪含量和蛋白含量。这说明,高低pH水体环境尚未对尼罗罗非鱼肌肉的主要营养成分产生影响。
肌肉组织中脂肪酸组成决定了肌肉的氧化稳定性,进而影响肌肉的风味和色泽,尤其是n-3 PUFAs被认为与人的健康密切相关[33]。然而,环境因素如温度和盐度会影响脂肪酸在鱼类体内的合成[34]。Tidwell等[35]指出在32℃水温下培养的鲈(Micropterus salmoides)肌肉中的饱和脂肪酸含量显著高于20℃或26℃水温下的鲈。除此之外,水体盐度会显著影响鱼类细胞内外的离子浓度,为了维持体内正常的渗透压,鱼类可以通过调控脂肪酸去饱和酶及延长酶基因的表达来改变细胞膜中脂肪酸的种类及含量,以调整膜的通透性[36]。在本研究中,相较于对照组,高pH的水环境提高了罗非鱼肌肉PUFA的相对含量,尤其是n-3 PUFAs,这表明高pH的水体环境可能干扰了鱼体的正常代谢,但同时提高了罗非鱼肌肉的脂肪酸营养价值。由于PUFA在鱼体内具有抗逆和抗应激方面的作用[37],因此,推测罗非鱼在面对高pH水体环境胁迫时体内会合成大量的PUFA,或者大量消耗其他种类的脂肪酸而使得PUFA相对含量上升,以对抗高pH水体环境造成的应激,这一观点还有需要今后的研究以进一步证实。
系水力是衡量肉品质的最重要指标,低系水力往往意味着肌肉色泽差以及可溶性蛋白质和风味物质的流失,高系水力不仅能降低肌肉蛋白降解速度,而且能够延长贮存期,实验中通常通过离心损失和蒸煮损失等指标表示肌肉系水力的强弱[38]。水体环境的变化是影响鱼类肌肉系水力的重要因素,吕宏波等[8]指出中脂饲料投喂下,尼罗罗非鱼的离心失水率随着水体的盐度上升而降低,说明适宜的盐度可以增加系水力。在本研究中,相比于对照组,高pH组尼罗罗非鱼肌肉的蒸煮损失显著上升,说明其肌肉的系水力下降。而肌肉的系水力与肌肉的内在结构及化学性质紧密相关,细胞膜中的磷脂是维持细胞稳定的重要成分,然而磷脂中的PUFA易氧化分解,造成正常的细胞膜结构被破坏,细胞内容物渗出,导致系水力下降[39]。另外,肌肉系水力也与肌肉pH有关,pH下降会导致肌肉蛋白电荷失衡,进而造成肌肉系水力的下降,而肌肉pH的下降主要由肌糖原无氧酵解产生乳酸引起[40]。在本实验中,高pH组尼罗罗非鱼肌肉中PUFA含量和乳酸含量均显著上升,这表明在高pH的水体环境下,尼罗罗非鱼很有可能由于肌肉PUFA以及乳酸含量的增加进而影响肌肉系水力,造成肌肉品质下降。
水体环境也会对水生动物肌肉的质构特性造成影响,例如提升水体盐度可以明显提高吉富罗非鱼肌肉的咀嚼度、弹性、硬度和黏聚性[32]。除此之外,鱼类肌肉的质构特性还与其营养成分、肌纤维、蛋白质结构等密切相关[41]。有研究[42]表明高脂肪含量会导致肌肉机械强度降低,造成肌肉硬度降低。而吕帆等[43]在对鲤、草鱼等几种鱼类的研究中发现肌肉黏性等与粗脂肪含量成正相关,与粗蛋白含量呈负相关。在本实验中,低pH组的尼罗罗非鱼肌肉的弹性相较于其余两组显著降低,而高pH组的尼罗罗非鱼肌肉的黏性相较于其余两组显著降低,但是三组的水分、粗脂肪和粗蛋白含量都并无差异,这表明肌肉黏性和弹性可能受到除水分、脂肪和蛋白等营养成分外的其他多重因素影响。另外,还有研究指出肌肉黏性和弹性的变化可能受到渗透调节功能的影响[44],这有待进一步的研究。以上结果表明,高低水体pH对于尼罗罗非鱼物理特性具有不同的影响,高pH会显著提高肌肉的蒸煮损失、降低肌肉黏性,而低pH则会降低肌肉的弹性。
另外,由于本实验采用静水养殖,水体不可避免地较为浑浊,因此罗非鱼生长较慢,造成10周末体重不足20 g。尽管在大多数情况下,市场上销售的是体重大于200 g的罗非鱼成鱼。但是,目前在大量的学校食堂和快餐盒饭消费中,20—50 g左右的罗非鱼按条出售和消费也日益增多。并且,在实际养殖环境中,鱼类从幼鱼阶段就有可能受到水体pH的影响,本研究结果即证明了pH对于鱼肉品质的影响在幼鱼阶段就会出现。因此,从消费者和理论研究的角度来看,对于体重不足20 g罗非鱼的肌肉品质特征研究也具有一定的现实意义。
4 结论
本研究探讨了水体pH对尼罗罗非鱼生长、营养组成和肉质的影响。结果表明,高pH和低pH水环境均会抑制尼罗罗非鱼的生长,引发肝糖原累积,并造成肝脏损伤。另外,高pH水环境会显著降低脏体比、肌肉系水力和肌肉黏性,并引发血清和肌肉中乳酸的累积,显著提高肌肉中PUFA,特别是n-3 PUFA的相对含量,提升肌肉脂肪酸营养价值。而低pH水环境则会提高脏体比和饲料系数,降低产肉率以及肌肉弹性。因此,尽管高pH水环境会使罗非鱼肌肉中n-3 PUFA含量有所提高,但是整体来看,高或低pH水环境均不利于尼罗罗非鱼的健康生长和代谢,并对肌肉的营养品质和质构特性造成影响。因此,养殖尼罗罗非鱼仍应尽量保持水体稳定在适宜的pH范围内。
