褐菖鲉养殖密度与其eDNA的相关关系探讨
2022-08-04高天翔陈治王晓艳张浩博史会来
高天翔 陈治 王晓艳 张浩博 史会来
(1.浙江海洋大学水产学院,舟山 316022;2.海南热带海洋学院水产与生命学院,三亚 572022;3.浙江海洋大学国家海洋设施养殖工程技术研究中心,舟山 316022;4.浙江省海洋水产研究所,浙江省海水增养殖重点实验室,舟山 316021)
褐菖鲉(Sebastiscus marmoratus)属鲉形目(Scorpaeniformes)、平鲉科(Sebastiae)、菖鲉属(Sebastiscus)。褐菖鲉作为暖水性底层鱼类,生活在近海底层岩礁地带,广泛分布于我国南北沿海近海岩礁海域,是典型的岛礁定居性鱼类[1]。春夏季分散在岩礁岸边和岛屿四周觅食,冬季游向较深海区越冬。褐菖鲉是舟山岛礁水域的优势鱼种,同时也是主要的海洋捕捞及海钓对象[2,3],具有较高的经济价值。
环境DNA(Environmental DNA,eDNA)是生物体释放于冰芯、土壤、空气、水体、底泥等环境中的DNA总称。eDNA分析是一种从环境样品中提取所有的DNA片段,然后通过相应的DNA检测技术进行目标生物的定性和定量分析的新工具[4—10]。该方法最早出现于20世纪80年代[11],主要被应用于微生物生态学研究[12—14]。近十年来,随着样品采集、DNA提取和DNA测序分析等关键技术的突破,环境DNA分析技术日渐成熟。其应用从微生物分析扩展到高等水生或半水生物种鉴定乃至生物群落的多样性分析,目前已在生物入侵防治、濒危物种保护、生物多样性评价及重要资源监测评估等方面发挥重要作用[15—17]。
褐菖鲉的研究主要集中在早期发育、苗种生产及生物学特征、生理生化及遗传学方面[18—24]。国内外尚未见褐菖鲉eDNA方面的研究报道。本文通过设计褐菖鲉特异性引物及Tanqman探针,进而建立褐菖鲉养殖密度与其eDNA浓度之间的相关关系,为基于eDNA技术的褐菖鲉生物量评估奠定基础。
1 材料与方法
1.1 褐菖鲉选取
实验时间为2020年6月8日至2020年6月25日,在浙江省舟山市西轩岛(29°53′41.45″ N,122°18′40.12″ E)养殖场开展研究。由于褐菖鲉个体暴露在空气中挣扎强烈,影响体长、体重等生物学测定,因此先目测挑选个体基本一致的褐菖鲉个体,用直径20 cm、孔径0.2 cm、柄长1 m的鱼捞将褐菖鲉捞入直径1 m、水深10 cm的圆形水槽中。随后用直径10 cm、孔径0.2 cm、把柄长28 cm的小型鱼捞移入圆形水槽中,对个体略大和略小的个体进行再次筛选,以保证圆形水槽中剩余的褐菖鲉个体大小相近。随机采集褐菖鲉个体,放入20 cm×20 cm×10 cm的塑料泡沫箱中(塑料泡沫箱中事先加入一定体积的水,防止褐菖鲉在泡沫箱中跳动,影响测重的准确性)。用量程为5 kg的天平秤量褐菖鲉的总重,取均值作为每尾实验鱼的重量。
1.2 室内养殖实验
取5个容积为1 m3、具有完备和相同换水装置的圆形水桶,用10%次氯酸钠充分消毒后,在水桶中加入0.5 m3海水(海水已进行多级沉淀、过滤和消毒)。每个水桶内的水体更新速度恒定保持为3 L/min,多余水体从溢流管流出,使体积保持不变,直到实验结束。分别在这5个水桶中加入2、4、8、16和32尾均重为12.46 g的褐菖鲉,在充分供氧条件下,统一喂食一定数量的虾。在加入褐菖鲉0、8h、16h、1d、1.5d、2d、3d、4d、5d、6d、7d、8d及10d后,对每个水桶采集250 mL水样,共取平行样3组,同时取250 mL纯净水作为空白对照组。采样前用浓度为0.1%的次氯酸钠溶液对采样的玻璃瓶进行消毒处理。室内温度稳定保持在(26±2)℃,保证养殖环境的稳定适宜。
1.3 室外养殖试验
对3个室外养殖池[水体体积约为:40 m(长)×15 m(宽)×0.3 m(高)=180 m³]进行充分消毒,分别在3个养殖池内投放20、40和80尾褐菖鲉。分别抽取放入褐菖鲉0、8h、16h、1d、1.5d、2d、3d、4d、5d、6d、7d、8d及10d后的养殖池水样2L,共取3组平行样,空白对照及消毒方式与室内养殖实验相同。
1.4 DNA 提取及 PCR扩增验证
采用苯酚-氯仿方法从褐菖鲉肌肉中提取DNA[25]。使用硬骨鱼类COI通用引物F1(5′-TCAACCAACCACAAAGACATTGGCAC-3′)、R1(5′-TAGACTTCTGGGTGGCCAAAGAATCA-3′)[26]进行PCR扩增,反应体系为:DNTPs 2 μL(2.5 μmol/L),10×buffer(含Mg2+)2.5 μL,rTaq0.15 μL(5 U/μL),上下游引物各1 μL(10 μmol/L),DNA模板1 μL(50 ng),无菌水补齐总体积至25 μL。反应程序:95℃ 预变性5min;40次循环过程为:95℃变性30s,58℃退火30s,72℃延伸30s,最终在72℃延伸10min后于4℃保存。PCR产物质量采用1%琼脂糖凝胶电泳法来检测,使用DL DNA Marker (TaKaRa),挑选电泳条带单一且最为明亮的PCR产物送至生工生物工程(上海)有限公司进行双向测序。测得的序列使用SeqMan软件进行拼接、比对及人工手动校对,得到褐菖鲉的标准COⅠ片段。
1.5 褐菖鲉特异性引物和Taqman探针设计
用Clustal(version 2.0.11)、DNAMAN、Primer-Express 3.0.1及NCBI在线引物设计工具(https://www.ncbi.nlm.nih.gov/tools/primer-blast/),通过对比褐菖鲉与其他5种舟山海域出现的近缘鱼种:许氏平鲉(Sebastes schlegelii)、三色菖鲉(Sebastiscus tertius)、裸胸鲉(Scorpaena izensis)、单指虎鲉(Minous monodactylus)和日本鬼鲉(Inimicus japonicus)的COⅠ基因片段序列,设计褐菖鲉特异性引物和TaqMan探针。基于设计好的引物与探针使用K2P模型构建NJ树计算褐菖鲉与其他5种近缘鱼种的种间遗传距离。各鱼种信息见表 1。

表1 褐菖鲉及其近缘种样品信息Tab.1 Sampling information of S.marmoratus and its relative species
1.6 特异性引物和TaqMan探针的验证
使用普通P C R 验证引物的可行性,并用7300Plus Real-Time PCR仪检测引物和探针的特异性。荧光定量PCR扩增体系为:TaqMan™ Fast qPCR Master Mix(Applied Biosystems™) 10 μL、正反向引物各0.4 μL (10 μmol/L)、DNA模板2 μL (50 ng)、探针0.4 μL (10 μmol/L)、无菌水补齐至20 μL。热循环条件:50℃孵育2 min进行UNG酶激活,95℃预变性2min,45次循环过程为95℃变性30s,60℃退火/延伸30s。验证用到的鱼种见表 1。
1.7 褐菖鲉eDNA 提取及数字定量PCR扩增
对1.2和1.3采集的250 mL和2 L水用直径47 mm,孔径0.45 μm的醋酸纤维素滤膜(上海兴亚)抽滤,分别抽滤等体积的纯净水作为阴性对照。用DNeasy Blood and Tissue Kit试剂盒进行eDNA提取,使用QuantStudio 3D数字PCR(Digital PCR,dPCR)进行褐菖鲉eDNA浓度的测定。
1.8 eDNA 浓度计算
使用R软件(version 4.0.3)“basicTrendline”包对不同分组间进行散点图拟合,计算线性回归方程、方差和相关系数,同时进行显著性t检验。使用Excel 2019绘制褐菖鲉eDNA浓度变化趋势图及生物量加倍时eDNA浓度的增长倍数雷达图。
2 结果
2.1 褐菖鲉特异性引物和探针
通过比对褐菖鲉与其他5种近缘鱼种COⅠ基因片段序列,设计的褐菖鲉特异性引物和探针位于褐菖鲉线粒体基因组6503—6575 bp,其中引物为:HF-6503:5′-ATTACCGCTGTCCTTCTCCTT-3′、HR-6575:5′-ACAATGCTTCTAACAGACCGGAA-3′,探针为:HPro-6524:FAM-TCTCCCTACCAG TTCTTGCTGCTGGCAT-TAMRA。褐菖鲉的引物、探针序列及与近缘鱼种的碱基差异情况如图 1所示,种间遗传距离见表 2。
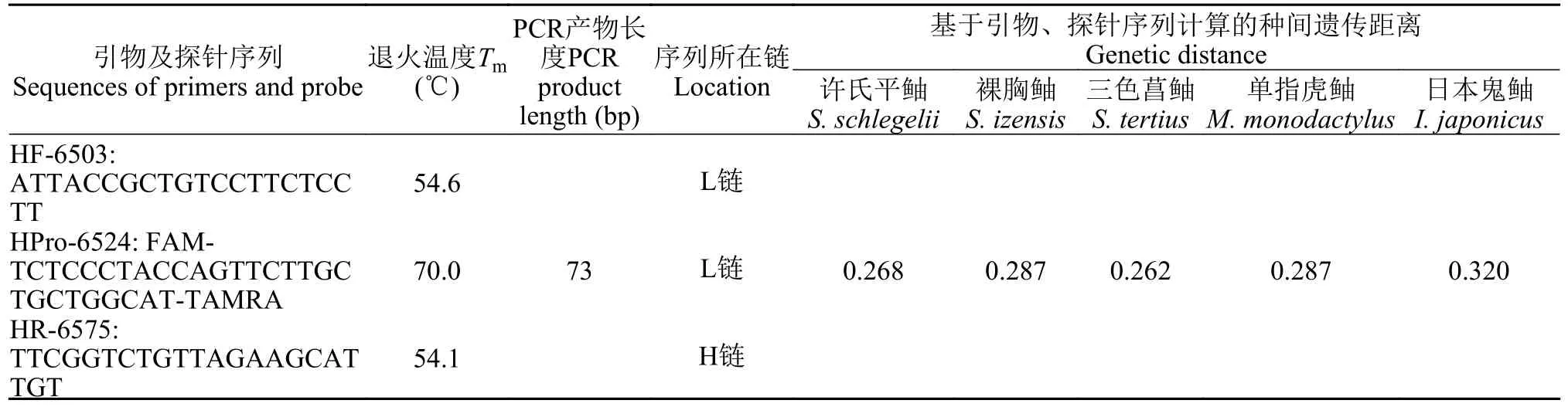
表2 褐菖鲉特异性引物、探针信息Tab.2 Information of specific primers and probe of S.marmoratus

图1 褐菖鲉引物、探针序列与其近缘种碱基差异情况Fig.1 Nucleotide variation of primers and probe between S.marmoratus and its relative species
2.2 荧光定量PCR结果
以6种鱼类的组织DNA为模板,进行引物探针的特异性验证,结果显示褐菖鲉的Ct值为20左右,其他5个近缘鱼种均未检出。由此证明设计的褐菖鲉引物和探针具有特异性。各物种qPCR所得的Ct值见表 3。

表3 基于荧光定量PCR的目标生物引物、探针特异性验证结果Tab.3 The specificity of primers and probe of target species by qPCR
2.3 室内养殖条件下褐菖鲉eDNA浓度变化情况
室内养殖条件下褐菖鲉eDNA浓度具体变化趋势见图 2。褐菖鲉eDNA浓度前后变化明显,48h后达到峰值,3d后较为稳定,且与各自群体密度相对应。

图2 室内水体褐菖鲉eDNA浓度变化情况Fig.2 Variation trend of eDNA concentration of S.marmoratus in indoor tanks
2.4 室外养殖条件下褐菖鲉eDNA浓度变化情况
室内养殖条件下eDNA浓度具体变化趋势见图 3。eDNA浓度先减少,存在8h的检测盲点,之后再次增加,72h后达到峰值。
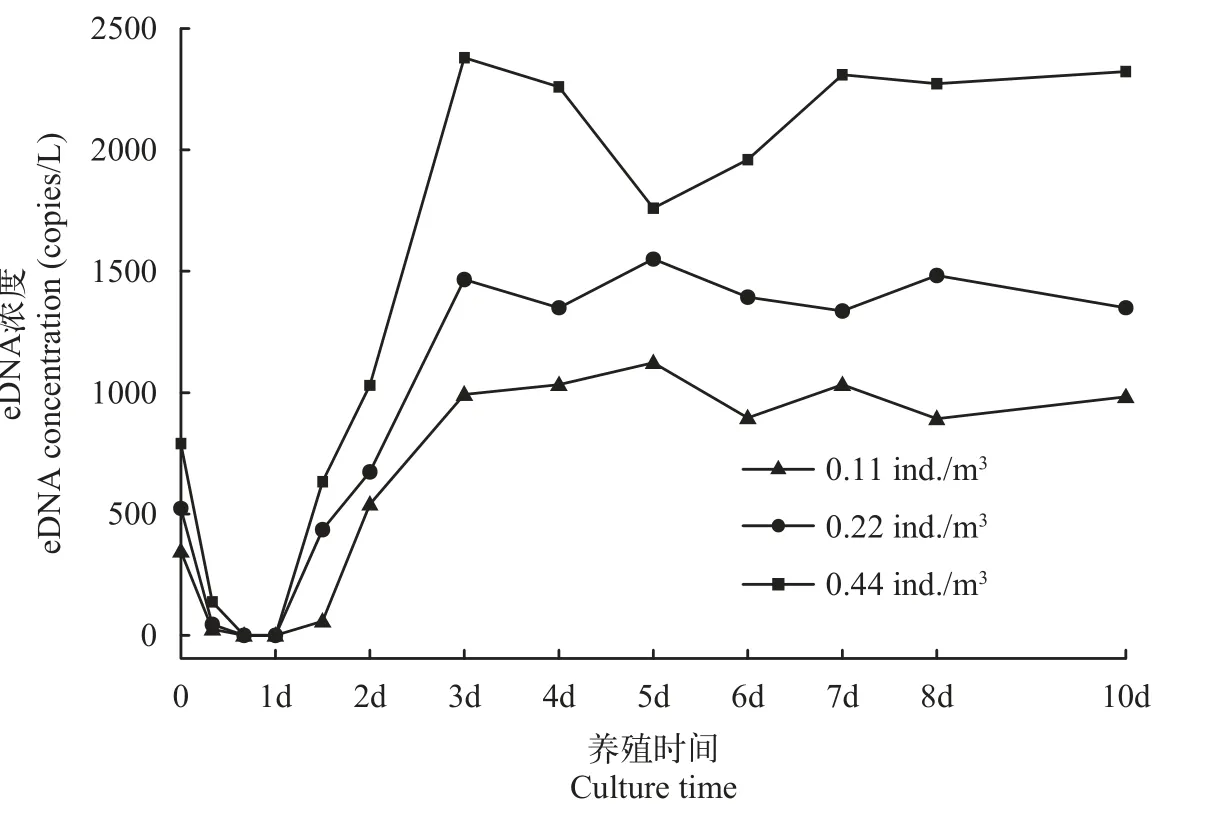
图3 室内水体褐菖鲉eDNA浓度变化情况Fig.3 Variation trend of eDNA concentrations of S.marmoratus in outdoor ponds
2.5 室内养殖条件下褐菖鲉eDNA浓度与其养殖密度之间的相关关系
将同一养殖密度下不同时间的数据进行整合,评估养殖密度与eDNA浓度之间的整体相关性(图4a),拟合效果较差,相关性不高(R²=0.70)。因此将时间组分为释放早期:0—4d(含前者不含后者)和稳定期:4—10d(含这两个点)两个时间段,取两个时间段内的分子拷贝数分别进行相关性分析。结果显示稳定期的拟合效果更佳(图4b),在该时间段内,室内养殖条件下eDNA浓度与褐菖鲉养殖密度之间呈显著的线性相关,关系式为:Density (ind./m3)=6.094×10-5×eDNA concentrations (copies/L)-1.033,R2=0.96。
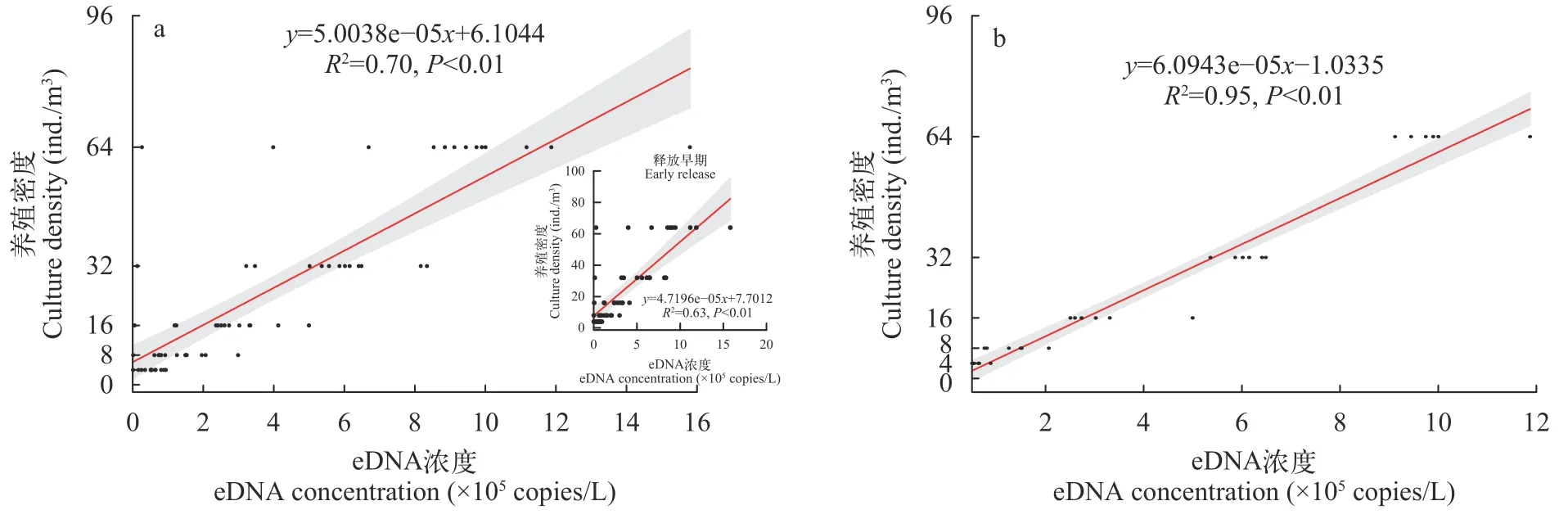
图4 室内养殖条件下褐菖鲉eDNA与其养殖密度之间相关关系Fig.4 Correlation between eDNA of S.marmoratus and its culture density in indoor culture
2.6 室外养殖条件下褐菖鲉eDNA浓度与其养殖密度之间的相关关系
室外数据整合与室内数据方法一致,对养殖密度与eDNA浓度之间的整体相关性进行评估,结果显示整体拟合效果较差(图5a),相关性较低(R2=0.17)。同样将时间组分为释放早期:0—7d(含前者不含后者)和稳定期:7—10d(含这两个点)两个时间段,取两个时间段内的分子拷贝数分别进行相关性分析。结果显示稳定期的拟合效果更佳(图5b),在该时间段内,室外养殖条件下eDNA浓度与褐菖鲉养殖密度之间呈显著的线性相关,关系式为:关系式为:Density (ind./m3)=2.445×10-4× eDNA concentrations (copies/L)-0.123,R2=0.99。
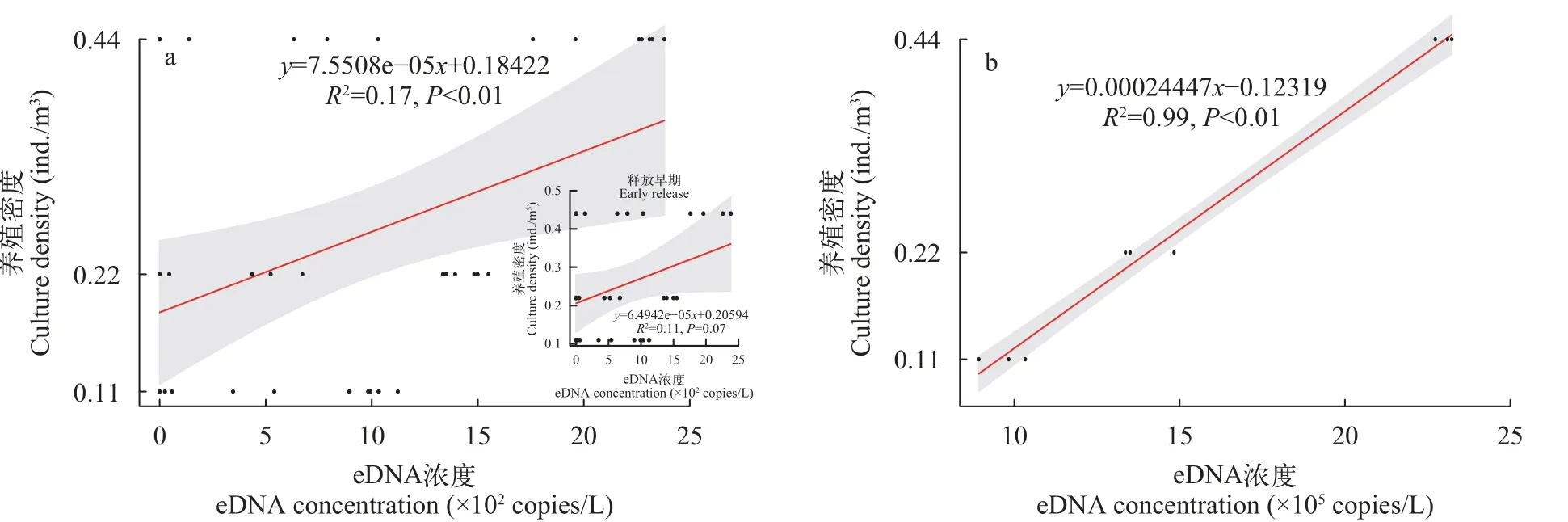
图5 室外养殖条件下褐菖鲉eDNA浓度与其养殖密度之间相关关系Fig.5 Correlation between eDNA of S.marmoratus and its culture density in outdoor culture
2.7 室内、室外养殖条件下,eDNA浓度与褐菖鲉养殖密度之间关系的联合分析
将室内水桶和室外养殖池实验结果联合,进行eDNA浓度与褐菖鲉养殖密度相关关系分析。结果表明整体与释放早期拟合效果差、相关性低(图6a),室内室外在稳定期的数据表明eDNA浓度与褐菖鲉养殖密度之间呈线性相关关系(图6b),关系式为:Density (ind./m³)=6.017×10-5× eDNA concentrations (copies/L) -0.485,R²=0.96。
2.8 褐菖鲉生物量加倍时 eDNA浓度的增长倍数
选取室内组、室外组稳定期数据探究褐菖鲉养殖密度加倍时eDNA浓度增长倍数(表4和表 5)。室内组在养殖密度由8 ind./m³增加到16 ind./m³时,eDNA浓度增长倍数较高,室外组养殖密度由0.22 ind./m³增加到0.44 ind./m³时,eDNA浓度增长倍数高。整体来看,室内各小组eDNA浓度增长倍数(图7)均高于室外小组(图8),室内组和室外组中eDNA浓度随着褐菖鲉养殖密度增加而增加,但室内组随着养殖密度不断增加eDNA浓度增加倍数趋于平缓。
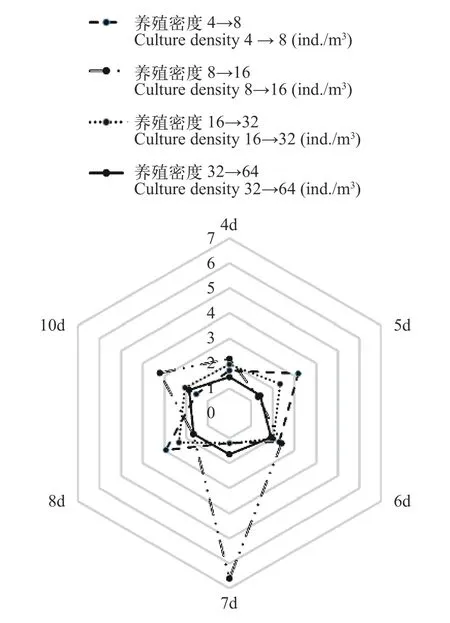
图7 室内褐菖鲉养殖密度加倍时eDNA浓度增长倍数Fig.7 Ratio of indoor eDNA growth of S.marmoratus resulted from its culture density doubling

图8 室外水体褐菖鲉养殖密度加倍时eDNA浓度增长倍数Fig.8 Ratio of outdoor eDNA growth of S.marmoratus resulted from its culture density doubling
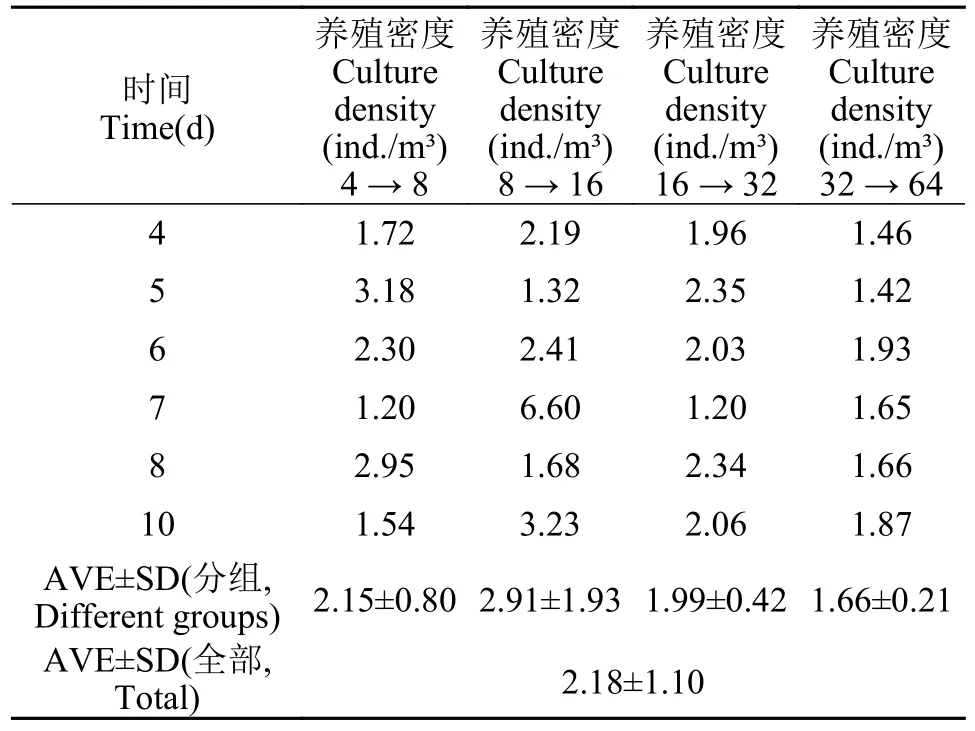
表4 室内褐菖鲉养殖密度加倍时eDNA浓度增长倍数Tab.4 Ratio of indoor eDNA growth of S.marmoratus resulted from its culture density doubling
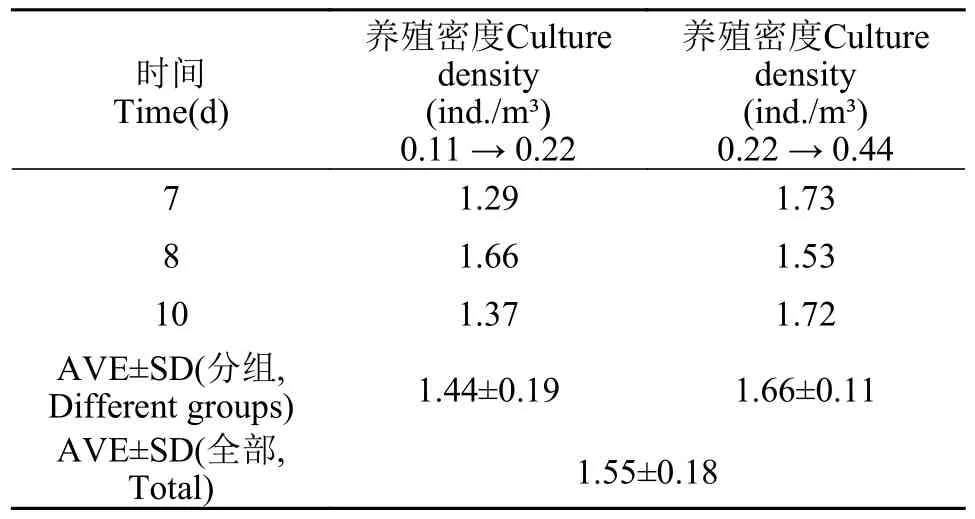
表5 室外水体褐菖鲉养殖密度加倍时其eDNA浓度增长倍数Tab.5 Ratio of outdoor eDNA growth of S.marmoratus resulted from its culture density doubling

a.整体与释放早期;b.稳定期a.whole and early stage of release;b.stable stage
3 讨论
3.1 特异性引物和探针设计
TaqMan探针法能够保证在扩增过程中只对目标种进行特异性检测[27,28]。本实验通过对褐菖鲉及其近缘鱼种进行同源序列比对,在序列变异较大的位置进行特异性引物探针设计,所得的引物、探针与近缘鱼种序列皆存在一定数量的碱基差异。在引物探针的特异性验证过程中,仅以褐菖鲉组织DNA为模板的样品被检测出,而以其他5种近缘鱼种组织DNA为模板的样品均未检出,因此本研究设计的褐菖鲉特异性引物和TaqMan探针能保证扩增结果的特异性。
3.2 褐菖鲉eDNA定量检测技术的高灵敏性
室内条件下,不同养殖密度检测到的eDNA在0—2d时间段内呈上升趋势,在2—3d内褐菖鲉eDNA浓度回落,3d后趋于稳定状态。在室外条件下,0—1d、1d—3d和3d—10d这3个时间段内,褐菖鲉eDNA浓度分别呈下降,上升和稳定趋势。室内水桶及室外养殖池在“0”组的eDNA浓度极低,但并不为0。这与水母(Chrysaora pacifica)、鲤(Hypophthalmichthys molitrix)等物种定量检测研究结果相一致[15,29]。塑料鱼笼放入水桶的瞬间可能引起了水流波动,导致褐菖鲉eDNA能够扩散到临近水体中,致使dPCR结果为阳性。本实验选用的褐菖鲉全部为幼鱼,个体都比较小(12.46 g/尾);室外养殖池的水体体积也较大,最低密度组(0.11 ind./m³)中的褐菖鲉eDNA在释放早期仍可被dPCR检出。在不同时间段室内组和室外组检测的褐菖鲉eDNA浓度均有所不同,且差异较大,由此可以看出褐菖鲉eDNA定量检测技术具有较高的灵敏性。
3.3 褐菖鲉eDNA浓度变化及“空白的8h”
无论是室内水桶组还是室外养殖池组,褐菖鲉eDNA浓度的波动范围都比较大。稳定时期的褐菖鲉eDNA浓度大约比初始时期高1—2个数量级。对特定物种进行定量检测时,应在预实验中设置不同的采样时间点,预先研究水体中eDNA浓度的稳定情况。室内和室外在实验前期阶段(eDNA释放早期)的生物量评估结果较差,因此用于拟合分析的数据应选自eDNA稳定释放的时期,而结果也表明稳定期的线性拟合效果好。在室外养殖组,褐菖鲉初始组(0)的eDNA浓度较高,这可能是因为室内、室外水温不一致,褐菖鲉由室内转移室外时会产生应激反应,皮肤黏液脱落等原因造成。但在0—1d组,水样中的褐菖鲉eDNA浓度迅速降低;尤其是16h—1d时间段出现了eDNA浓度的“空白的8h”,dPCR也无法检测到水体中的褐菖鲉eDNA。室外养殖池水质较为清澈,褐菖鲉初始阶段为躲避外界刺激可能游向水较深、离岸较远的水池中央。褐菖鲉具有明显的恋礁性[18,30],静止在养殖池中部的褐菖鲉可能不再发生游动。取样处的褐菖鲉eDNA扩散或者降解后不再有新的褐菖鲉eDNA补充。反映在dPCR结果上,则是16h—1d阶段内褐菖鲉eDNA检测为阴性。而1d后,水池中央的褐菖鲉eDNA开始扩散到养殖池外缘的水样采集处。褐菖鲉eDNA才得以开始累积,直到最后稳定下来。由此来看,恋礁行为可能会影响褐菖鲉eDNA扩散,“远礁点”处存在eDNA检测盲点。
此外,采样点的设置对eDNA检出和浓度估计是一个重要的因素。受室外条件限制,室外条件下的养殖池仅设置了一个采样位点,这可能会导致检出的eDNA浓度与实际有所偏差。水体eDNA的数量、质量和稳定性在很大程度上受到其在水中扩散的影响[31—33],室内养殖水桶体积小,因此采样位点对eDNA检测影响较小。室外养殖池范围较大,由于褐菖鲉的恋礁性会导致养殖池内的eDNA分布不均匀,单一采样位点难以保证采集到池内均匀的eDNA,无法准确评估实际的eDNA浓度[36]。在自然环境中,水流、温度、降水和紫外线等因素都会影响影响eDNA的降解[34—36],从而影响eDNA检出与浓度估计。室外的环境因素往往无法控制,因此在难以保证养殖条件稳定的情况下设置多个采样位点对于eDNA的检出和浓度的评估是非常有必要的。
3.4 在室内和室外条件下,褐菖鲉eDNA与其密度相关关系
由于eDNA技术是基于生物体持续释放到周围环境的代谢物来分析和研究的[37,38]。在本研究中,随着养殖密度增加,褐菖鲉eDNA浓度也呈增加趋势,可见养殖条件下的水体eDNA能够体现褐菖鲉密度,其相关关系为近海野外褐菖鲉资源定量监测评估奠定了基础。实际的野外采样要选择天气情况良好且温度适宜的时间段,以便采集到褐菖鲉eDNA释放稳定期的水样,最能反映实际环境的褐菖鲉资源密度和数量。同时要尽可能增加采样位点和重复采样,避免产生检测盲点导致假阴性的结果。
