贵州省浮萍形态学鉴定与遗传多样性分析
2022-08-04冯丹谭艾娟吕世明郑萌盟杨贵利
冯丹 谭艾娟 吕世明 郑萌盟 杨贵利,
(1.贵州大学生命科学学院,山地植物资源保护与保护种质创新教育部重点实验室,山地生态与农业生物工程协同创新中心,贵阳 550025;2.贵州大学动物科学学院,贵阳 550025;3.中国科学院地球化学研究所环境地球化学国家重点实验室,贵阳 550025)
浮萍,属于被子植物门,单子叶植物纲,共有5个属,分别是绿萍属(Lemna)、紫萍属(Spirodela)、斑萍属/兰氏萍属(Landoltia)、泥萍属(Wolffiella)和无根萍属/芜萍属(Wolffia)[1]。浮萍是世界上最小的开花植物,植株较小,只有几到几十毫米。浮萍结构比较简单,仅有叶状体和根,通常漂浮于水面,通过叶状体或根从水中吸收营养物质[2];浮萍通常以无性繁殖的方式生长,从母叶状体无性生殖出子叶状体,繁殖速率近似指数增长,生长周期短至1—2d即可实现生物量翻倍。浮萍在温度较低时会产生休眠体进入休眠状态,如越冬前在其夹囊或开口内生椭圆形的冬芽,脱离母体沉入水底,第2年当温度回升时浮出水面形成新的植株重新生长,生命力极强[3,4];浮萍可以在pH 4.5—7.2,温度为2—35℃的条件下生长,具有较宽的pH和温度域,对自然环境的适应能力强,所以浮萍分布广泛,在世界各地的水田、池沼和湖泊等静水中均有分布[5]。
近年来,浮萍以其独有的优势逐渐引起关注,已被广泛应用于生物燃料、毒性测试、环境监测和污水修复等方面[6,7]。浮萍能克服藻类的缺点,利用生长抑制试验评价污染物质的毒性,可以更好、更标准地反映废水毒性的变化[8,9],同时也是地表水中污染物(有机污染物、重金属、农药、放射性废物、纳米材料和碳氢化合物)的有效生物蓄积器[10,12]。其次,浮萍作为新型生物反应器可以用于合成疫苗、抗体、药用蛋白和工业酶制剂等生物制品,在生物制药方面也表现出了巨大的应用潜力[13]。目前,利用转基因浮萍表达抗体已有研究报道[14],例如Cox等[15]在Lemna minor中成功表达了单克隆抗体(Monoclonal antibody,mAb),Khvatkov等[16]在Wolffia arrhiz中成功表达了粒细胞集落刺激因子(Gh-CSF),以上结果为开发以浮萍为生物反应器合成抗体、蛋白等生物制品提供了依据。有研究表明[17]L.minor在液体培养基中生长速度快(生物量倍增时间为36h),蛋白质含量高达其生物量干重的45%。2017年,Appenroth等[18]报道指出浮萍中的蛋白质和氨基酸含量与世界卫生组织(WHO)推荐给人类的价值几乎相同,证实浮萍也是一种潜在的蛋白质来源[19]。此外,在光照条件为110 μmol/(m2·s)时,Lemna aequinoctialis的最大淀粉产量为98.70 g/m2,说明浮萍是生产丁醇和乙醇等最有希望的替代能源之一[20—23]。所以,浮萍是一种极具应用前景的小型水生被子植物,是一种适用于基础和应用研究的新型生物材料。
随着现代生物科学技术的成熟,研究遗传多样性的方法由最初的形态学水平发展到细胞水平,再进一步发展到生物化学和分子生物学水平,利用分子生物学技术开展浮萍的研究也越来越多[24]。浮萍有5个属37个种,其遗传多样性能够影响其表型特征和其他生物性状,从而导致浮萍对不同自然环境的适应性不同[25]。遗传多样性是物种进化潜能和适应自然界生存压力的重要遗传学评价指标,对于不同地区的浮萍进行种属鉴定,分析其种质资源的分布情况,发现不同水域、温度和地形均对浮萍的多样性有影响[26]。因此,对浮萍科植物进行遗传多样性分析能对不同地区浮萍科植物的研究提供遗传性依据。2009年,Martirosian等[27]对25份浮萍科植物种质的rpS16内含子序列分析表明,基于rpS16内含子的遗传距离分析支持将Landoltia punctata从紫萍属分离出来单独设立斑萍属。随后,Wang等[28]比较了CBOL (Consortium for the Barcode of Life)提出的7个质体标记对97份浮萍科31种植物的序列识别潜力,最后发现atpF-atpH间隔序列最能表现浮萍多样性的特点,建立了基于该序列多态性的浮萍分子鉴定方法。所以,atpF-atpH间隔序列和rpS16内含子序列都可用于浮萍系统发育研究,且同时利用atpF-atpH间隔序列和rpS16内含子序列共同鉴定浮萍科植物的种属准确性更高。因此,为了更准确地区分贵州省浮萍科植物种间遗传多样性,需要同时利用atpF-atpH间隔序列和rpS16内含子对浮萍不同株系进行种属鉴定[29]。
本研究在贵州省辖9个地级行政区的多处水环境中共采集到41份浮萍种质,利用叶绿体atpF-atpH间隔序列和rpS16内含子序列进行分子生物学分析,并对浮萍遗传多样性分析进行初步性研究,讨论并比较了中国亚热带湿润季风地区浮萍种群和遗传多样性的差异。对浮萍进行形态学鉴定和遗传多样性分析无论是对浮萍多样性的保护,还是对浮萍物种的生物学理解和生物量生产应用都有重要的意义。
1 材料与方法
1.1 植物材料采集
贵州省地处中国西南内陆地区腹地,跨长江和珠江两大水系,界于北纬24°37′—29°13′,东经103°36′—109°35′;贵州境内地势西高东低,海拔在157—2841 m,属亚热带湿润季风气候,气候温和,雨量充沛,年平均日照1354h,年均温度18℃左右,夏季平均气温24℃,年均降雨量1200 mm[30]。贵州省野生植物资源丰度很高,共计43科75属126种[31]。浮萍作为一种适应能力强的植物,在贵州省也广泛分布,本研究在贵州省9个地级行政区采集到多种浮萍资源,共计41份 (图1)。
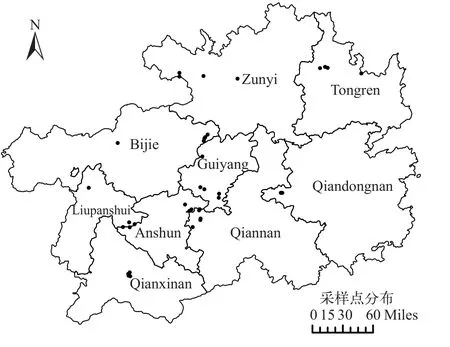
图1 贵州省浮萍种质采集地点分布Fig.1 Distribution of duckweed germplasm collection sites in Guizhou Province
1.2 仪器药品
试剂:NaClO、75%乙醇、MS培养基(Hopebio;青岛)、头孢霉素(Ameresco;USA)、Hoagland培养液、巯基乙醇(Aladdin;上海)、CTAB、核酸提取液(Acmec;上海)、异丙醇(Aladdin;上海)、Taq酶(TransTaqDNA Polymerase High Fidelity;北京)、琼脂糖(Sigma-Aldrich;USA)。
仪器:体视显微镜(SMZ-171;Motic;厦门)、人工气候培养箱(GXZ-80;Thermo;美国)、超净台(SW-CJ-1D;孚夏;浙江)、灭菌锅(DR60DA;ZEALWAY;USA)、pH仪(pHS-3C;雷磁;上海)、通风橱、离心机(TG-16S;蜀科;四川)、T100 Thermal Cycler PCR仪(T100;Thermo;USA)、水平电泳仪(JY1600C;JUNYI;北京)、凝胶电泳成像仪 (biorad ChemiDoc MP;Bio-Rad;USA) 。
1.3 无菌株系的制备
将野外采集的浮萍材料编号,纯水中漂洗两遍,采用5%的次氯酸钠和75%的乙醇进行外植体消毒处理并接种于添加50 mg/L头孢霉素的MS固体培养基中进行保存,继代周期为1个月,为后续实验提供种质资源材料。DNA提取前,从保存的培养皿上接种10—20片浮萍植株转接至pH调至5.0—5.5,添加1.5%蔗糖后灭菌处理的Hoagland营养培养液中进行扩大培养[32],培养条件为光照强度5000 lx,温度25℃,光照周期16h/8h(L/D),湿度75%,培养时间2周左右。
1.4 形态学鉴定
用体视显微镜对无菌培养的浮萍进行形态学鉴定,通过根的数量、叶片的大小、颜色等形态,粗略鉴定浮萍样品的属分类。在浮萍5属中,泥萍属(Wolffiella)未在国内发现,无根萍属/芜萍属(Wolffia)体积较小,无根,呈微小颗粒状,易与其他属区分开,绿萍属(Lemna)、紫萍属(Spirodela)和斑萍属/兰氏萍属(Landoltia)都有叶状体和根,很少开花,常在叶状体边缘的侧囊中形成子代叶状体,子代叶状体逐渐长大从侧囊中浮出。根据叶片和根的形态观察判断标准如下:正面背面均为绿色,叶片小,长倒卵形或椭圆形,表面积约1—25 mm2,表面中脉稍隆起,腹面扁平,由1—4片单一的叶状体组成,每个叶状体有1根细长的根,根鞘短,植物体开花时,着生花器的2—3个叶状体脱离母体浮出水面,属于绿萍属(Lemna);叶片表面积与绿萍属相似,呈倒卵形,正面中央为绿色,叶脉5条以下,边缘一圈紫色,背面为紫色,根较少的浮萍属于斑萍属/兰氏萍属(Landoltia);叶片较大,圆形或倒卵形,不对称,叶状体腹面凸起,表面积约1 cm2,叶脉5条以上,正面呈绿色,背面为紫色,根非常茂密且长,15—35 mm,根冠明显,属于紫萍属(Spirodela)[33—35]。
1.5 DNA提取、PCR扩增及测序
使用CTAB法提取浮萍DNA,取0.1—0.5 g新鲜浮萍叶片与于1.5 mL离心管中,加入1 mL含有2 μL的2×CTAB,65℃水浴30min,期间不断摇动,使之混匀;水浴后冷却到室温,加入等体积的核酸提取液,混匀,12000 r/min离心10min;取上清液重复上述动作一次;取上清液于新的1.5 mL离心管,加入0.6倍体积冰浴的异丙醇,在-20 ℃冰箱放置30min后,12000 r/min,4 ℃离心10min;取上清液,在沉淀中加入1 mL 75%的乙醇,12000 r/min,4℃离心5min,吸去乙醇;在超净台吹干沉淀,加入30—50 μL ddH2O,溶解DNA,置于-20℃保存。
PCR扩增浮萍的叶绿体atpF-atpH间隔序列和rpS16内含子序列(引物见表 1)。反应体系25 μL:2 μL的DNA 模板,0.25 μL 5 U/μL HiFi酶,2.5 μL 10×Trans TaqHiFi buffer,2 μL 2.5 mmol/L的dNTP,1 μL引物,17.25 μL的ddH2O。PCR扩增反应程序:95℃预热变性5min,94℃变性30s,50℃降温30s,72℃延伸45s,30个循环,72℃延伸2min。将扩增产物进行琼脂糖凝胶电泳检测,产物由擎科公司测序。
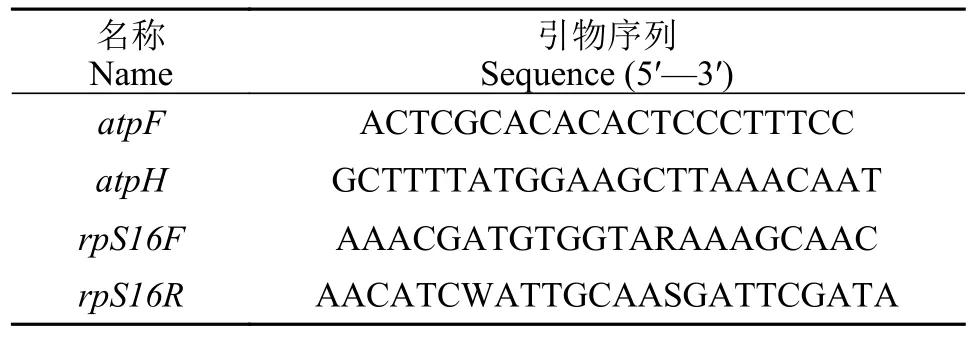
表1 atpF-atpH和rpS16序列扩增引物Tab.1 Primers for the amplification of atpF-atpH and rpS16
1.6 分子系统学及遗传多样性分析
在NCBI(National Center for Biotechnology Information)数据库中下载已知的37种浮萍物种的代表性序列,先用BioDeit软件进行序列比对和剪切,再分别采用atpF-atpH间隔序列与rpS16内含子序列在Mega6.0软件中构建NJ(Neighbor-joining Tree)型系统发育树,确定浮萍样品的种属分类,再将浮萍所有样品序列比对结果输入DNA SP6软件,分析贵州省不同地区浮萍种质资源的遗传多样性,包括单倍型数(H)、单倍型多态性指数(Hd)、核苷酸多态性指数(Pi)、群体突变率(θw)和平均每kb核苷酸差异数[36]。
2 结果与讨论
2.1 形态学鉴定
通过肉眼及显微镜对浮萍叶状体和根进行观察,鉴定贵州省采集的41份种质中只有绿萍属(Lemna)、紫萍属(Spirodela)和斑萍属/兰氏萍属(Landoltia)。其中绿萍属居多,共33个;其余有6个紫萍属,2个斑萍属(表2和图 2)。贵阳市位于贵州省中部,水资源丰富,主要采集的浮萍为绿萍属和斑萍属,只有1株紫萍属;安顺市位于贵州中部偏西,只采到绿萍属,没有采到紫萍属和斑萍属;黔东南和黔北地区的遵义和铜仁市多有绿萍属和紫萍属,约70%为绿萍属,黔西地区包括六盘水和毕节等市,主要采集到的是绿萍属和斑萍属,毕节市只采到绿萍属,六盘水采到绿萍属和斑萍属。

图2 浮萍代表性株系的形态学观察Fig.2 Morphological observation of representative strains of Duckweed
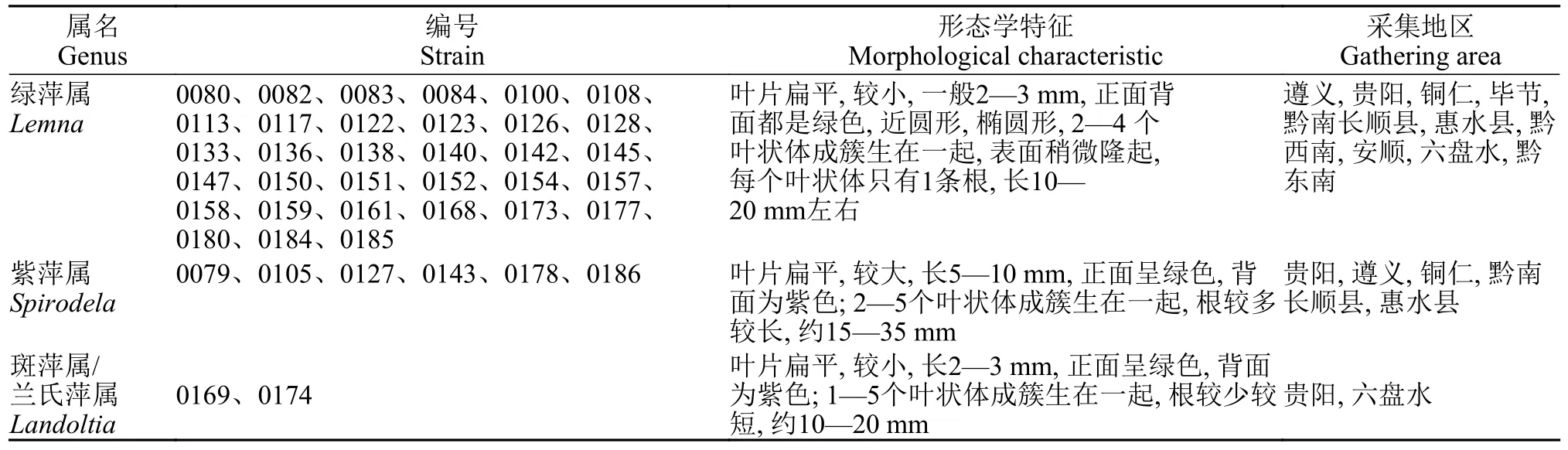
表2 浮萍种质的形态学鉴定Tab.2 Morphological identification of duckweed germplasm
2.2 叶绿体保守序列PCR扩增
图3是部分浮萍株系的atpF-atpH间隔序列和rpS16内含子序列PCR扩增结果。其41个种质都成功扩增出目的条带,其中atpF-atpH间隔序列的长度为 687—708 bp,rpS16内含子序列的长度为1020—1059 bp 。
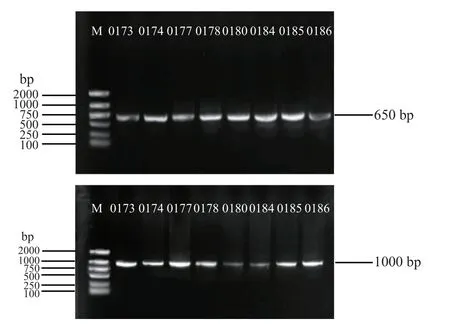
图3 部分浮萍种质atpF-atpH间隔序列和rpS16间隔序列凝胶电泳图Fig.3 Gel electrophoresis of atpF-atpH interval sequence and rpS16 interval sequence of some duckweed germplasm
2.3 分子生物学鉴定结果
利用浮萍叶绿体atpF-atpH间隔序列和rpS16内含子序列进行分子聚类分析,41份浮萍种质聚类到4个种,分别是L.aequinoctialis、L.minor、Spirodela polyrhiza和Landoltia punctata。用两种序列所得出的结果吻合,在属间的分类与形态学分类的结果一致。其中L.minor种质数量最多,有29份,4份属于L.aequinoctialis,6份属于S.polyrhiza,2份属于L.punctata(表3)。
利用atpF-atpH间隔序列和rpS16内含子序列分别用BioDeit软件比对后,用MAGE6软件构建分子系统发育树(图4)。
从NCBI上下载了浮萍37个种的叶绿体atpF-atpH间隔序列,并按照全部序列中最短的序列进行剪切,构建的系统发育树亲缘关系更准确;同样,在NCBI上下载25条浮萍rpS16内含子序列,其中,绿萍有7个未找到,无根萍有1个未找到,芜萍属有4个未找到,本次在贵州省内的样品采集过程中没有以上浮萍种,所以对实验分析结果的影响不大。
由发育树图 4a可看出,0168所代表的29份浮萍种质由atpF-atpH间隔序列所构成的系统发育树都与L.minor聚为一类,因此,这29份种质为L.minor,0145、0080、0083和0180与L.aequinoctialis聚为一类,以0079为代表的6份种质与S.polyrhiza聚为一类,0169、0174与L.punctata聚为一类;此结果与图 4b相对比,聚类结果相同。将41份浮种质分类进行总结(表3)。

图4 贵州41份浮萍种质的系统发育树Fig.4 Phylogenetic tree of 41 Duckweed germplasm in Guizhou Province
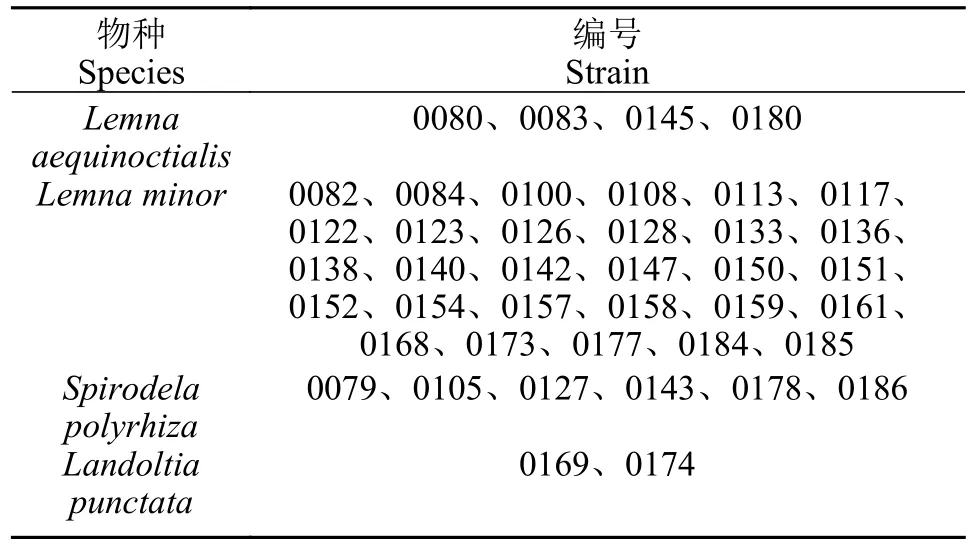
表3 贵州省41份浮萍种质的分类Tab.3 Classification of 43 duckweed germplasm in Guizhou Province
2.4 遗传多样性分析
利用DNA SP6软件分析贵州省浮萍种质的遗传多样性。结果表明贵州省浮萍种质的遗传多样性非常丰富,基于atpF-atpH和rpS16的单倍型指数分别为13和10,群体突变率分别为0.15380和0.14334,核苷酸多态性指数分别为0.08725和0.09158,每kb平均核苷酸差异数为47.20000和61.72200,单倍型多态性指数分别为0.98700和0.64700(表4)。
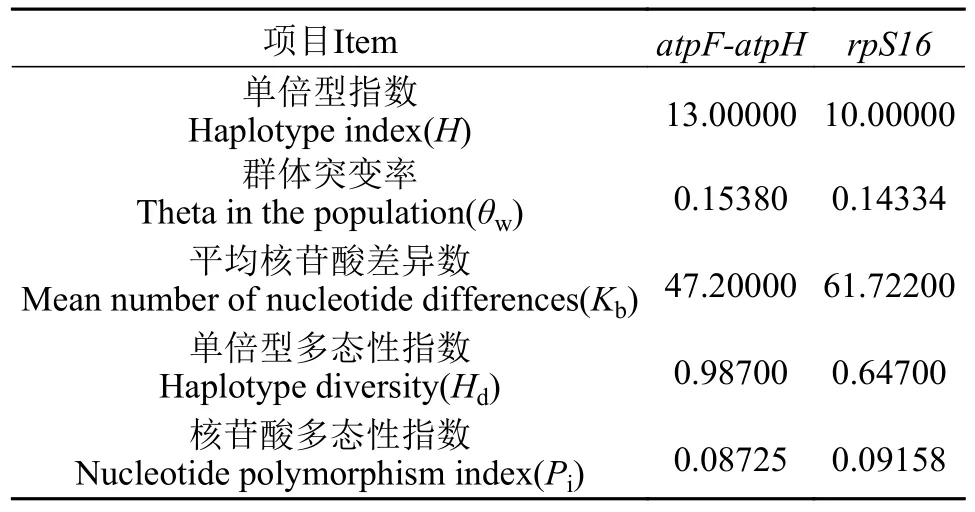
表4 贵州省浮萍遗传多样性分析Tab.4 Genetic diversity analysis of duckweed in Guizhou Province
不同属间遗传多样性也存在差异,绿萍属基于atpF-atpH的单倍型指数远大于rpS16序列的单倍型指数,多根紫萍属和少根紫萍属单倍型数分别为5和1,绿萍属平均每kb核苷酸差异数及核苷酸多态性指数最大,其次是紫萍属;群体突变率也是绿萍属最大,其次是紫萍属,斑萍属群体突变率及核苷酸多态性均最小(表5)。

表5 不同属浮萍遗传多样性分析Tab.5 Genetic diversity analysis of duckweed in different genera
3 讨论
3.1 贵州省浮萍种质资源分布
贵州省分为黔中、黔西、黔北、黔东南等几个地区,黔中地区包括贵阳、安顺等市,属于以山地、丘陵为主的丘原盆地地区,最高温度平均在25—28℃[37],水资源丰富,绿萍属分布较多;黔北地区的遵义和铜仁市多有绿萍属和紫萍属,遵义市处于云贵高原向湖南丘陵和四川盆地过渡的斜坡地带,在云贵高原的东北部,地形起伏大[38],主要分布绿萍属,铜仁市在远离河谷的山原面上,岩溶、丘陵、洼地较多,地面起伏不太大,主要分布绿萍属和紫萍属;黔东南山地纵横,峰峦连绵,群山叠翠、林木葱笼,森林资源丰富,年平均气温15℃左右,在黔东南地区只采集到绿萍属;黔西地区包括六盘水、毕节等市,主要分布绿萍属和斑萍属,毕节市地处滇东高原向黔中山原丘陵过渡的倾斜地带,平均温度10—15℃[39],只采集到绿萍属,六盘水市地处长江水系和珠江水系的分水岭地区,境内10 km以上河流43条,水资源丰富,采集到绿萍属和斑萍属。因此可以看出,紫萍属多在地势起伏不大,温度较高的地区有分布;斑萍属在温度为25℃左右、水资源丰富的地区分布较多,绿萍属适应能力更强,温度适应域较宽,10—25℃均能生长,对自然环境的适应能力较强,分布最广;此外,贵州省属于喀斯特地貌,全省地貌可概括分为高原、山地、丘陵和盆地四种基本类型,其中92.5%的面积为山地和丘陵,水域分布不均匀,由于某些人为原因(比如使用除草剂或人工清理等)使浮萍科植物生长的池塘、稻田等水域未采集到浮萍,虽然采样地分布较集中,但是在贵州省9个地级行政区都进行了采集,并且常见的绿萍属、紫萍属、斑萍属都有采集到。因此,对研究浮萍科植物在贵州省的分布及遗传多样性分析均无较大影响。
3.2 贵州省浮萍种质资源鉴定
经构建系统发育树分析发现,贵州省41份浮萍种质,经过聚类分析得到3属4种,分别是L.aequinoctialis、L.minor、S.polyrhiza和L.punctata,其中L.minor分布最多。浮萍科植物有5个属37种,而相关研究发现除泥萍属(Wolffiella)从未在国内找到以外,中国浮萍科植物只有4属[40]。在海南岛收集到34个浮萍株系,经过鉴定共有4属4种,分别是Wolffia globosa、L.aequinoctialis、S.Polyrrhiza和L.punctata[41];太湖流域采集到3属5种浮萍,分别为S.polyrrhiza、L.minor、Lemna turionifera、L.aequinoctialis和L.punctata[42];2018年,陈蕾等[43]在广东和江苏2省采集了63份浮萍样品,结果为3属4种,L.aequinoctialis、L.minor、S.polyrhiza和L.punctata,其中广东采集的浮萍均为L.minor;江西省10个市29个县(区)采集到39份浮萍种质,经过种属鉴定,共有4属5种,分别为L.minor、Lemna perpusilla、S.polyrrhiza、L.punctata和Wolffia arrhiza,L.minor最多共34株[44]。目前,中国长江中游的湖北、湖南,下游地区的江西一带,包括东边的浙江和福建,南边的广东,东北方向的江苏及华南地区的海南等8个省份的浮萍种质资源研究取得较大进展。而贵州省位于中国西南喀斯特地区的中心区域,喀斯特地貌发育强烈,地形起伏大,湿润温暖,光照充足,多年年均降水量约为1142 mm,年均气温16℃[45,46],气候及水资源均是浮萍科植物生长的良好环境,尚未有关于浮萍分布及遗传多样性的研究,因此,本实验采集了贵州省41份浮萍种质,经过聚类分析得到3属4种,其中L.minor是优势种,在亚热带湿润季风气候地区,热量丰富、雨量充沛、光照充足,非常适合浮萍科植物的生长,但是不同属之间对水体环境的适应能力不同,绿萍属在不同水域中均有分布,而紫萍属和斑萍属多在地势起伏不大、温度较高、水资源丰富的地区分布,贵州省浮萍种质资源丰富,并且积累了较多的遗传多样性。
3.3 贵州省浮萍遗传多样性分析
遗传多样性是生物多样性的重要组成部分,是地球上所有生物携带的遗传信息的总和。已有研究发现atpF-atpH间隔序列和rpS16内含子序列保守性很高,最能体现浮萍多样性的特点[47],因此,本研究对贵州省41个浮萍样品DNA 序列进行遗传多样性分析,利用atpF-atpH间隔序列和rpS16内含子序列共同鉴定浮萍科植物的种属准确性更高,其中主要分析群体突变率(θw)、平均核苷酸差异数(kb)、单倍型多态性指数(Hd)和核苷酸多态性指数(Pi)。目前,国内只有吉林省、长江中游湖南、湖北地区和福建地区对浮萍科植物遗传多样性进行了研究[48],与典型亚热带季风气候地区对比,贵州省浮萍科植物的群体突变率均较大,绿萍属和紫萍属基于atpFatpH间隔序列和rpS16内含子序列的每kb平均核苷酸差异数和核苷酸多态性指数均远大于湖南、湖北地区,福建地区和典型温带季风地区吉林省均未找到斑萍属,贵州省绿萍属和紫萍属遗传多样性也均大于福建省和吉林省的浮萍科植物多样性。由此可见:贵州省浮萍种质存在丰富的遗传多样性。喀斯特地区亚热带湿润季风气候高温多雨,全年温润,使浮萍科植物积累了较多的遗传多样性。因此贵州省浮萍科植物的遗传多样性丰富。
本研究以贵州省为代表对亚热带湿润季风气候喀斯特地区浮萍科植物进行种属鉴定和遗传多样性分析,比较了浮萍种间亲缘关系及变异情况,为浮萍种属鉴定和亲缘关系分析提供依据,有利于对亚热带湿润季风气候地区浮萍科植物的研究。
