miR-299-3p靶向ALDH3A1下调NF-κB信号通路诱导胃癌细胞凋亡的机制研究
2022-08-04周宁于文燕
周宁 于文燕
胃癌(gastric cancer)是一种常见的恶性消化系统肿瘤,病死率高居世界癌症第二位[1],2018年估计有78.3万人死于胃癌,50%的患者来自中国,欧洲国家胃癌5年生存率为10%~30%[2]。研究胃癌进展的潜在机制,为疾病诊治提供有效分子靶点,已成为胃癌基础临床研究的重点。miRNA(micro RNA)在胃癌组织和体液中表达异常,对胃癌诊断和预后具有重要应用前景[3]。另有研究表明,miR-299-3p在舌鳞状细胞癌[4]、肝癌[5]中都发挥抑癌作用,miR-299-3p在胃癌组织中低表达,可能参与胃癌的发生发展[6]。乙醛脱氢酶3A1(aldehyde dehydrogenase 3A1,ALDH3A1)在胃癌细胞中高表达,高表达ALDH3A1的胃癌患者生存期显著缩短[7,8]。下调ALDH3A1会抑制NF-κB的转录,进而抑制肺癌细胞的增殖[9]。miR-299-3p和ALDH3A1在胃癌中是否存在关系也有待研究。本研究旨在探寻miR-299-3p对胃癌凋亡的影响,并分析其作用机制是否与调控ALDH3A1有关。
1 材料与方法
1.1 材料 人胃癌细胞株BGC-823、SGC-7901、MKN-45和正常胃上皮细胞GES-1购自ATCC;胎牛血清(fetal bovine serum,FBS)(10099141)和RPMI-1640培养基(C22400500BT)购自美国Gibco公司,牛血清白蛋白(Bovine Serun Albumin,BSA)(A3912)、四氮唑蓝(MTT)(M2128)、二甲基亚砜(DMSO)(D2650)和胰蛋白酶Trypsin(T7409)购自美国Sigma-Aldrich公司;引物、miR-299-3p模拟物(miR-299-3p)、抑制剂(anti-miR-299-3p)、ALDH3A1的过表达载体(pcDNA- ALDH3A1)、干扰物(si-ALDH3A1)、阴性对照(miR-con、anti-miR-con和si-con)、双荧光素酶载体、空载体pcDNA购自上海吉玛制药有限公司;双荧光素酶报告系统购自美国Promega公司;Bax抗体(ab32503)、Bcl2抗体(ab59348)、NF-κB抗体(ab28849)、ALDH3A1抗体(ab76976)和β-actin抗体(ab179467)购自英国Abcam公司;IκB-α抗体(9242s)、p-IκB-α抗体(2859s)抗体购于美国CST公司;RNA提取试剂TRIzol(10296010)、Lipofectamine 2000转染试剂(13778-075)、反转录试剂、real-time PCR 试剂盒购自美国Invitrogen公司;细胞凋亡检测试剂盒购自美国BD公司。
1.2 方法
1.2.1 细胞培养:将人胃癌细胞株SGC-7901、MKN-45、BGC-823和正常胃上皮细胞GES-1培养在含10% FBS、100 U/ml青霉素和100 μg/ml链霉素的RPMI-1640培养液中,于湿度95%, 5% CO237℃培养箱中培养。
1.2.2 细胞转染:收集90%融合细胞,Trypsin消化,稀释细胞至浓度1×106个/ml,在6孔板培养。无血清OptiMEM培养液分别稀释Lipofectamine 2000和不同载体,将上述混合物轻柔混匀,室温作用20 min,加入融合为60%细胞,培养6 h,更换RPMI-1640完全培养基,收集转染48 h细胞进行后续实验。
1.2.3 qRT-PCR检测RNA的表达:用TRIzol试剂从胃癌细胞、胃正常上皮细胞中提取总RNA,采用反转录试剂盒合成cDNA,按照real-time PCR的说明书以cDNA为模板进行荧光定量PCR。用2-ΔΔCt方法分析miR-299-3p和ALDH3A1 mRNA表达量。
1.2.4 Western blot实验:RIPA法提取各实验组胃癌细胞总蛋白。取适量变性蛋白样品进行SDS-PAGE,转膜后,脱脂奶粉室温封闭2 h,洗膜3次,加入稀释的ALDH3A1抗体(1∶1 200)、Bax抗体(1∶2 000)、Bcl2抗体(1∶1 500)、IκB-α抗体(1∶1 500)、NF-κB抗体(1∶1 000)、p-IκB-α抗体(1∶1 000)和β-actin抗体(1∶2 000)4℃过夜孵育,洗膜3次,然后用酶标二抗室温孵育2 h。显影后,以β-actin为内参照,Image-Pro Plus 6.0软件分析目的蛋白表达量。
1.2.5 流式细胞术检测细胞凋亡:将转染后各组SGC-7901细胞消化并用结合缓冲液稀释为1×106个/ml细胞悬液。取5 μl膜联蛋白V-FITC(Annexin V-FITC)、5μl PI(碘化丙啶)加入200 μl细胞悬液中混匀,避光反应15 min,流式细胞仪分析细胞凋亡百分比。
1.2.6 双荧光素酶报告系统实验:对数期SGC-7901细胞以2×104个/孔接种于24孔板中,培养至细胞60%融和进行转染,将构建的野生型(WT)和突变型(MUT)荧光素酶报告质粒WT-ALDH3A1、MUT-ALDH3A1分别与miR-con、miR-299-3p mimics、anti-miR-con或anti-miR-299-3p共转染。培养48 h,RIPA法裂解细胞收集上清,加入底物,发光仪测定荧光素酶活性,计算相对萤火虫荧光素酶活性。
2 结果
2.1 miR-299-3p和ALDH3A1在胃癌细胞株和胃正常上皮细胞中的表达 Western blot和qRT-PCR结果表明,胃癌细胞株SGC-7901、MKN-45和BGC-823中miR-299-3p表达量与胃正常上皮细胞GES-1相比显著降低(P<0.05),ALDH3A1的mRNA和蛋白表达量与胃正常上皮细胞GES-1相比显著升高(P<0.05)。见图1,表1。
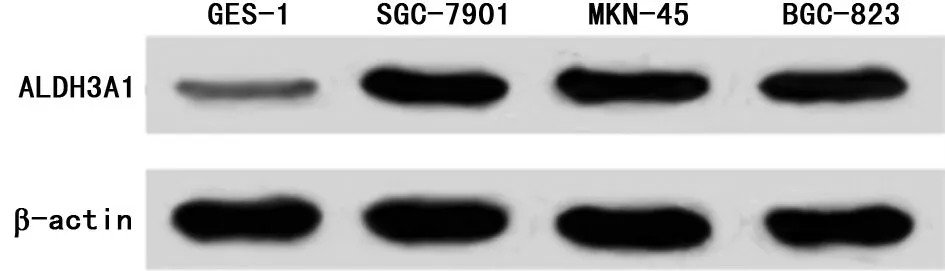
图1 检测胃癌细胞株和胃正常上皮细胞中ALDH3A1的表达
表1 ALDH3A1和miR-299-3p在胃癌细胞株中的表达
2.2 过表达miR-299-3p可诱导胃癌细胞SGC-7901凋亡 miR-299-3p组SGC-7901细胞的miR-299-3p表达量、凋亡率、Bax蛋白表达量与miR-con组相比显著升高(P<0.05),Bcl2蛋白表达量与miR-con组相比显著降低(P<0.05)。见表2,图2、3。
表2 过表达miR-299-3p对胃癌SGC-7901细胞凋亡的影响
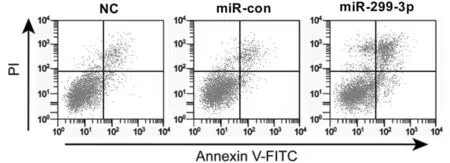
图2 过表达miR-299-3p对胃癌SGC-7901细胞凋亡的影响
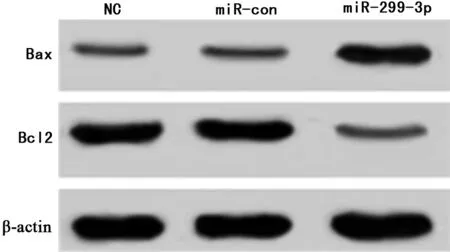
图3 western blot检测过表达miR-299-3p对SGC-7901细胞凋亡相关蛋白的影响
2.3 miR-299-3p靶向调控ALDH3A1的表达 Targetscan预测到miR-299-3p与ALDH3A1的3’-UTR存在特异结合位点。与转染miR-con相比,转染miR-299-3p mimics后SGC-7901细胞WT-ALDH3A1的相对萤火虫荧光素酶活性显著下降(P<0.05),而MUT-ALDH3A1的相对萤火虫荧光素酶相对活性没有明显变化;与转染anti-miR-con相比,转染anti-miR-299-3p后SGC-7901细胞WT-ALDH3A1的相对萤火虫荧光素酶活性显著升高(P<0.05),而MUT-ALDH3A1的相对萤火虫荧光素酶活性 没有明显变化。Western blot结果发现,miR-299-3p组的ALDH3A1蛋白表达量与miR-con组相比显著下降(P<0.05);anti-miR-299-3p组的ALDH3A1表达量与anti-miR-con组相比显著上升(P<0.05)。见图4、5,表3、4。

图4 ALDH3A1的3’-UTR的序列中含有与miR-299-3p互补的核苷酸序列
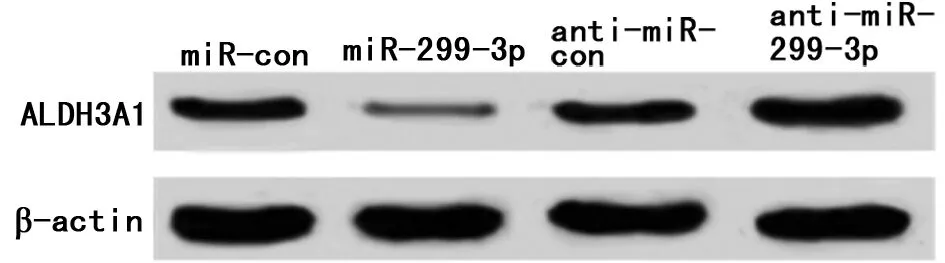
图5 miR-299-3p的表达对SGC-7901细胞中ALDH3A1蛋白表达的影响
表3 双荧光素酶报告实验
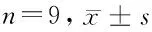
表4 miR-299-3p调控ALDH3A1的表达
2.4 抑制ALDH3A1表达可诱导SGC-7901细胞凋亡 Western blot结果显示,与si-con组相比,si-ALDH3A1组的ALDH3A1表达量显著降低(P<0.05),细胞凋亡率显著升高(P<0.05),促凋亡蛋白Bax表达量升高(P<0.05),抗凋亡蛋白Bcl2表达量显著降低(P<0.05)。说明抑制ALDH3A1可诱导SGC-7901细胞凋亡。见图6,表5。
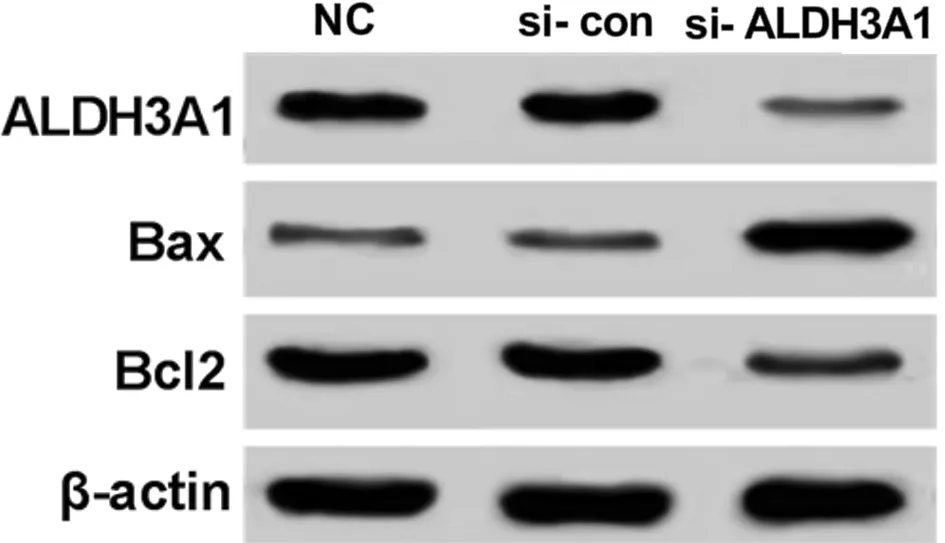
图6 抑制ALDH3A1表达对SGC-7901细胞中凋亡相关蛋白表达量的影响
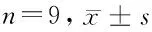
表5 抑制ALDH3A1表达对SGC-7901细胞凋亡的影响
2.5 miR-299-3p靶向ALDH3A1调控SGC-7901细胞的NF-κB信号通路和凋亡 与miR-con组相比,miR-299-3p组的NF-κB信号通路蛋白IκB-α表达量无显著变化,ALDH3A1、p-IκB-α和NF-κB蛋白表达量显著下降(P<0.05),细胞凋亡率显著上升(P<0.05),Bax表达升高(P<0.05),Bcl2表达下降;同时过表达miR-299-3p和ALDH3A1则结果相反。见图7、8,表6、7。
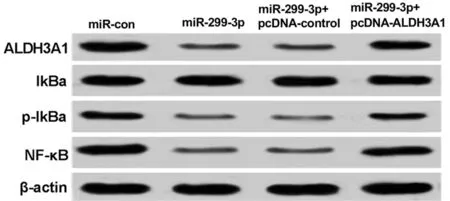
图7 SGC-7901细胞中NF-κB信号通路相关蛋白的表达
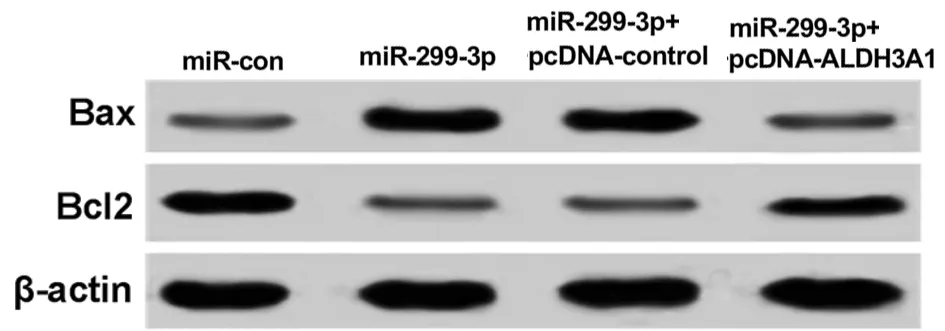
图8 检测SGC-7901细胞中凋亡相关蛋白的表达
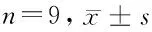
表6 过表达ALDH3A1逆转了上调miR-299-3p表达对SGC-7901细胞中NF-κB信号通路相关蛋白表达的影响
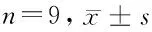
表7 过表达ALDH3A1逆转了上调miR-299-3p表达对SGC-7901细胞凋亡的作用
3 讨论
胃癌在中国发病率相对较高,虽然早期患者5年生存率可达90%,但是因早期诊断率低,大多患者确诊时已是晚期,预后一般较差,全球晚期5年生存率大约5%~10%,患者生存质量较差,负担较重[10,11]。研究胃癌细胞凋亡机制可以为疾病提供早期分子治疗靶点。
研究表明,在胃癌中,多种miRNA异常表达并通过靶向下游基因,通过多个信号通路影响癌细胞的增殖、转移、凋亡和耐药性等过程[12]。Göhring等[13]通过微流体芯片实验证明,在乳腺癌和纤维肉瘤细胞中,miR-299-3p下调Oct4(Octamer-binding factor)可导致侵袭性降低,miR-299-3p可导致癌细胞凋亡。miR-299-5p在肠型胃腺癌组织中表达显著下调,可能作为肠型胃腺癌的肿瘤标志物[14]。miR-299-3p在胃癌中表达下调,具体作用机制尚不清楚[6]。本研究发现,miR-299-3p在胃癌细胞株SGC-7901、MKN-45和BGC-823中表达下调,过表达miR-299-3p可以抑制NF-κB信号通路,从而诱导SGC-7901细胞凋亡,证实了miR-299-3p在肿瘤组织多表达下调,并调控癌细胞的凋亡。
ALDH3A1又称乙醛脱氢酶3A1,是主要存在于哺乳动物角膜中的水溶性蛋白,参与细胞周期调控,保护细胞免受氧化应激[15]。Okazaki等[16]研究发现,ALDH3A1在头颈部鳞状细胞癌(HNSCC)细胞高表达,ALDH3A1的下调可增强肿瘤细胞对肿瘤抑制药物磺胺嘧啶的敏感性。Wu等[17]研究表明,ALDH3A1在胃癌干细胞样细胞中表达上调,与胃癌的发育不良、分级、分化、淋巴结转移、肿瘤分期均有较好的相关性。本研究结果发现,ALDH3A1在3个胃癌细胞株中表达上调,抑制ALDH3A1表达可诱导SGC-7901细胞凋亡,证实了ALDH3A1的表达在肿瘤中具有重要意义。
核转录因子κB(nuclear factor Kappa B,NF-κB)与胃癌的发病和发展都有关,激活NF-κB信号通路可使促凋亡蛋白Bax、p-IκB-α和NF-κB的过表达,促进细胞凋亡,下调NF-κB信号通路可促进肿瘤细胞的凋亡,抑制肿瘤发生发展[18]。本研究通过检测NF-κB信号通路蛋白,发现过表达miR-299-3p可抑制NF-κB信号通路,促进癌细胞凋亡,说明miR-299-3p可能通过调控NF-κB信号通路促进癌细胞凋亡。
另外,Targetscan预测到miR-299-3p与ALDH3A1的3’-UTR存在互补的核苷酸序列,提示ALDH3A1是miR-299-3p潜在下游靶点。进一步双荧光素酶报告实验证实miR-299-3p靶向负调控ALDH3A1的表达;蛋白表达水平和凋亡实验表明,过表达ALDH3A1逆转了上调miR-299-3p对SGC-7901细胞凋亡的促进作用以及对NF-κB信号通路的抑制作用,进一步证实了miR-299-3p与ALDH3A1在胃癌中的调控关系。
本研究首次阐述了在胃癌SGC-7901细胞中miR-299-3p靶向ALDH3A1抑制NF-κB信号通路调控肿瘤细胞的凋亡。这为胃癌发病机制研究提供了新的方向,为防治胃癌的提供了潜在有效靶点。
