异黏蛋白对前列腺癌PC-3细胞多西他赛药物敏感性的影响研究
2022-08-04孟亚军李江涛
孟亚军,李江涛,张 静
(1. 中国人民解放军陆军第八十二集团军医院,河北 保定 071000;2. 河北省第八人民医院,河北 石家庄 050000;3. 保定市第二中心医院,河北 保定 072750)
前列腺癌是前列腺上皮细胞恶性增生所致的一种肿瘤,其发病率存在明显的地域差异,欧美地区较高[1]。我国由于人口老龄化和生活方式的西方化,近年来其发病率出现升高趋势,成为了威胁我国老年男性健康的重要疾病之一。前列腺癌中98%为腺癌,常从前列腺萎缩的外周部分发生,大多数为多病灶[2]。根治性前列腺切除术是治疗局限于前列腺内肿瘤的主要术式,也可作为放疗后复发患者的一种补救治疗措施[3]。内分泌治疗是前列腺治疗的重要手段之一,但是绝大多数最初对内分泌治疗敏感的患者在18~24个月后转变为去势抵抗性前列腺癌[4],而目前对去势抵抗性前列腺癌尚无有效治疗策略。异黏蛋白(MTDH)是一种转移黏附基因,是多种恶性肿瘤、炎性疾病的调节因子[5],但其对化疗药物敏感性是否有影响尚不明确。本研究旨在通过观察MTDH基因转染前列腺癌PC-3细胞前后细胞中MTDH的表达情况及转染后对化疗药物的敏感性,探讨MTDH与药物敏感性之间的关系,从而寻找一种可以评估前列腺癌预后并指导治疗的分子生物学指标。
1 实验材料与方法
1.1细胞株、药物、试剂和仪器 前列腺癌PC-3细胞株购自中国科学院上海生命科学研究院细胞资源中心;多西他赛(DTX)购自美国Selleck;1640培养基、10%胎牛血清、青链霉素、链霉素购自美国Invitrogen公司;MTDH鼠抗人单克隆抗体购自北京中杉金桥生物技术有限公司;反转录试剂盒购自赛默飞世尔科技公司;PCR仪购自美国ABI公司;Epics-XLⅡ型流式细胞仪购自美国Beckman Coulter公司;HZQ-X100振荡培养箱购自哈尔滨市东联电子技术开发有限公司。
1.2细胞培养及转染方法
1.2.1细胞株培养和耐药株构建 参考文献[6]方法,将前列腺癌PC-3细胞株置于10%胎牛血清和1%青-链霉素双抗的RPMI-1640的培养基中复苏,放于37 ℃、5%的CO2中培养,当细胞融合80%以上时,吸取培养瓶中的残液,加入RPMI-1640终止。采用吸管将贴壁细胞吹打成细胞悬液,置于37 ℃、5%的CO2中继续培养。采用浓度递增的DTX(0.1 nmol/L、0.2 nmol/L、0.5 nmol/L、1 nmol/L、5 nmol/L、10 nmol/L)间断性刺激PC-3细胞,当PC-3细胞株在当前浓度下恢复到未加药的生长速度,且可以稳定传代,即可认为PC-3耐DTX细胞株(PC/DTX)构建成功。
1.2.2PC-3/DTX细胞分组和转染 实验分为对照组、NC-shRNA组和MTDH-shRNA组,每组取PC-3/DTX细胞以1×105个/孔密度接种至6孔细胞培养板中,对照组添加转染试剂,NC-shRNA组转染空载体shRNA-NC慢病毒,MTDH-shRNA组转染MTDH-shRNA,按照Lipofectamine 3000试剂说明进行转染,转染48 h。
1.3检测指标及方法
1.3.1MTDH mRNA检测 采用qRT-PCR法检测PC-3细胞和PC-3/DTX细胞中及PC-3/DTX细胞各组中MTDH mRNA表达情况:Tirzol法提取细胞中的RNA,反转录合成cDNA,采用SYBR Premix Ex Taq Ⅱ试剂盒检测。荧光定量PCR反应体系:SYBR Premix Ex Taq Ⅱ 12.5 μL,Reverse Primer C引物1 μL,Forward Primer引物1 μL;荧光定量PCR反应条件:95 ℃预变性60 s,1个循环;95 ℃变性10 s,60 ℃退火和延伸30 s,40个循环;用相对定量2-ΔΔCT方法计算MTDH mRNA表达量。
1.3.2MTDH和PI3K/Akt/mTOR信号通路相关蛋白检测 采用Western blot法检测:收集细胞,加入总蛋白提取液,充分吹打后放置冰上20 min,吸出匀浆液移入离心管中,9 000×g离心10 min,收集上清液,BCA法检测蛋白浓度。SDS-PAG电泳,转膜至PVDF膜,将膜置于脱脂奶粉中封闭,孵育60 min,弃封闭液,加入MTDH(1∶1 000)、Akt(1∶1 000)、mTOR(1∶200)、PI3K110α(1∶1 000)、p-Akt(1∶500)、p-mTOR(1∶200)和p-P70s6k(1∶500)一抗溶液,孵育60 min,加入二抗溶液(稀释比例均为1∶10 000),孵育1 h,将β-actin作为内参,化学发光和显影、定影,Quantityone软件分析条带光密度值。
1.3.3细胞存活率检测 采用MTT 法检测:将对照组、NC-shRNA组和MTDH-shRNA组PC-3/DTX细胞密度调整为1.0×105/mL,每个孔以200 μL接种于96孔的培养板中,培养48 h后,分别加入不同浓度的DTX(20 nmol/L、40 nmol/L、80 nmol/L、160 nmol/L),对照组不加任何药物,设置4个复孔,然后加入5 mg/mL的MTT工作液,混匀后放于5%CO2、37 ℃的培养箱中培养4 h,离心后,去上清,每个孔中加入200 μL的二甲基亚砜,采用Bio-rad酶标仪检测吸光度值。
1.3.4细胞凋亡检测 细胞转染后48 h,采用0.25%的胰酶和2%的EDTA消化,用50 μL的PBS重悬细胞,离心10 min,将细胞悬液转移到试管中,分别加入5 μL的Annexin Ⅴ和10 μL的PI孵育15 min,上流式细胞仪检测,采用Cellquest 1.2软件分析。

2 结 果
2.1PC-3和PC-3/DTX细胞株中MTDH mRNA及蛋白表达情况 PC-3/DTX细胞株中MTDH mRNA及蛋白相对表达量分别为1.36±0.29和1.42±0.32,PC-3细胞中分别为0.48±0.11和0.56±0.13,PC-3/DTX细胞株中MTDH mRNA及蛋白相对表达量较PC-3细胞中高,差异均有统计学意义(P均<0.05)。
2.2各组PC-3/DTX细胞中MTDH mRNA及蛋白表达情况 对照组和NC-shRNA组MTDH mRNA及蛋白相对表达量比较差异均无统计学意义(P均>0.05),MTDH-shRNA组MTDH mRNA及蛋白相对表达量均明显低于对照组和NC-shRNA组(P均<0.05)。见图1和表1。

图1 各组PC-3耐多西他赛细胞中MTDH蛋白表达情况

表1 各组PC-3耐多西他赛细胞中MTDH mRNA及蛋白表达情况
2.3各组PC-3/DTX细胞存活情况 不同浓度的DTX作用24 h后,对照组和NC-shRNA组细胞存活率比较差异均无统计学意义(P均>0.05),MTDH-shRNA组细胞存活率均明显低于对照组和NC-shRNA组(P均<0.05)。见表2。

表2 不同浓度的多西他赛作用24 h后各组PC-3耐多西他赛细胞存活率比较
2.4各组PC-3/DTX细胞凋亡情况 对照组、NC-shRNA组、MTDH-shRNA组细胞凋亡率分别为(5.87±1.69)%、(6.03±1.74)%、(33.52±8.46)%,对照组和NC-shRNA组细胞凋亡率比较差异无统计学意义(P>0.05),MTDH-shRNA组细胞凋亡率明显高于对照组和NC-shRNA组(P均<0.05)。见图2。
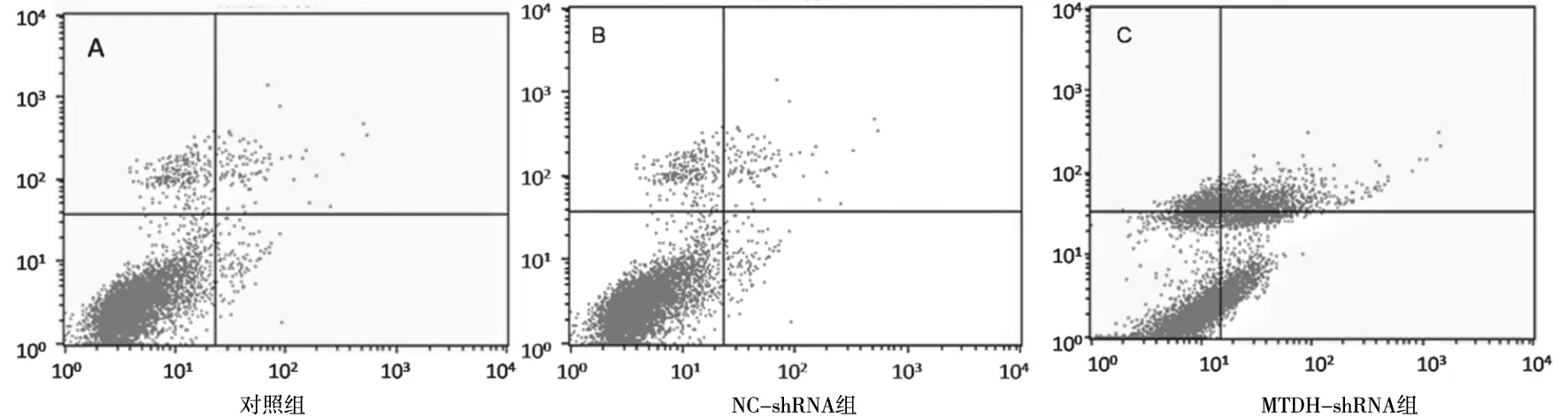
图2 各组PC-3耐多西他赛细胞凋亡情况
2.5各组PC-3/DTX细胞中PI3K/Akt/mTOR信号通路相关因子蛋白表达情况 对照组和NC-shRNA组PC-3/DTX细胞中PI3K110α、p-Akt、p-mTOR和p-P70s6k蛋白相对表达量比较差异均无统计学意义(P均>0.05),MTDH-shRNA组PC-3/DTX细胞中PI3K110α、p-Akt、p-mTOR和p-P70s6k蛋白相对表达量均明显低于对照组和NC-shRNA组(P均<0.05),3组Akt和mTOR蛋白相对表达量比较差异均无统计学意义(P均>0.05)。见表3和图3。

图3 各组PC-3耐多西他赛细胞中PI3K/Akt/mTOR信号通路相关因子蛋白表达情况

表3 各组PC-3耐多西他赛细胞中PI3K/Akt/mTOR信号通路相关因子蛋白相对表达量比较
3 讨 论
前列腺癌是男性泌尿生殖系统最常见的恶性肿瘤之一,发病率与年龄有关,70~80岁人群高发[7]。目前前列腺癌缺乏有效治疗手段,DEX是化疗主要用药,初次用药有效,但患者多在6.3个月左右出现肿瘤耐药,导致治疗失败[8]。肿瘤耐药是指长期使用某种药物过程中,肿瘤细胞对于药物作用产生耐受性,导致药物作用显著降低甚至无效[9-10]。在没有新的替代药物出现的情况下,如何逆转DEX的耐药,增强DEX化疗方案的敏感性成为研究重点。近年来,采用RNA干扰技术,通过基因沉默的方式逆转肿瘤耐药研究取得了一定的成果,故本研究进行了相关探讨。
MTDH基因又称为AEG-1基因,由582个氨基酸组成,分子量64 kDa,起初在艾滋病病毒(HIV)包膜蛋白、肿瘤坏死因子或HIV-1感染处理过的原代培养的人胚胎星形胶质细胞中发现,随着研究深入,发现其在多种肿瘤中均有表达[11-12]。MTDH是一类多功能细胞增殖调控因子,在恶性肿瘤的发生发展中具有促肿瘤细胞生长、增殖、迁移、血管生成和抑制其凋亡等作用[13]。MTDH在前列腺癌细胞的生长调控和向恶性表型转化方面起重要作用,阻断MTDH的信号传导会恢复细胞的表型,促进细胞凋亡,提高细胞对化疗的敏感性,并抑制癌细胞转移[14]。张玲芳等[15]研究表明,MTDH过表达引起的P-gp过表达和Wnt/β-catenin信号通路活化,可能与乳腺癌化疗耐药有关。侯赞等[16]研究发现,miR-506-3p可通过靶向抑制MTDH的表达增强人前列腺癌耐药细胞株PC-3/PTX的化学敏感性。
本实验结果显示,PC-3/DTX细胞株中MTDH mRNA及蛋白表达量明显增高;沉默MTDH后,PC-3/DTX细胞株中MTDH mRNA及蛋白表达量和PC-3/DTX细胞存活率明显降低,细胞凋亡率明显增高,PI3K110α、p-Akt、p-mTOR和p-P70s6k蛋白表达量明显降低。提示PC-3/DTX细胞株中MTDH高表达,MTDH可能通过PI3K/Akt/mTOR信号通路促进细胞增殖和抑制细胞凋亡,沉默PC-3/DTX细胞株MTDH基因后,可能通过抑制PI3K/Akt/mTOR信号通路,从而抑制PC-3/DTX细胞增殖,诱导其凋亡,并提高耐药细胞对DTX的敏感性,将MTDH作为分子靶向的靶点在前列腺癌的治疗领域有着广阔的前景。
利益冲突:所有作者均声明不存在利益冲突。
