背根神经节表达的N-甲基-D-天冬氨酸受体在神经病理性疼痛中的作用
2022-08-04李金时范易听
李金时,范易听,方 波
(中国医科大学附属第一医院,辽宁 沈阳110002)
0 引言
背根神经节(Dorsal Root Ganglion,DRG)是各椎间孔内侧面附近脊髓背根的膨胀结节,由向心感觉纤维细胞构成,负责接收来自身体感受器的全部神经冲动,包括一般躯体感觉和内脏感觉;DRG内含躯体初级感觉神经元(Primary Sensory Neuron,PSN)胞体,这一细胞群由浅染的大细胞(Aα和Aβ神经元,传递非伤害性信息主要是触觉、振动和本体感觉)和深染的小细胞(Aδ和C神经元,负责伤害性感受的传递)组成,占比约15%[1-3].因此从解剖学和功能意义角度出发,DRG位于外周和中枢神经系统(Central Nervous System,CNS)的交界处[4-5].在外周神经损伤的情况下,伤害性感受器对于正常的非伤害性刺激的阈值降低,进而诱发痛觉过敏[4].经过多年的研究,科研人员发现DRG的可塑性和形态的变化似乎是慢性疼痛的标志,可成为治疗干预的新靶点[5](见表1).N-甲基-D-天冬氨酸受体(N-methyl-D-aspartic Acid Receptor,NMDAR)因其具有兴奋性突触传递的功能和可塑性改变的特性,例如从记忆形成到慢性疼痛的各种神经活动过程中该受体都起到了关键作用,以至受到不同领域专家学者的特别关注[6].研究表明,神经病理性疼痛(Neuropathic Pain,NP)可能是由于伤害性通路的长期可塑性改变所致,如外周伤害性纤维中的NMDAR可能通过介导外周敏化参与NP的发生[7-8].同时,在CNS众多区域的突触可塑性调节的过程中,NMDAR的激活是普遍存在的.除此之外,NMDAR在初级传入神经元的中枢和外周终末端均有表达[9].因此,DRG中的NMDAR的可塑性改变对于NP有着重要的意义.本文对NMDAR的构成、分布、激活、调控及修饰的研究进展进行了综述,对于在DRG中表达NMDAR的神经可塑性调节机制研究具有一定的参考意义.

表1 DRG神经元的主要慢性疼痛机制[5]
1 DRG中表达的NMDAR
谷氨酸和γ-氨基丁酸(γ-aminobutyric Acid,GABA)是成年哺乳动物的2种主要的神经递质,分别发挥兴奋性和抑制性作用.上述神经递质通过2种不同类型的受体发挥作用:离子型受体和代谢型受体,离子型受体是参与快速突触传递的配体门控离子通道,代谢型受体属于G蛋白偶联受体(G Protein-Coupled Receptors,GPCRs)超家族,负责谷氨酸和GABA的神经调节作用.这些受体存在于痛觉神经轴的不同水平,进而调节伤害性信息传递和疼痛产生[10].CNS中的神经元胞膜上存在2种类型的GABA受体,分别为GABAA受体及GABAB受体[11].GABA是其中主要的抑制性递质,随着GABAA受体的激活,导致细胞膜超级化以阻止信号传递[12].
CNS中,DRG神经元胞膜上还存在着多种兴奋性受体,谷氨酸受体(Glutamate Receptor,GluR).离子型谷氨酸受体(Ionic Glutamate Receptors,iGluRs)根据其对激动剂的亲和性、自身的药理学和结构特性分为3种:NMDAR、海人藻酸受体和α-氨基-3-羟基-5-甲基-4-异恶唑受体,它们与离子通道耦联,介导快速信号传递[12].代谢型谷氨酸受体(Metabolic Glutamate Receptors,mGluRs)仅有一种,它与膜内G蛋白耦联,产生较为缓慢的生理反应.体内主要的兴奋性神经递质L-谷氨酸通过激活传入神经纤维外周和中央终末的2种受体来调节PSN的敏感性[13].上述的iGluRs被激活后,带正电的离子流入突触后膜,使神经元轻度去极化.而与iGluRs激活机制有所不同的是,mGluRs亚型与Gq/11(一种G蛋白亚型)耦联,并且广泛地表达于DRG神经元胞体和周围组织中的无髓传入纤维.当全身应用mGlu1/5R的激动剂时,增加了对于伤害性热的敏感性,导致热痛觉过敏发生;相反,应用选择性的拮抗剂时则减轻了炎性疼痛[14].因此,有理由认为GluR是预防和治疗NP的潜在靶点.其中,NMDAR是iGluRs中的一种,与上述其他GluR相比,具有独特性质.首先,NMDAR通道具有独特的门控方式,既受配体门控,又受电压门控,在CNS中必须同时被谷氨酸和甘氨酸(或丝氨酸)结合,并且在合适的电压下,通道才会开放.其次,该受体耦连多种离子通道,如具有电压依赖的Mg2+通道;NMDAR激动时,不仅对单价离子通透,还对Ca2+有高通透性,可触发各种细胞内信号级联的激活,是多种形式突触可塑性调节的基础[15].此外,NMDAR也参与许多复杂的生理和病理机制,如诱导长时程增强作用(与学习和记忆机制相关),控制发育过程中大脑神经元回路的结构和突触的可塑性、神经退行性病变、缺血缺氧导致的兴奋性毒性作用以及癫痫等疾病的发生发展[16].
2 NMDAR的组成活化机制
2.1 NMDAR亚基组成及其在DRG中的分布
NMDAR是异四聚体组成的具有功能性的离子通道,它们共同形成一个中心离子通道孔,其形状特征与倒置的钾通道极为相似.NMDAR具有7种不同的亚单位,包括GluN1/NR1、GluN2/NR2(A-D)和GluN3/NR3(A、B)[16-18].现今,NMDAR的亚基构成已经被确定为2个GluN1和2个相同或相异的GluN2(A-D),偶尔也会包含与甘氨酸结合的可抑制受体兴奋功能的GluN3(A、B)亚基[19-21].如前文所述,NMDAR必须同时被谷氨酸和甘氨酸(或丝氨酸)结合,并且在合适的电压下,才能激活;谷氨酸的结合位点在GluN2上,而甘氨酸的结合位点在GluN1上,从这个角度推测GluN1及GluN2是该功能性四聚体十分重要的亚单位[22].
CNS中,普遍存在着NMDAR,通过介导外周和中枢敏化参与慢性疼痛反应.而DRG作为外周和中枢神经的交界神经节同样也表达该受体.Marvizón等[17]验证了大鼠DRG中所表达的NMDAR包含NR1、NR2B、NR2C和NR2D亚基,但并不表达NR2A.DRG中表达至少2种不同亚基组成的NMDAR,且具有不同的细胞定位:90%的DRG神经元(其中包括大多数A神经元)表达NR1和NR2;NR2B则普遍表达于A和C神经元中,而NR2D则只表达于C神经元中.
2.1.1 GluN1
GluN1亚基与甘氨酸和d-丝氨酸结合,是功能性NMDAR的必须亚基,在中枢神经元中普遍表达.外显子5编码GluN1细胞外氨基末端结构域(Amino-Terminal Domain,ATD)中21个高电荷态氨基酸的N1盒,外显子21和22编码细胞内C末端结构域(C-Terminal Domain,CTD)中的C1和C2盒.mRNA转录的选择性剪接是调节蛋白功能的一种常见途径,GluN1亚基的可变剪接就发生于上述的ATD和CTD部位.NMDAR的标志性功能之一是含有ATD中外显子5编码的21个氨基酸残基的GluN1亚基的剪接变体,其对质子的敏感性显著降低且失活速度更快[23].外显子21和22发生的选择性剪接对NMDAR的功能和药理学特性没有明显影响,但可以改变其与细胞内蛋白的相互作用,从而影响NMDAR的亚细胞分布[24-25].与没有N1盒的GluN1亚单位(例如GluN1-1a)相比,由外显子5编码的包含N1盒的GluN1亚单位(例如GluN1-1b)可以减轻GluN2B选择性拮抗剂(依芬地尔)对NMDAR功能的抑制,并降低了细胞外Zn2+等离子的抑制敏感性作用,并几乎消除细胞外胺的增强作用[26-27].N1盒的存在加速了谷氨酸激活的NMDAR反应的失活,并缩短了兴奋性突触后电流的时程[28-29].与此同时,Regan等[30]也报道了GluN1中外显子5基序的存在改变了异四聚体GluN1-GluN2的局部结构,并与GluN1和GluN2亚单位的配体结合域(Ligand Binding Domain,LBDs)建立域间接触.这些独特的相互作用可能会影响ATD/LBD和LBD/LBD接口的稳定性,对离子敏感性和失活的控制至关重要,同时也反映了ATD与由外显子5编码的残基创建的GluN1和GluN2激动剂结合域(Agonist Binding Domain,ABD)之间的相互作用关系.
已知GluN1亚型具有不同的区域和发育表达模式[4],对于单细胞的研究表明,编码GluN1剪接变异体的mRNA带N1盒和不带N1盒可以在神经细胞中共存[31].由此推测神经元NMDAR可能包含2种不同的GluN1亚型,但目前N1亚型并未在体内得到证实.Yi等[32]研究发现,在HEK293细胞表面可以形成2种不同GluN1亚型的NMDAR的组装(1b/1b/2及1a/1a/2),同时神经元可以通过改变表达GluN1-1a和GluN1-1b亚型的比例调整NMDAR的激活和失活,含有1a/1a/2的受体要比含有1b/1b/2的受体具有更强的激动剂效力,并且其失活更慢.然而,仅含有一种GluN1-1a和一种GluN1-1b亚型(1a/1b/2)的NMDAR活性情况尚且不明确.
2.1.2 GluN2(A-D)
GluN2作为NMDAR重要的亚基之一存在于整个CNS,而且它们在发育的时间和空间上都是以细胞和突触特异性的方式差异表达.GluN2亚基还使NMDAR对胞外Zn2+、精胺和其他药理激动剂、拮抗剂及变构调节剂具有不同的敏感性[33-34].例如,与GluN1/2C和GluN1/2D受体相比,双异构体GluN1/2A和GluN1/2B受体具有更高的单通道电导、Ca2+通透性及Mg2+敏感性.此外,GluN1/2D受体对谷氨酸的亲和力最强;当激动剂与受体完全结合的时候,通道开放概率以GluN1/2A受体最高,其次是GluN1/2C和GluN1/2D受体.近年来,报道称三异构体GluN1/GluN2A/GluN2B受体,可能是成人前脑中最丰富的NMDAR,显示出中等水平的激动剂敏感性、通道开放概率和去激活动力学,以及对异丙苯地尔(GluN2B特异性阻滞剂)、Zn2+和质子的敏感性[35-36].由此,GluN2亚型的组成不同,NMDAR倾向于不同的功能,进而与核内产生不同的级联反应,又反过来导致含有不同种类亚基的NMDAR存在于不同功能的细胞中.
NMDAR突触的数量和亚基组成受到生物合成、树突运输、胞吐、侧向扩散、内吞、循环和降解之间的微妙平衡的严格控制[15].例如,与NMDAR转运相关的机制也涉及上述CTD端,受体通过CTD与细胞内转运、支架和信号分子建立蛋白质互作[37].GluN2亚基的CTD经历了各种翻译后修饰,其作用是调节突触位点的受体运输和NMDAR的稳定[38].因此,在哺乳动物CNS的神经元中,不同GluN2亚基之间的CTD多样性对于含GluN2的NMDAR的特异性转运至关重要.
2.1.3 GluN3(A-B)
GluN3A是NMDAR亚单位家族的非常规成员,与仅由GluN1和GluN2亚单位组成的NMDAR相比,它赋予了NMDAR通道低钙渗透性和降低镁敏感性.由于这些特性,GluN3A亚基作为一个分子制动器,限制了兴奋性突触的可塑性和成熟度,这表明去除GluN3A是神经元电路发展的一个关键步骤[39].含有GluN3的NMDAR要比经典的NMDAR更为罕见,后者仅由GluN1和GluN2亚基组成,具有非常规的生物物理、转运和信号传递特性.GluN3A在出生后发育的特定时期广泛表达,在新皮质、海马区、嗅球、小脑以及杏仁核、丘脑、下丘脑均有高水平表达,如GluN3A的表达在妊娠期很低,出生后不久激增,并在青春期逐渐减弱.CNS疾病的基础科学研究表明,未能正确下调GluN3A或在超过生理时间窗的情况下重新激活GluN3A表达会导致突触功能障碍并损害认知和运动能力,是成瘾、神经退行性疾病和其他大脑疾病不适应性突触重排的基础[40].
2.2 NMDAR的激活
由GluN1/GluN2亚基组成的NMDAR的激活需要2个分子的辅佐剂甘氨酸和2个分子的激动剂谷氨酸[41-43].最近,D-丝氨酸被描述为突触处的主要NMDAR的协同激动剂,而甘氨酸是突触外NMDAR协同激动剂[44].大多数突触后膜的[6]NMDAR在静止状态下会被Mg2+阻断,因此需要神经元去极化并与谷氨酸结合才使功能活跃,Ca2+通道被进一步激活,大量的钙离子进入细胞后,继而发生一系列的生化反应.以G蛋白为中介,活化磷酯酶C(Phospholipase C,PLC[7]),催化磷脂酰肌醇水解为三磷酸肌醇(Inositol 1,4,5-triphosphate,IP3)和甘油二酯(Diacylglycerol,DAG);以IP3和DAG作为第二信使,引起细胞内激发效应,IP3刺激内质网释放出Ca2+,DAG在Ca2+的存在下,激活蛋白激酶C(Protein Kinase C,PKC),不仅提高突触后膜对递质的敏感性,PKC还可以通过磷酸化蛋白质的方式,修饰核转录因子,进而引起核内相关靶蛋白基因的启动和转录[45],如图1所示.
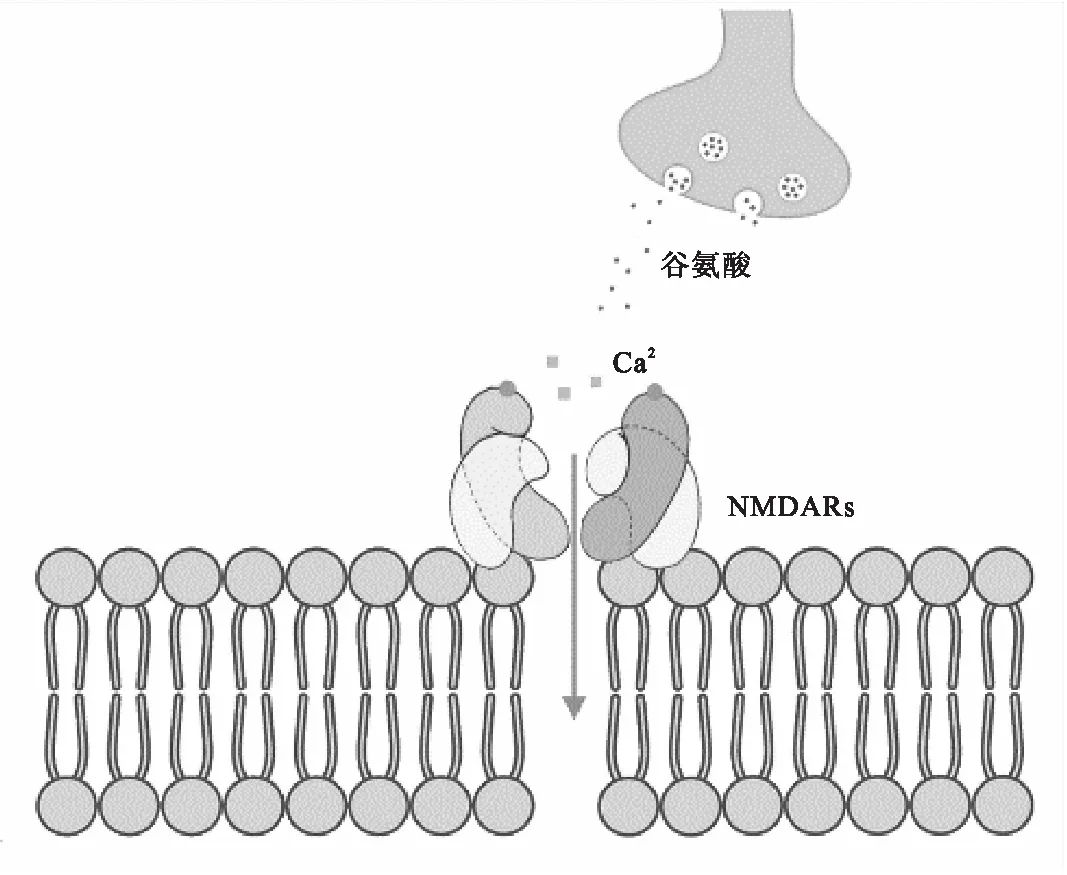
图1 NMDAR激活后通道开放伴随Ca2+内流(示意图)
2.3 NMDAR的修饰
NMDAR的激活方式并不唯一,除了与胞外配体谷氨酸及协同激活剂甘氨酸结合产生激活效应以外,对于其胞内部分的修饰也同样可以产生激活效应,而当NMDAR激活后会进一步导致病理性疼痛的发生.上文提到,功能性的NMDAR通道是由2个GluN1加上2个GluN2或GluN3亚基组装而成.所有亚基具有相似的膜拓扑结构,具有3个跨膜结构域(Transmembrane Domain,TMD)、环区以及细胞外N末端和细胞内C末端.N末端与激动剂、拮抗剂和调节剂(如锌、质子和多胺)结合,最终可以控制离子通道的开放或调节离子通道功能及脱敏行为[46].C末端的尾部调节受体与多种胞浆蛋白的相互作用.同时,这些蛋白之间的相互作用决定了NMDAR在细胞内的精准运输和定位[47].更重要的是,NMDAR亚基的C末端是翻译后修饰的底物,如磷酸化、泛素化或棕榈酰化[48].
在NMDAR的亚基中,GluN2B具有很长的C末端,并且在该亚基中发现许多丝氨酸、苏氨酸或酪氨酸的磷酸化位点[49].而磷酸化位点不同,其产生的效应并不相同.当S1480位点被酪蛋白激酶Ⅱ(Casein Kinase Ⅱ,CK2)磷酸化时,会介导GluN2B的内吞效应,同时增加GluN2A的表达,最终导致NMDAR亚基的组成发生变化[8,50-51].近20年,随着科研技术的不断提高,人们逐渐揭示各个磷酸化位点所对应的激酶,以及不同位点磷酸化后所产生不同的效应.综上,GluN2B的磷酸化可能影响NMDAR的转运,控制细胞膜上NMDAR的数量和功能.当NMDAR膜上的转运数量增多,或其功能增强,则会导致痛觉过敏的发生.
泛素是一种由76个氨基酸组成的蛋白质,可在ATP依赖的酶反应中以共价方式连接在底物上使其泛素化[9].泛素化需要泛素活化酶(E1)、泛素结合酶(E2)和泛素连接酶(E3)的共同作用.泛素化在所有细胞中都受到严格调控,具有显著的时空精确度[52].研究表明,在培养的皮层神经元中,突触表达NMDAR的数量和亚单位组成不仅受刺激依赖的基因表达和蛋白质合成的调节,还受泛素-蛋白酶体系活性依赖的蛋白质降解的调节[53-54].
棕榈酰化是蛋白质的另一种翻译后修饰,在调节蛋白质靶向膜和突触的过程中发挥重要作用[55].近来研究表明,GluN2A和GluN2B亚单位在其C末端有2个不同的共识半胱氨酸簇(Cys簇Ⅰ和Ⅱ).第一个半胱氨酸簇(Cys簇Ⅰ)的棕榈酰化控制着表面NMDAR的稳定表达和组成性内化.第二个半胱氨酸簇(Cys簇Ⅱ)被蛋白质酰基转移酶棕榈酰化,该簇的去醛化作用调节NMDAR表面的递送.此外,GluN2亚基的棕榈酰化受神经元活动的动态调节[56].由此,NMDAR的棕榈酰化增强,该受体的稳定性和膜转运都会增强,进一步加剧NP的发生.
3 NMDAR的上游调控机制
NMDAR在神经细胞表面并不是孤立存在的,其激活途径被上游因子调控的同时,产生了多重效应.Kumar等[45]报道,当NMDAR和钙离子门控通道(Voltage-gated Calcium Channels,VGCCs)激活时,导致大量Ca2+涌入胞内激活钙信号.细胞内的钙信号诱导钙/钙调蛋白依赖激酶Ⅱ(calmodulin dependent protein kinase Ⅱ,CaMKⅡ)和PKC介导GluN2B-Ser1303的磷酸化,进一步激活NMDAR,导致兴奋性增强,则意味着更多的Ca2+流入细胞内,形成正反馈环路导致细胞的钙超载.在细胞内,Ser473位蛋白激酶B(protein kinase B,PKB)和Ser133位环磷腺苷效应元件结合蛋白(cAMP-response element binding protein,CREB)的磷酸化是促进细胞存活的信号;当VGCC或NMDAR被激活后,大量的Ca2+可以螯合胞内的磷酸基团导致p-PKB和p-CREB均降低,表明NMDAR过度激活抑制PKB与CREB对细胞的保护作用并产生兴奋性毒性作用[45,57].当NMDAR的抑制剂处理后,由于激活了磷酸酶,从而引起NMDAR的去磷酸化过程发生,同时p-PKB和p-CREB的去磷酸途径关闭.由此,得出当NMDAR过分磷酸化会导致神经细胞过度兴奋产生毒性作用,最终导致细胞死亡[45].与此同时,Song等[58]在2019年报道,瞬时受体电位香草酸亚型1(Transient Receptor Potential Vanilloid1,TRPV1)受体参与了瑞芬太尼术后痛敏反应.TRPV1通过激活DRG神经元上的CaMKⅡ-PKC信号通路,使NMDAR磷酸化增强,从而参与瑞芬太尼诱导的术后痛敏的持续.此项研究证明,NMDAR受体并不是独立发挥作用的,而是可以与其他的膜受体交互,联合发挥作用进一步加重NP.由此,我们猜想若切断痛觉相关受体间的交互作用,应该可以成为抑制NP发生的新靶点.
与CaMKⅡα相同,死亡相关蛋白激酶(Death Associated Protein Kinase 1,DAPK1)也属于钙调蛋白家族的成员,结合GluN2B亚基,调节NMDAR通道电导.伴随着DAPK1-NMDAR的相互作用增加,NMDAR的GluN2B在Ser1303位点的磷酸化水平增强,NMDAR活性增强.Li等[59]在其研究中指出,选择性GluN2B拮抗剂、用腺相关病毒介导的短发夹状RNA或药物抑制剂敲除DAPK1以及DAPK1从NMDAR的GluN2B亚基解偶联后,可迅速产生抗抑郁药样作用.
NMDAR是miRNA的靶标[60-61].GluN2A和GluN2B mRNA的3′-UTRs含有许多预测的miRNA结合位点,其中有几个已经得到了实验验证.Corbel等[62]曾经报道,GluN2B是miR-539的靶标,GluN2A是miR-19a的靶点.此外,同一研究小组表明,miR-539和miR-19a在发育过程中与GluN2B和GluN2A的表达成反比,似乎可以周期性地调节NMDAR表达.根据近年来的报道,miR-223可以控制GluN2B在兴奋性毒性发生时的表达[63],而GluN2A 3′-UTR中的miR-125b结合位点赋予该mRNA结合蛋白能力[64].
Lee等[65]研究表明,NMDAR和TRPV1在大鼠三叉神经感觉神经元中存在功能上的相互作用.其意义在于,这2个独立参与肌肉疼痛和痛觉过敏的重要配体门控离子通道直接相互作用,可能作为功能单位发挥作用,具有重要的科学和临床指导作用.同时也存在着间接作用机制,即当NMDAR被激活后会随之增强CaMKⅡ和PKC的作用,进而增加TRPV1的磷酸化水平.
4 总结与展望
NP显著影响患者的情绪、睡眠、饮食等生活中的方方面面,若难以控制,严重影响生活质量.而在多年的探索中,DRG逐渐成为治疗NP的重要环节,而NMDAR也成为了新兴靶标.迄今,对NMDAR的功能、激活和修饰已经有了较为清晰认识.然而,对影响NMDAR基因的转录、翻译过程的调控机制鲜有报道.在本文中,我们较深入地讨论了NMDAR在DRG中的分布、分子组成与激活形式以及其上游的调节通路.此外,在众多NMDAR的修饰种类中,我们重点介绍了NMDAR的磷酸化机制.在NP中,最容易通过调节上游机制进而调节NMDAR的磷酸化减少,从而抑制该受体的激活作用,进一步导致Ca2+内流减少而减轻NP的发生.在多种NMDAR的亚基组成中,研究显示[11],由于GluN2B在细胞内存在较长的C端,并存在许多丝氨酸、苏氨酸或酪氨酸磷酸化位点,易于进行磷酸化的调控,从而影响NMDAR的激活.基于此,在未来的研究中,应该深入探讨NMDAR的上游调节机制网,进一步为在DRG水平中阻断NP的发生奠定基础.
