2020 年北京市啮齿类实验动物组织病理学监测总结和分析*
2022-08-03赵梦洋赖梦雨宋银娟张茜茜梁正敏杨东明王元智李志萍屈孟锦董玉慧王浩然刘一朵关芷玲孙芷馨陈玉兰昕王冬冬高虹丽赵化芬赵德明周向梅杨利峰
李 杰 赵梦洋 赖梦雨 宋银娟 张茜茜 梁正敏 杨东明 王元智 李志萍 屈孟锦 董玉慧 王浩然 刘一朵 关芷玲 姚 娇 孙芷馨 陈玉兰 葛 昕王冬冬 高虹丽 陈 森 赵化芬 李 雯 赵德明 周向梅 杨利峰
(中国农业大学动物医学院 国家动物海绵状脑病实验室,北京 100193)
科学技术是第一生产力,随着国家大力发展科学技术,实验动物科学作为科学技术的重要组成部分取得了高速发展。实验动物质量的抽查检验是实验动物主管部门综合应用抽查和检验两种方式评价、判断实验动物质量的行政行为。实验动物的特殊性决定了实验动物抽查检验的专业性、技术性和法定性。实验动物质量监督检测制度对全面了解实验动物质量,对实验动物质量总体水平做出科学的评估,及时发现实验动物质量存在的问题,采取有效措施,强化实验动物质量管理与安全意识,保障和维护实验动物生产稳定进行发挥了重要作用[1]。
病理学诊断一直被认为是准确率高于其他检查手段的“金标准”。应用传统病理学方法对实验动物质量进行系统的评价与检测,不但为实验动物质量评价提出可靠准确的依据,还有助于实验动物学科研究领域和生产实践的合理、良好、科学的发展,也是对病理学全面发展的诠释。两门学科可互相促进,共同进步[2]。本研究拟对北京20多家实验动物繁育机构2020 年两次送检的750 只啮齿类实验动物的病理检测结果进行分析总结,一方面对北京市啮齿类实验动物质量总体水平做出科学评估,及时发现实验动物质量存在的问题,从而为实验动物的生产、管理和改进提供参考。另一方面强化实验动物质量管理与安全意识,保障和维护实验动物生产稳定。
1 材料和方法
1.1 实验动物
2020 年5月份和10月份,由中国食品药品检定研究院从北京市20多家实验动物单位总共抽取750只SPF 级、清洁级的小鼠、大鼠、豚鼠、地鼠和普通级豚鼠4种实验用鼠进行调查和分析,具体情况见表1。

表1 2020年抽查的750只啮齿类实验动物采样情况Table 1 Classification of 750 rodent samples in 2020
1.2 实验方法
1.2.1组织切片的制备和观察:CO2安乐死动物,迅速采集动物的心脏、肺脏、肝脏、脾脏、肾脏、小肠和大肠。经甲醛钙液(10%甲醛+ 1%氯化钙)固定后按常规方法制作石蜡切片,HE染色,OLYMPUSU-SRG数码显微镜观察,采集图像,记录结果。
1.2.2肝脏油红O染色:对HE染色观察中有中度及以上细胞肿胀的肝脏样品,抽取部分样品进行油红O染色。主要步骤为: 组织块用甲醛钙液(10%甲醛+ 1% 氯化钙) 固定一周,肝脏组织制作冰冻切片,油红O染色,甘油明胶封片后显微镜下观察并采图。
1.2.3肝脏PAS染色:同时对HE染色观察出现中度及以上细胞肿胀的肝脏样品进行PAS染色。主要步骤为: 甲醛钙液固定,制作肝组织石蜡切片,高碘酸氧化,Schiff氏试剂染色,苏木素复染细胞核,甘油明胶封片后显微镜下观察并采图。
2 结果
2.1 小鼠的病理学变化及统计
共取样360只,其中SPF级320只,清洁级40只。结果显示,5例SPF级NPG小鼠、4例SPF级C57小鼠和10例SPF级ICR小鼠脾脏表现出弥漫性白髓细胞减少,髓外造血增加;2例SPF级C57小鼠表现出脾脏轻度出血,含铁血黄素沉着;1例SPF级BALB/c小鼠心脏表现出心外膜钙化;1例SPF级BALB/c小鼠心脏表现出心外膜炎;1例SPF级ICR小鼠在大肠肠腔中发现了寄生虫感染;1例清洁级C57小鼠小肠表现出慢性增生性肠炎;1例SPF级NIH小鼠肾脏表现出局灶性间质性肾炎;2例SPF级KM小鼠肝脏表现出肝细胞肿胀,其中1例经特殊染色证实为肝细胞脂肪变性;1例清洁级ICR小鼠肝脏表现出肝细胞肿胀,经特殊染色证实油红O染色与PAS染色均为阴性。其余各组织脏器未见明显病理变化。
2.1.1脾脏病变:与正常脾脏(图1A)相比,脾脏轻度出血在红髓中可见棕褐色含铁血黄素沉积(图1B); 脾脏弥漫性白髓细胞减少,髓外造血增加,红髓与白髓界限不清,白髓显著减少,巨噬细胞呈弥漫性增多(图1C)。

图1 小鼠脾脏组织病变情况注: A.正常脾脏; B. 脾脏轻度出血; C. 脾脏弥漫性白髓细胞减少,髓外造血增加;A、B、C为HE染色(× 400) Fig.1 Pathological changes in mouse spleens tissueNote: A. Normal spleen; B. Spleen slight bleeding; C. Spleen diffuse white medullary cell decrease and extramedullary hematopoietic increase; A, B, and C were HE staining (× 400)
2.1.2心脏病变:与正常心脏相比(图2A),心外膜炎可见心外膜增厚,炎性细胞浸润(图2B);心外膜钙化可见心外膜增厚,其内可见大量嗜碱性蓝染颗粒状成分,为大量钙盐沉着(图2C)。
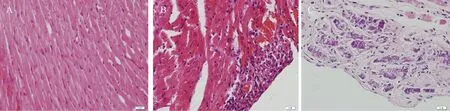
图2 小鼠心脏组织病变情况注: A.正常心脏;B.心外膜炎;C.心外膜钙化;A、B、C为HE染色(× 400)Fig.2 Pathological changes in mouse heart tissuesNote: A. Normal heart; B. Epicardial inflammation; C. Epicardial calcification; A, B, C were HE staining (× 400)
2.1.3肠道病变:与正常肠道(图3A、C)相比,病变大肠肠腔中可见寄生虫虫体(图3B); 慢性增生性肠炎可见黏膜下层增厚,较多浆细胞浸润,肠腺萎缩(图3D)。

图3 小鼠肠道组织病变情况注: A.正常直肠;B.大肠寄生虫感染;C.正常小肠;D.小肠慢性增生性肠炎;A、B、C、D为HE染色(×400)Fig.3 Pathological changes in mouse intestinal tissuesNote: A. Normal rectal; B. Rectal parasitic infection; C. Normal duodenum; D. Chronic proliferative; A, B, C and D were HE staining(×400)
2.1.4肾脏病变:与正常肾脏(图4A)相比 ,肾脏间质出现局灶性炎性细胞浸润(图4B)。

图4 小鼠肾脏组织病变情况注: A.正常肾脏;B.间质性肾炎;A、B为HE染色(× 100) Fig.4 Pathological changes in mouse kidney tissuesNote: A. Normal kidney; B. Interstitial nephritis;A and B were HE staining (×100)
2.1.5肝脏病变:与正常肝脏(图5A)相比,肝细胞肿胀可见肝小叶结构不清晰,未见明显肝索结构,肝细胞体积变大,胞质中有不同程度的空泡出现(图5B) ; 对肝细胞肿胀的样本进行PAS染色(图5C)和油红O 染色(图5D),显示肝脏脂肪变性,可见较多红色大小不一的圆形小滴分布在肝细胞胞浆中,有的围绕在细胞核周围,有的聚集呈大脂滴(图5D) 。

图5 小鼠肝脏组织病变情况注: A.正常肝脏;B.肝细胞肿胀; C.肝脏PAS染色阴性; D.肝脏脂肪变性;A、B为HE染色(× 400);C为PAS染色(× 400);D 为油红O 染色阳性(×1 000)Fig.5 Pathological changes in mouse liver tissuesNote: A. Normal liver; B. Hepatocellular swelling; C. Liver PAS staining was negative;D. Hepatic steatosis; A, B were HE staining (× 400);C was PAS staining (×400); D was Oil Red-O staining positive (× 1 000)
2.2 大鼠的病理学变化及统计
共取样160只,其中SPF级140只,清洁级20只。有15例脾脏表现为弥漫性白髓细胞减少,髓外造血增加;3例肝脏表现出肝细胞肿胀,经特殊染色确定1例为肝细胞糖原沉积。其余各组织脏器未见明显病理变化。
2.2.1脾脏病变:与正常脾脏相比(图6A),脾脏弥漫性白髓细胞减少,髓外造血增加,红髓与白髓界限不清,白髓显著减少,巨噬细胞呈弥漫性增多(图6B)。

图6 大鼠脾脏组织病变情况注: A.正常脾脏;B.脾脏弥漫性白髓细胞减少,髓外造血增加;A、B为HE染色(×400)Fig.6 Pathological changes of in rats spleens tissuesNote: A. Normal spleen; B. Spleen diffuse white medullary cell decrease and extramedullary hematopoietic increase;A, B were HE staining (×400)
2.2.2肝脏病变:与正常肝脏(图7A)相比, 肝细胞肿胀可见肝小叶结构不清晰,未见明显肝索结构,肝细胞体积变大,胞质中有不同程度的空泡出现(图7B);对肝细胞肿胀的样本进行油红O 染色(图7C)和 PAS染色(图7D) ,显示肝细胞胞浆呈均质淡粉色,其中可见紫红染色的糖原颗粒(图7D) 。
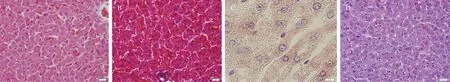
图7 大鼠肝脏组织病变情况注: A. 正常肝脏;B. 肝细胞肿胀;C. 油红O 染色阴性;D. 肝脏PAS染色阳性;A、B为HE染色(×400);C为油红O 染色阴性(×1 000);D为PAS染色阳性(×400);Fig.7 Pathological changes in rats liver tissuesNote: A. Normal liver; B. Hepatocellular swelling; C. Liver Oil red O staining was negative; D. Liver PAS staining was positive;A, B were HE staining (× 400);C was Oil Red-O staining negative (× 1 000);D was PAS staining positive(×400)
2.3 豚鼠的病理学变化及统计
共取样210只,其中SPF级30只,清洁级20只,普通级160只。异常主要集中在普通级豚鼠的肺脏,肝脏和小肠。15例间质性肺炎,其中两只豚鼠同时表现出肝脏胆管上皮增生;13例肝脏细胞胞质中有大小不一的空泡,进行油红O及PAS染色,结果为6例油O染色阳性,2例PAS染色阳性;5例小肠固有层含铁血黄素沉积。在SPF级豚鼠中发现1例肉芽肿性肺炎。其余各组织脏器未见明显病理变化。
2.3.1肺脏病变:与正常肺相比(图8A), 间质性肺炎的肺泡壁局部增宽,增宽区域肺泡结构消失,在增生的区域及支气管、血管周围可见炎性细胞浸润,邻近区域可见局部肺泡代偿性增大(图8B)。肉芽肿性肺炎可见肺脏局部出现增生的区域有大量淋巴细胞,巨噬细胞等炎性细胞浸润,并可见少量的多核巨细胞(图8C,D)。
2.3.2肝脏病变:与正常肝脏(图9A)相比,肝细胞肿胀可见肝小叶结构不清晰,未见明显肝索结构,肝细胞体积变大,胞质中有不同程度的空泡出现(图9B);对肝细胞肿胀的样本进行油红O 染色(图9C)和 PAS染色(图9D),可见胞浆中大小不一的圆形红染脂滴(图9C),肝细胞胞质呈均质淡粉色,其中可见紫红染色的糖原颗粒(图9D)。胆管上皮增生可见肝小叶间及汇管区胆管上皮增生,上皮呈团块状生长,不形成管腔(图9E)。

图9 豚鼠肝脏组织病变情况注: A. 正常肝脏;B. 肝细胞肿胀;C. 油红O 染色阳性;D. 肝脏PAS染色阳性;E. 胆管上皮增生;A、B、E为HE染色(× 400);C为油红O染色阳性(× 1 000);D为PAS染色阳性(× 400)Fig.9 Pathological changes of livers in guinea pigsNote: A. Normal liver; B. Hepatocellular swelling; C. Liver Oil red O staining was positive; D. Liver PAS staining was positive;E. Hyperplasia of bile duct epithelium; A, B, E were HE staining (×400); C was Oil Red-O staining positive (×1 000) ;D was PAS staining positive (×400)
2.3.3肠道病变:与正常小肠(图10A)相比,小肠陈旧性出血可见肠绒毛固有层有数量不等的呈棕红色的含铁血黄素沉积(图10B)。
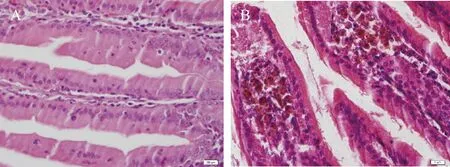
图10 豚鼠肠道组织病变情况注: A.正常十二指肠;B.十二指肠陈旧性出血;A、B为HE染色(×400)Fig.10 Pathological changes in guinea pig intestinal tissuesNote: A. Normal rectal; B. Chronic duodenal hemorrhag (× 400);A, B were HE staining (×400)
2.4 地鼠的病理学变化及统计
共取样清洁级地鼠20只。被检地鼠中可见3例肝细胞肿胀,经特殊染色确定其中1例为糖原沉积,其余各组织脏器未见明显病理变化。地鼠基本合格。
与正常肝脏(图11A)相比,肝细胞肿胀可见肝小叶结构不清晰,未见明显肝索结构,肝细胞体积变大,胞质中有不同程度的空泡出现(图11B);对肝细胞肿胀的样本进行油红O 染色(图11C)和 PAS染色(图11 D),其中可见紫红染色的糖原颗粒(图11D)。

图11 地鼠肝脏组织病变情况注: A.正常肝脏;B. 肝细胞肿胀;C. 油红O 染色阴性;D. 肝脏PAS染色阳性;A、B为HE染色(× 400);C为油红O 染色阴性(×1 000);D为PAS染色阳性(× 400)Fig.11 Pathological changes in hamster liver tissuesNote: A. Normal liver; B. Hepatocellular swelling; C. Liver Oil red O staining was negative; D. Liver PAS staining was positive;A, B was HE staining (× 400); C was Oil Red-O staining negative (×1 000); D was PAS staining positive (× 400)
3 讨论
本次抽查检验北京市啮齿类实验动物的病理变化显示,大多数送检的实验动物基本健康。但来自于不同公司的SPF级小鼠和大鼠的脾脏均表现出弥漫性白髓细胞减少、髓外造血增加;普通级豚鼠普遍表现出间质性肺炎。所有品种及不同级别的鼠肝脏出现个别肿胀、空泡化,但经特殊染色观察,仅有少数为脂肪变性、糖原沉积。其余不同级别鼠的脏器仅个别出现病理变化。如:心外膜炎、心外膜钙化;直肠寄生虫感染;十二指肠慢性增生性肠炎,陈旧性出血;肾脏间质性肾炎。
3.1 肝脏病变分析
在取样小鼠、大鼠、豚鼠、地鼠中均出现个别肝细胞肿胀、空泡化。近10年肝细胞脂肪变性,肝细胞肿胀,炎性反应,坏死比较明显[3-12],但呈现逐年下降趋势[10],说明北京市实验动物质量控制逐渐标准化。2020年啮齿类实验动物肝脏并没有表现出其他病理变化,如炎性反应、坏死、变性等,排除了肝脏毒性损伤。进行特殊染色处理,仅有极少数为脂肪变性、糖原沉积,可能造成的原因为:①运输、处死过程中的应激以及部分组织脏器的自溶;②与饲料、饲喂管理方式(饮食、维生素A过量等)以及动物个体差异有关,导致肝脏出现营养紊乱[13]。因此,在实验动物的繁育过程中,饲料应选用优质的原料、合理恒定的配方及适宜的灭菌方法,动物饮水也应使用灭菌的自来水[14]。
3.2 脾脏病变分析
分别来自不同单位的34例SPF级小鼠和大鼠脾脏表现出弥漫性白髓细胞减少、髓外造血增加。白髓细胞数量减少可能是由于衰老、应激、营养不良、毒素、自身免疫、放射、感染或其他部位的肿瘤引起的。可能是因为被检测鼠长期接触某些毒物或者病原微生物(细菌或病毒)引起脾脏滤泡萎缩,滤泡内淋巴细胞凋亡、坏死,淋巴细胞生成减少。随着时间推移,生发中心和滤泡消失,最终导致脾脏全部淋巴组织数量减少。这些因素还会引起脾脏红髓巨噬细胞增多,髓外造血增加。实验动物繁育公司可以排查饲料、垫料中是否有毒素的存在。
3.3 肺脏病变分析
普通级豚鼠肺脏普遍表现为间质性肺炎,其中2例同时表现出肝脏胆管上皮增生,可能与寄生虫感染或者其他刺激因素有关。肺脏病变可能与垫料质量不达标或饲养密度过大有关,劣质的垫料碎屑及尘埃较多,极易造成异物刺激引发动物肺部炎症;饲养密度过大、温湿度不适、通风不良和饲养员清理不及时,室内臭味和氨浓度升高容易诱发气管炎、肺炎等。因而,在实验动物的饲养过程中需要注意饲养环境的空气情况、饲养密度以及通风情况等。选用符合标准的垫料,尽量减少室内垫料碎屑、臭味和氨味等对动物呼吸道的刺激。
3.4 其余脏器病变分析
其余脏器(如心脏、肾脏、大肠、小肠)仅有1例或极少数出现病变。SPF级小鼠大肠出现寄生虫感染,说明饲养环境需要进一步检查完善。其他脏器的病变可能与饲料、饲喂管理方式以及动物个体差异有关。另外,运输、处死过程中的应激以及部分组织脏器的自溶可能对病理学检查结果都会产生一定影响。
基于以上结果认为,虽然大多数送检实验动物基本健康,但啮齿类不同级别实验动物的不同脏器出现不同程度的组织病理学损伤。虽然有的啮齿类实验动物符合国家微生物学等标准,但仍有部分实验动物处于亚健康状态。因此,病理学监测在实验动物质量评价中有着不可替代的重要作用。通过病理学监测实验动物的健康状况对于更好地保障实验动物的福利和保证科学研究结果的可靠性和准确性具有重要的意义。
