富氢液对脓毒症小鼠心肌细胞线粒体自噬的影响
2022-08-03侯凯耀张二飞郑李娜陈红光谢克亮
侯凯耀, 张二飞, 郑李娜, 陈红光, 谢克亮
1.延安大学医学院,陕西 延安 716000;
2.延安大学附属医院麻醉科,陕西 延安 716000;
3.山西省人民医院麻醉科,太原 030012;
4.天津医科大学总医院麻醉科,天津 300052;
5.天津医科大学总医院重症医学科,天津 300052
脓毒症是由于微生物感染导致免疫系统过度激活,从而导致炎症相关损伤的疾病,脓毒症是全球十大最常见的死亡原因,该病引起的心肌损伤被称为脓毒症心肌病,也是感染患者最常见的死亡原因。脓毒症的早期治疗可改善患者预后,降低死亡率[1]。研究表明,脓毒症引起的心功能障碍在脓毒症中的发生率达40%,脓毒症并发心功能障碍死亡率可达70%~90%[2]。脓毒症诱导的心肌细胞线粒体氧化应激是心肌损伤的主要原因[3]。脓毒症中心肌细胞线粒体超微结构损伤(线粒体肿胀和线粒体嵴丢失)和功能障碍[线粒体膜电位(mitochondrial membrane potential,MMP)下降和ATP产生减少],最终引起心肌功能障碍[4]。目前,通过减轻脓毒症心肌线粒体损伤改善心肌损伤的相关研究较少,且机制尚不清楚。有研究证实,通过诱导心肌细胞线粒体自噬可改善心肌细胞线粒体功能障碍和心肌损伤、防止心肌缺血再灌注损伤引起的心功能衰竭[5]。脓毒症引起的心肌线粒体损伤和线粒体功能障碍是心肌损伤和心功能障碍的关键因素。线粒体自噬被证实是改善线粒体损伤、提高线粒体功能的有效途径,但靶向调控线粒体自噬改善脓毒性心肌线粒体损伤的研究鲜有报道。
研究发现,氢可通过抗炎、抗氧化发挥对损伤器官的保护作用,低浓度氢气具有脓毒症保护作用[6],可减轻肺、脑、肝等器官的损伤[7-8]。近年来,氢的医学应用一直是科学家们研究的重点之一,氢的医学应用的另一表现形式是以富氢液来实现的,而富氢液能否诱导心肌线粒体自噬从而改善脓毒症引起的心肌损伤和心功能障碍尚未见报道。基于此,本研究旨在评价腹腔注射富氢液对脓毒症小鼠心肌细胞线粒体自噬的调控及心功能障碍的治疗作用,以期为富氢液的医学应用奠定理论基础。
1 材料与方法
1.1 材料
选取72只雄性C57BL/6J小鼠作为研究对象,6~8周龄,体质量20~25 g,均购自中国北京军事医学科学院实验动物中心[动物合格证号:SCXK(京)-0008]。采用随机数字表法分为4组:假手术组(Sham组)、假手术+富氢液组(Sham+HRS组)、脓毒症组(CLP组)、脓毒症+富氢液组(CLP+HRS组)。本实验经延安大学医学院实验动物管理委员会批准,实验过程遵守伦理学规定。
1.2 方法
1.2.1 盲肠结扎穿孔(cecal ligation perforation,CLP)制备脓毒症模型制备 实验前动物禁食,自由饮水。采用盲肠结扎穿孔法[6]建立小鼠脓毒症模型。小鼠吸入2%七氟烷(恒瑞医药,国药准字H20070172)进行麻醉。在无菌手术环境下,沿腹中线切开腹壁约1 cm进入腹腔,无菌镊探查到盲肠后用手术缝线在回盲瓣下方距离盲肠根部约1.5 cm处用5号无菌丝线结扎盲肠,距离盲肠根部约1 cm处用22 G针头穿透,并挤出少许粪便,将盲肠和挤出物共同还纳腹腔,用无菌6-0丝线逐层缝合腹壁切口。Sham组和Sham+HRS组仅进行开腹及盲肠游离。手术结束后每只动物皮下注射0.9% NaCl溶液(50 kg·mL-1)。于术后6 h开始皮下注射抗生素[美罗培南,石药集团中诺药业(石家庄)有限公司,国药准字H20065253]25 mg·kg-1,1次·d-1,连续注射3 d。
1.2.2 富氢液制备 参考相关文献[9]的方法,在高压(0.4 MPa)下,使用GCH-300高纯氢气发生器(天津同普分析仪器科技有限公司)产生氢气。将氢气(纯度>99.9999%)在0.9% NaCl溶液中溶解4 h达到饱和状态,常压4℃储存备用,γ射线消毒灭菌。富氢液均为新鲜制备使用,氢浓度为0.6 mmol·L-1。于造模后1、6 h时,Sham+HRS组和CLP+HRS组小鼠腹腔注射富氢液10 mL·kg-1。Sham组和CLP组小鼠腹腔注射等容量0.9% NaCl溶液。
1.2.3 炎症因子和心肌酶测定 造模后24 h,各组随机取6只小鼠,吸入2%七氟烷进行麻醉,收集小鼠颈动脉血样,在25℃下静置凝结30 min。在1 500 r·min-1,4 ℃下离心15 min,取上清,-80 ℃保存待生化测定。采用ELISA试剂盒(美国R&D Systems公司)测定血清炎症因子肿瘤坏死因子α(tumor necrosis factor-alpha,TNF-α)、白细胞介素1β(interleukin-1β,IL-1β)水平,采用ELISA试剂盒(江苏南京建成生物公司)测定肌钙蛋白I(cardiac troponin I,cTnI)和肌酸激酶同工酶(creatine kinase MB,CK-MB)。
1.2.4 线粒体膜电位和ATP测定 造模后24 h,各组随机取6只小鼠,吸入2%七氟烷进行麻醉,取左室心肌组织。按照组织线粒体分离试剂盒(上海碧云天生物技术有限公司)说明书分离线粒体。按照10 mL·g-1组织的用量加入线粒体分离介质A,在预冷的玻璃匀浆器中充分匀浆10次,4℃下1 000 r·min-1离心5 min,取上清液,4℃下3 500 r·min-1,离心10 min,弃上清,沉淀即为粗制线粒体。加入保存介质约400µL·g-1。采用考马斯亮蓝法测定蛋白浓度[10]。采用荧光分光光度法检测线粒体膜电位[11]。将线粒体加入0.9 mL JC-1染色工作液,混匀后使用EnSpire多功能酶标仪(美国PerkinElmer公司)测定绿色荧光强度(激发波长490 nm,发射波长530 nm)和红色荧光强度(激发波长525 nm,发射波长590 nm),计算红色荧光与绿色荧光强度的比值即为MMP。参照ATP检测试剂盒(上海碧云天生物技术有限公司)说明书采用荧光素-荧光酶发光法进行检测。按照10 mL·g-1组织的用量加入ATP检测裂解液,在预冷的玻璃匀浆器中充分匀浆10次,4℃下10 000 r·min-1离心5 min,取上清。在检测孔中加入20µL组织样本,混匀后使用EnSpire多功能酶标仪(美国PerkinElmer公司)测定相对光单位值,根据标准曲线计算ATP含量。
1.2.5 线粒体自噬相关蛋白测定 采用Western blot法测定心肌组织线粒体自噬LC3Ⅰ/Ⅱ和P62的表达。造模后24 h,各组随机取6只小鼠,吸入2%七氟烷进行麻醉,分离左室心肌组织称重,加入预冷的PBS缓冲液和蛋白酶抑制剂,采用JY96-II超声波细胞粉碎机(宁波新芝生物科技有限公司)裂解匀浆5 min,4 ℃下14 000 r·min-1离心10 min,离心半径10 cm,取上清,二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量后加入蛋白上样缓冲液,煮沸变性,-80℃保存。经电泳分离蛋白、转膜、脱脂牛奶封闭,加入LC3Ⅰ/Ⅱ和P62一抗(1∶800,英国Abcam公司),4℃孵育过夜。次日TBST洗膜5次,每次5 min,加入相应二抗室温孵育1 h。洗膜缓冲液(Tris-buffered saline tween,TBST)洗膜5次,每次5 min;避光加入电化学发光(electrochemical luminescence,ECL)超敏发光液,机器曝光。采用Image J软件分析条带灰度值,以目的蛋白条带的灰度值与对应内参磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GAPDH)条带灰度值的比值反映目的蛋白的表达水平。
1.3 统计学分析
采用SPSS 19.0软件进行数据分析,符合正态分布的计量资料以(±s)表示,多组间比较采用单因素方差分析,两两比较采用独立样本t检验,以P<0.05为差异有统计学意义。
2 结果与分析
2.1 富氢液对脓毒症小鼠心肌损伤炎症因子和心肌损伤指标的影响
由表1可知,术后24 h,4组小鼠TNF-α、IL-1β、cTnI、CK-MB水平比较差异均有统计学意义(P<0.05);Sham组和Sham+HRS组血清TNF-α、IL-1β、cTnI和CK-MB水平比较差异无统计学意义(P>0.05);与Sham组比较,CLP组和CLP+HRS组血清TNF-α、IL-1β、cTnI、CK-MB水平均显著升高(P<0.05);与CLP组比较,CLP+HRS组血清TNF-α、IL-1β、cTnI、CK-MB 水平均显著降低(P<0.05)。以上结果表明,富氢液可以抑制脓毒症小鼠的炎症因子的过度表达,缓解心肌损伤。
表1 4组小鼠血清TNF-α、IL-1β、cTnI和CK-MB水平比较(±s)Table 1 Comparison of serum TNF-α,IL-1β,cTnI and CK-MB levels among four groups of mice(±s)
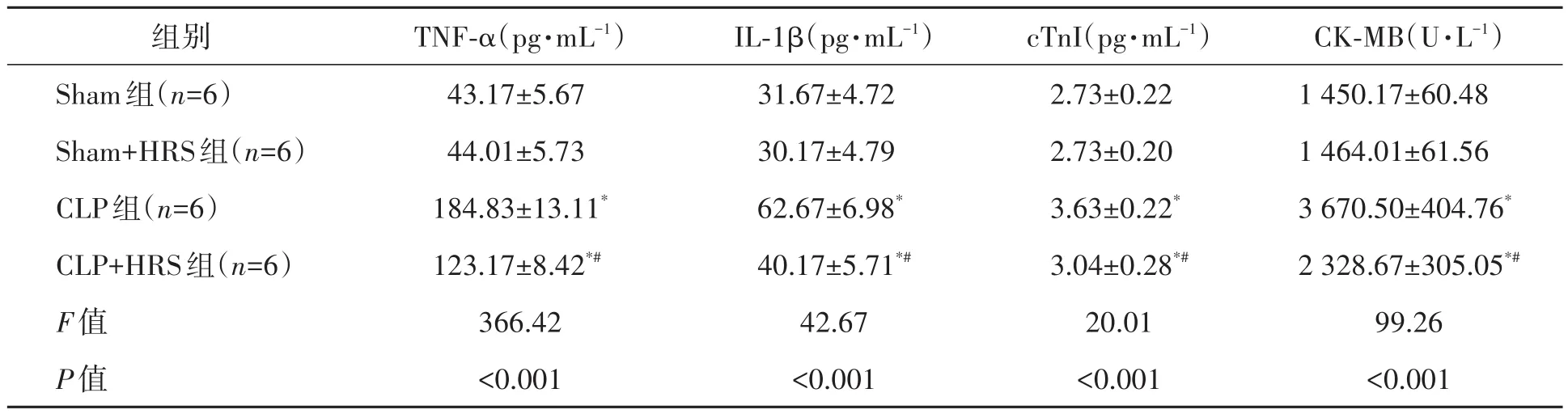
表1 4组小鼠血清TNF-α、IL-1β、cTnI和CK-MB水平比较(±s)Table 1 Comparison of serum TNF-α,IL-1β,cTnI and CK-MB levels among four groups of mice(±s)
注:TNF-α—肿瘤坏死因子-α;IL-1β—白细胞介素-1β;cTnI—肌钙蛋白I;CK-MB—肌酸激酶同工酶。*表示与Sham组比较,差异在P<0.05水平有统计学意义;#表示与CLP组比较,差异在P<0.05水平有统计学意义。
CK-MB(U·L-1)1 450.17±60.48 1 464.01±61.56 3 670.50±404.76*2 328.67±305.05*#99.26<0.001组别Sham组(n=6)Sham+HRS组(n=6)CLP组(n=6)CLP+HRS组(n=6)F值P值TNF-α(pg·mL-1)43.17±5.67 44.01±5.73 184.83±13.11*123.17±8.42*#366.42<0.001 IL-1β(pg·mL-1)31.67±4.72 30.17±4.79 62.67±6.98*40.17±5.71*#42.67<0.001 cTnI(pg·mL-1)2.73±0.22 2.73±0.20 3.63±0.22*3.04±0.28*#20.01<0.001
2.2 富氢液对脓毒症小鼠心肌损伤线粒体ATP含量和MMP的影响
由表2可知,术后24 h,4组心肌线粒体ATP含量和MMP比较差异均有统计学意义(P<0.05);Sham组和Sham+HRS组心肌线粒体ATP含量和MMP比较差异无统计学意义(P>0.05);与Sham组比较,CLP组和CLP+HRS组心肌线粒体ATP含量和MMP比较均显著降低(P<0.05);与CLP组比较,CLP+HRS组心肌线粒体ATP含量和MMP均显著升高(P<0.05)。以上结果表明,富氢液可以通过增加脓毒症心肌损伤线粒体ATP含量和改善MMP来提高线粒体功能。
表2 4组小鼠心肌组织MMP和ATP含量比较(±s)Table 2 Comparison of MMP and ATP contents in myocardial tissue among four groups of mice(±s)
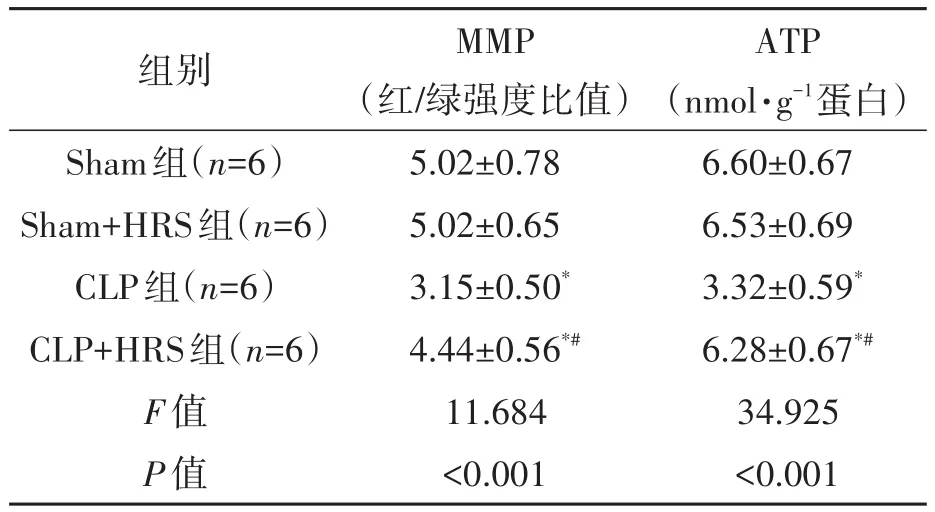
表2 4组小鼠心肌组织MMP和ATP含量比较(±s)Table 2 Comparison of MMP and ATP contents in myocardial tissue among four groups of mice(±s)
注:MMP—线粒体膜电位;ATP—三磷酸腺苷。*表示与Sham组比较,差异在P<0.05水平有统计学意义;#表示与CLP组比较,差异在P<0.05水平有统计学意义。
ATP(nmol·g-1蛋白)6.60±0.67 6.53±0.69 3.32±0.59*6.28±0.67*#34.925<0.001组别Sham组(n=6)Sham+HRS组(n=6)CLP组(n=6)CLP+HRS组(n=6)F值P值MMP(红/绿强度比值)5.02±0.78 5.02±0.65 3.15±0.50*4.44±0.56*#11.684<0.001
2.3 富氢液对脓毒症小鼠心肌组织线粒体自噬的影响
由表3可知,4组LC3Ⅱ/LC3Ⅰ、P62/GAPDH表达水平比较差异有统计学意义(P<0.05);Sham组与Sham+HRS组LC3Ⅱ/LC3Ⅰ、P62/GAPDH表达水平差异无统计学意义(P>0.05);与Sham组比较,CLP组和CLP+HRS组LC3Ⅱ/LC3Ⅰ表达水平显著升高(P<0.05),P62达水平表达显著降低(P<0.05);与CLP组比较,CLP+HRS组LC3Ⅱ/LC3Ⅰ表达水平进一步增加(P<0.05),P62表达水平进一步降低(P<0.05)。结果表明,富氢液可以增加线粒体自噬的发生,可能与受损线粒体的更新和循环有关。
表3 4组小鼠心肌组织LC3Ⅱ/LC3Ⅰ和P62表达水平比较(±s)Table 3 Comparison of LC3Ⅱ/LC3Ⅰ and P62 expression levels in myocardial tissues among four groups of mice(±s)

表3 4组小鼠心肌组织LC3Ⅱ/LC3Ⅰ和P62表达水平比较(±s)Table 3 Comparison of LC3Ⅱ/LC3Ⅰ and P62 expression levels in myocardial tissues among four groups of mice(±s)
注:LC3Ⅱ/LC3Ⅰ—微管关联蛋白轻链3Ⅱ/Ⅰ;P62—蛋白62;GAPDH—内参蛋白。*表示与Sham组比较,差异在P<0.05水平有统计学意义;#表示与CLP组比较,差异在P<0.05水平有统计学意义。
P62/GAPDH 0.75±0.12 0.74±0.13 0.56±0.10*0.31±0.06*#31.310<0.001组别Sham组(n=6)Sham+HRS组(n=6)CLP组(n=6)CLP+HRS组(n=6)F值P值LC3Ⅱ/LC3Ⅰ1.00±0.14 0.98±0.13 1.45±0.22*1.87±0.29*#25.430<0.001
3 讨论
脓毒症性心肌病的发病机制包括氧化应激、钙失衡、线粒体功能障碍、内质网应激、自噬抑制、程序性细胞死亡激活、免疫紊乱等[12]。有研究报道,脂多糖诱导的脓毒症心功能障碍与线粒体生物合成功能不全相关。过度的线粒体裂变会促进线粒体损伤,减少线粒体ATP的合成,通过线粒体依赖的凋亡途径导致心肌细胞死亡,从而导致心脏功能下降[13]。因此,线粒体功能障碍可能是脓毒症性心肌病潜在的分子机制[14]。氢具有在细胞水平上起作用的能力,H2可穿过血脑屏障,进入线粒体,甚至在一定条件下还具有转运到细胞核的能力。近年来,氢的生物学效应已在170多种疾病模型和人类疾病中得到证实[15],包括缺血/再灌注损伤、代谢综合征、炎症、癌症、脑损伤和败血症[16-21]。但目前H2治疗疾病的机制尚未完全明确,其可能的机制包括抗炎、抗氧化、抗凋亡、保护线粒体、保护内质网、调节免疫细胞亚型和信号通路等。
心肌细胞线粒体功能障碍在脓毒性心肌病病理过程中起着十分重要的作用,线粒体功能受损导致细胞ATP储存的消耗,细胞ATP储存对于维持心肌组织的完整性和预防心肌细胞损伤至关重要,线粒体损伤发生线粒体裂变导致心肌细胞中的线粒体断裂和跨膜电位去极化,并导致线粒体功能障碍[15]。本研究结果表明,脓毒症会导致心肌细胞线粒体的ATP含量降低和MMP下降,而给予富氢液处理后,心肌线粒体ATP含量和MMP增加,说明富氢液可能改善了线粒体的功能进而降低了脓毒症心肌损伤。由于功能失调的线粒体可以通过自噬分离和消除,这一过程称为线粒体自噬。线粒体自噬是参与修复受损线粒体的主要应激反应和保护机制之一,在严重或慢性压力下,过度或不足的自噬会导致大量的自我降解或有毒物质的积累,两者均是不适应的,并最终引发细胞死亡[22-23]。LC3Ⅰ向LC3Ⅱ转化的过程是自噬的进行过程,LC3Ⅰ向LC3Ⅱ转化的减少或LC3Ⅰ水平的增加是自噬水平降低的特征;相反,当自噬增加时,会发现更高水平的LC3Ⅱ蛋白,而LC3Ⅱ/LC3Ⅰ比值的升高被认为是自噬的标志;另一个广泛使用的自噬标记物是P62,其是作为一个适配器分子,自噬受体P62是细胞解毒、应激反应和代谢过程的关键介质[19]。
本课题组前期的研究证实了H2可以减轻脓毒症脑细胞的线粒体功能障碍[24],富氢液可以减轻LPS导致的巨噬细胞的线粒体功能障碍[25]。而对于线粒体功能障碍的调控方式之一的线粒体自噬,已有的研究也表明,富氢生理盐水可通过PTEN诱发的假定激酶1(PTEN-induced putative kinase 1,PINK)介导的自噬减轻心肌I/R损伤中的炎症和细胞凋亡[24]。在心肌蛋白水平上,本研究发现,与正常组相比,脓毒症组LC3表达增加,P62表达降低。脓毒症导致自噬增加,考虑是应激导致自噬增加,与已有研究结果一致[26-27],脓毒症导致的急性肺损伤出现自噬增加。给予富氢液后的结果显示,与脓毒症组相比,给予富氢液治疗的脓毒症小鼠,P62水平进一步降低,腹腔注射富氢液后脓毒症小鼠心肌LC3Ⅱ蛋白水平进一步增加,LC3Ⅰ蛋白水平降低,提示富氢液可通过促进脓毒性心肌细胞的线粒体自噬作用改善心肌线粒体功能。与本课题组前期的结果一致[28],富氢液能够使LPS导致的急性肺损伤和巨噬细胞自噬进一步增加,发挥对受损线粒体清除再循环利用的作用。
综上所述,富氢液改善小鼠脓毒症心功能障碍的机制可能与调节心肌细胞线粒体自噬、改善心肌线粒体功能相关。但是本研究也存在不足,自噬干预后,富氢液的治疗效果和机制还有待进一步验证。本研究结果为H2治疗脓毒症提供了新的理论依据。
