云南油茶炭疽病菌的鉴定及生防菌筛选
2022-08-02陈健鑫魏玉倩张东华马焕成伍建榕
陈健鑫,魏玉倩,刘 丽,张东华,马焕成,伍建榕,
(1 云南省高校森林灾害预警控制重点实验室/西南林业大学 生物多样性保护学院, 云南 昆明 650224; 2 西南地区生物多样性保育国家林业局重点实验室/西南林业大学 林学院, 云南 昆明 650224)
油茶Camellia oleifera是一种重要的油料作物,在我国有长远的种植和栽培历史,被广泛地栽植于我国14个省(区),具有重要的经济价值。其种子含油率高,富含不饱和脂肪酸以及多酚、黄酮、原花青素等活性物质,是一种高质量、耐储存的健康食用油[1-2];其活性化合物能调节血脂水平,降低脑血管疾病的发生。此外,油茶及其副产品是多种工业制品的原材料,其发酵物可制备绿色无公害农药[3-4]。
单一品种油茶的集约化栽植、良种选育滞后及栽培管护技术落后均导致油茶病虫害发生严重,其中炭疽病的发生严重制约着云南省油茶产业的发展[5]。炭疽病菌Colletotrichumspp.能侵染油茶幼嫩的器官,侵染初期组织表面出现较小的褐色斑点,随后出现轮纹状枯斑,后期病斑上着生轮状排列的黑色点状物(分生孢子盘),空气湿度大时病斑处可见分生孢子堆,严重时出现叶片早落、枝梢枯死及果皮开裂早落的症状[6-7]。前期研究认为油茶炭疽病的病原菌为胶孢炭疽菌C.gloeosporioides,随着病原学与分子生物学的深入研究,研究者们认为引起油茶炭疽病的病原存在多个种类[8-9]。
几乎所有高等植物的多种组织中都普遍存在内生菌,内生菌在促进植物生长与提高植物抗逆性等方面具有重要的意义[10]。芽孢杆菌Bacillus和链霉菌Streptomyces是报道最多的2类有益内生菌,均能显著抑制植物病原菌,同时能够减少因化学农药过度使用带来的负面生态影响[11-12]。植物内生菌及其次生代谢产物在农林业有害生物控制和植物病害管理中具有较好的应用潜力。
本研究对云南省德宏州、文山州及保山市油茶种植区炭疽病的发生情况进行调查,联合形态学特征和多位点序列分析明确病原菌的种类,通过柯赫氏法则测定菌株对油茶的致病性,并通过分离健康油茶叶片内生菌筛选出具有拮抗效果的菌株,以期为油茶炭疽病的绿色防控提供理论依据。
1 材料与方法
1.1 材料
2019和2020年7 —9月,在云南省德宏州、文山州及保山市油茶种植基地收集表现出典型炭疽病症状的病叶和健康油茶叶片,用自封袋保存带回实验室。
马铃薯琼脂固体培养基(PDA):马铃薯200 g,葡萄糖 20 g,琼脂粉 20 g,蒸馏水 1 000 mL,pH=7.0;水酵母固体培养基(TWYE):酵母提取物0.25 g,K2HPO4·7H2O 0.5 g,琼脂粉 20 g,蒸馏水 1 000 mL,pH=7.2;牛肉膏蛋白胨固体培养基(LB):胰蛋白胨 10 g,酵母提取物 5 g,NaCl 10 g,琼脂粉 20 g,蒸馏水 1 000 mL,pH=7.0。
1.2 油茶炭疽病病害调查
2019和2020 年的7—9月份对云南省德宏州、文山州和保山市的栽培油茶各进行3次炭疽病病害调查,每个地区调查3个主要种植区,各样区按五点采样法随机抽取30株油茶,每株油茶在4个方向各抽查30片叶片计算发病率,同时参考杨光道[13]制定的分级标准(表1)计算病情指数。

表1 油茶炭疽病的分级标准Table 1 Rated scale for disease severity of Camellia oleifera anthrax
1.3 油茶炭疽病菌的分离及形态学鉴定
参照秦绍钊等[6]的方法,采用常规组织分离法分离病原菌。剪取染病叶片病健交界处组织,经表面消毒后接种于PDA培养基平板,待菌丝生长后重复纯化3~5次,得到的纯菌株用PDA试管斜面于4 ℃条件下保存备用。
采用玻片培养检视法观察油茶炭疽菌的形态特征。盖玻片灭菌后斜插入培养基平板,供试菌接种于斜插片附近,倒置培养7~10 d后拔出盖玻片,使用光学显微镜(尼康,上海)观察其形态特征。
采用徒手切片法观察染病部位炭疽菌的形态特征。将病症明显的病叶切成较薄的组织片并制成临时玻片标本,通过光学显微镜观察病原菌的形态学特征。
1.4 油茶炭疽病菌的致病性测定
参照秦绍钊等[6]的方法,采用活体植物接种法验证病原真菌致病性。病原菌活化培养后用5 mL无菌水充分洗涤分生孢子,调节其终浓度为1×106mL-1。健康油茶叶片用φ为75%乙醇轻轻擦拭表面并自然风干,接种针灼烧后在叶片表面轻轻刺出伤口,吸取20 μL孢子悬浮液接种至叶片伤口处,空白对照接种无菌水,5次重复,25 ℃条件下保湿培养10 d,每天观察并测量叶片的病斑面积,进行数据统计分析。
1.5 油茶炭疽病菌的分子鉴定
采用基因组DNA提取试剂盒(生工,上海)提取病原菌总DNA,提取后保存于-20 ℃冰箱备用。以真菌总DNA为模板扩增ITS片段、ACT、TUB2、CHS-1、GAPDH和HIS3基因[9],所用引物见表2。炭疽菌ITS片段的PCR反应条件:94 ℃预变性5 min后;94 ℃ 变性 30 s,56 ℃ 退火 40 s,72 ℃ 延伸 50 s,循环35次;最后72 ℃延伸10 min。其余基因片段的反应条件:94 ℃ 预变性 5 min 后;94 ℃ 变性 30 s,52 ℃ 退火 30 s,72 ℃ 延伸 30 s,循环 35 次;最后 72 ℃延伸10 min。PCR产物切胶纯化后送昆明硕擎生物科技有限公司测序,利用DNAMAN 8将双向测通的序列拼接并提交到NCBI数据库比对,利用MEGA 6中最大简约法(Maximum-parsimony,MP)同时通过RAxML-HPC2的最大似然法(Maximum-likelihood,ML)以1 000 进行 Bootstrap校验,构建真菌系统发育树。

表2 本研究采用的引物Table 2 Primers used in this study
1.6 油茶叶片内生拮抗菌的分离及形态鉴定
将健康油茶的叶片用流水冲洗20 min后,用超声波(45 kHz)清洗10 min去除表面灰尘及附着物,然后进行常规表面消毒,吸取100 μL最后一次清洗叶片的无菌水涂布于LB培养基平板,以此检验表面消毒是否彻底。取1.0 g表面消毒后的叶片用9 mL无菌水充分研磨至匀浆状,静止10 min后吸取上清液进行梯度稀释,吸取100 μL各浓度梯度的悬浮液分别涂布于TWYE培养基平板(添加制霉菌素 25 mg/L,K2Cr2O725 mg/L 和萘啶酮酸 25 mg/L)放置吸收1 h后,28 ℃条件下倒置培养5~7 d,同时涂布于LB培养基平板,放置吸收后,37 ℃条件下倒置过夜培养,单菌落经3~5次纯化后接种于对应试管斜面4 ℃冰箱保存备用。
采用玻片检视法观察内生放线菌的形态特征,通过革兰染色法鉴定细菌类型并观察其形态特征。
1.7 油茶叶片内生拮抗菌的筛选
采用平板对峙法测定内生菌的抑菌效果。将供试病原菌及内生菌菌株活化培养,调节供试内生菌悬浮液为 1×104cfu/mL,用 6 mm 打孔器制取炭疽病菌菌丝块并接种于PDA平板的中央,在距中央2.5 cm的两侧沾取内生菌悬浮液轻划2条细线,静置 10 min 后于 28 ℃ 条件下倒置培养 5 d,测量菌丝直径、计算抑菌率。
1.8 油茶叶片内生拮抗菌的分子鉴定
采用基因组DNA提取试剂盒(生工,上海)提取内生菌总DNA,提取后保存于-20 ℃条件下备用。以细菌总DNA为模板扩增内生细菌的16S rRNA基因,PCR反应条件:94 ℃预变性5 min后;95 ℃ 变性 30 s,55 ℃ 退火 1 min,72 ℃ 延伸 2 min,循环 35 次;最后 72 ℃ 延伸 10 min。双向测通的序列拼接并提交到EzBioCloud数据库进行比对,利用邻接法 (Neighbor jointing,NJ)以 1 000 进行Bootstrap校验,构建细菌系统发育树。
2 结果与分析
2.1 油茶炭疽病病害调查
对3个地区油茶栽培地进行病害调查的结果表明,人工栽植油茶炭疽病发生严重,幼嫩的叶片、枝条和果实症状明显,病斑灰白色至褐色,表面轮生黑色点状物,发病严重时叶片大面积枯死并早落;染病的小枝出现椭圆形病斑,后期病斑开裂,绕枝延伸1周后枝条枯死脱落;染病幼果初期产生圆形病斑,随后病斑延伸并产生轮状黑色点状物,后期果皮开裂,果实早落(图1)。定点调查结果表明,德宏州的油茶炭疽病发生较为严重,平均发病率为56.18%,病情指数为53.11,文山州油茶炭疽病病情较轻,平均发病率为43.99%,病情指数为42.01,保山地区油茶炭疽病平均发病率为53.65%,病情指数为47.19(表3)。

图1 油茶炭疽病症状表现Fig.1 Symptoms of Camellia oleifera anthrax

表3 云南省3个地区油茶炭疽病病害调查结果1)Table 3 Investigation results of Camellia oleifera anthrax in three areas of Yunnan Province
2.2 油茶炭疽病菌的分离及形态鉴定
从油茶染病叶片上共分离得到82株真菌,通过菌落形态及玻片检视初步鉴定出11株炭疽菌。菌株 CA01、CA02、CA07、CA11、CA13和 CA14的形态学特征如图2所示,在PDA培养基上,菌丝初期为白色,后逐渐加深为墨绿色,绒毛状,边缘整齐,气生菌丝较发达,绒毛状。分生孢子单孢,无色,长椭圆形,具 1~2个油球,13.5~15.5 μm×4.5~5.9 μm。光镜下可见少量附着胞,浅棕色,球形、棒形至不规则形,8.2~9.5 μm×5.5~6.3 μm,结合王玉春[5]的描述,初步确定上述6株菌属于胶孢炭疽菌复合种 (C.gloeosporioidescomplex)。
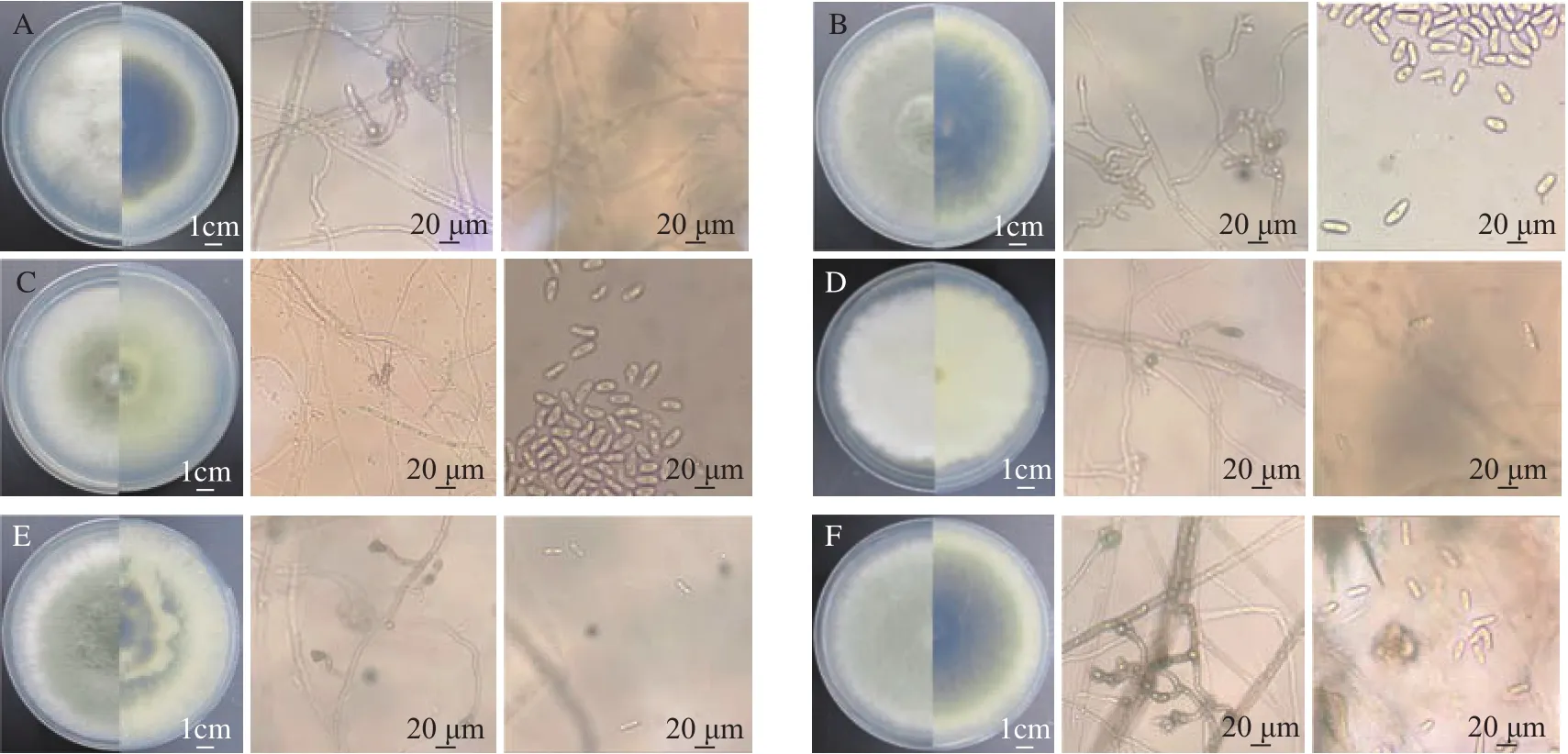
图2 胶孢炭疽菌复合种各菌株在PDA培养基上的形态学特征Fig.2 Morphological characteristics of Colletotrichum gloeosporioides complex strains on the PDA medium
由图3A可见,在PDA培养基上,菌株CA17菌落初期为白色,后期变为浅墨绿色,背面乳白色至浅黄色,有气生菌丝,绒毛状,边缘整齐。分生孢子单胞,无色,纺锤形质长椭圆状,两端钝圆,中心常可见明显的油滴,14.2~16.5 μm×4.9~5.1 μm。光镜下可见附着胞,卵圆形至不规则状,褐色至黑褐色,结合王玉春[5]的描述,菌株CA17可鉴定为暹罗炭疽菌C.siamense,属于C.gloeosporioidescomplex。
由图3B可见,在PDA培养基上,菌株CA21菌落初期白色,后期气生菌丝发达,毯状,出现鲜艳的橘红色至粉红色,菌落背面橘红色至粉色,菌落表面可见橘色分生孢子堆,分生孢子单孢,无色,纺锤形至卵圆形,光滑,11.2~15.5 μm×3.1~5.2 μm。光镜下可见有隔菌丝,未见附着胞形成,结合王玉春[5]的描述,菌株CA21可鉴定为C.fioriniae,属于尖胞炭疽菌复合种 (C.acutatumcomplex)。
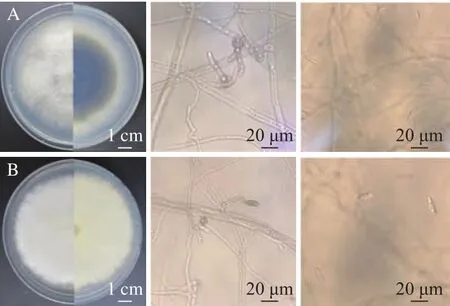
图3 暹罗炭疽菌与松针炭疽菌菌株在PDA培养基上的形态学特征Fig.3 Morphological characteristics of Colletotrichum siamense and C.fioriniae on the PDA medium
在PDA培养基上,菌株CA05、CA09和CA23菌落初期白色,后加深至墨绿色,略呈同心轮纹状,气生菌丝较发达,致密的毯状,中央略凸起,菌落背面浅橘色。分生孢子单孢,透明,纺锤形,11.2~18.8 μm×3.3~5.5 μm。光镜下未见附着胞,可见菌丝常纠结和缠绕形成较复杂的结构(图4),结合王玉春[5]的描述,上述3株菌可鉴定为博宁炭疽菌复合种 (C.boninesecomplex)中的C.karstii。

图4 喀斯特炭疽菌菌株在PDA培养基上的形态学特征Fig.4 Morphological characteristics of Colletotrichum karstii on the PDA medium
通过徒手切片观察染病叶片病斑处的显微结构,可见病斑处的叶片组织褐色,易碎,病原菌分生孢子盘暗褐色,半埋生于叶片组织内,周围有刚毛或无刚毛,刚毛暗色,分生孢子着生在分生孢子梗上,分生孢子无色,单胞,长椭圆形或短棒形 (图5)。
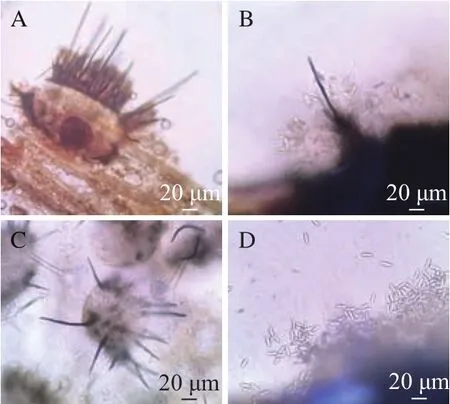
图5 染病部位炭疽菌的形态特征Fig.5 Morphological characteristics of Colletotrichum on the lesion
2.3 油茶炭疽病菌的致病性测定
活体油茶接种病原菌保湿培养10 d后结果表明,各炭疽菌对油茶叶片均有致病性,但致病力存在差异。接种后的3 d油茶叶片开始表现症状,出现水渍状圆形病斑,5 d后病斑面积扩大且颜色变深。菌株 CA01 (图6A),CA09 (图6E),CA11 (图6F)和CA14 (图6H)病斑较小,扩展较慢,致病力较弱,接种10 d后测量病斑,结果表明菌株CA17 (图6I)对油茶的致病力较强,叶片病斑最大,且与其他菌株差异显著(图7)。

图6 炭疽菌致病性验证Fig.6 Pathogenicity assay of Colletotrichum
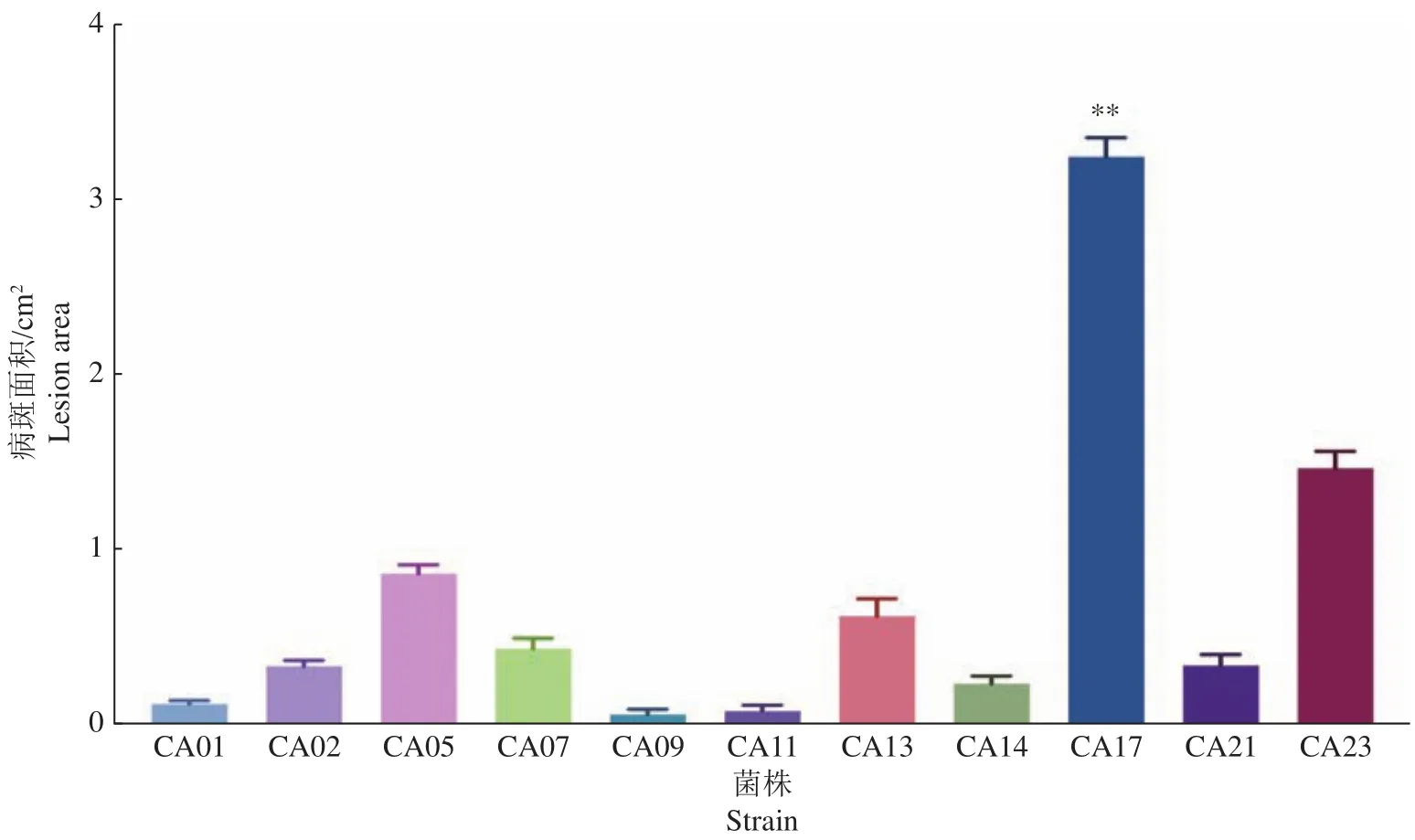
图7 接种炭疽菌菌株10 d后的病斑面积Fig.7 Lesion area for 10 days after inoculation with Colletotrichum
2.4 油茶炭疽病菌的分子鉴定
以病原菌总DNA为模板分别扩增ITS序列(700 bp)、ACT(300 bp)、TUB2(500 bp)、CHS-1(300 bp)、GAPDH(300 bp)和HIS3(450 bp)基因片段,基于多基因片段串联序列构建的油茶炭疽病菌系统发育树 (图8)结果表明,CA01、CA02、CA07、CA11、CA13、CA14和CA17并在胶孢炭疽菌复合种的进化支内且支持率较高,结合形态学特征将菌株 CA01、CA02、CA11、CA13和 CA14鉴定为胶孢炭疽菌C.gloeosporioides,菌株 CA07鉴定为卡哈瓦炭疽菌C.kahawae,菌株CA17鉴定为暹罗刺盘孢C.siamense。菌株 CA05、CA09 和 CA23 处于博宁炭疽复合种的进化支内,且与喀斯特炭疽菌C.karstii聚为一进化支,结合形态特征将其鉴定为喀斯特炭疽菌C.karstii。菌株CA21位于尖孢炭疽菌复合种进化支,与松针刺盘孢C.fioriniae聚为一支,结合形态学结果鉴定为松针刺盘孢C.fioriniae。

图8 基于多位点序列构建炭疽病菌的系统发育树Fig.8 Phylogenetic tree based on multilocus sequence of Colletotrichum spp.
2.5 油茶叶片内生拮抗菌的分离及形态鉴定
通过TWYE和LB培养基从健康油茶叶片内共分离出19株内生放线菌和27株内生细菌,且涂布最后一次清洗叶片的无菌水未长出菌落,说明表面消毒彻底,上述46株细菌均属于油茶叶片内生菌。
通过菌落与显微形态观察结果表明,菌株BC07为链霉菌,菌落致密,干燥且不透明,后期菌落上产生晶莹粉状物,白色至浅绿色,有特殊的气味,光镜下可见发达的菌丝体,淡色,弯曲,分枝较多(图9A~9C)。菌株BC11为芽孢杆菌,菌落白色至浅黄色,表面光滑,镜检为革兰阳性菌,可见芽孢 (图9D~9F)。

图9 内生拮抗菌的形态特征Fig.9 Morphological characteristics of antagonistic endophytic bacteria
2.6 油茶叶片内生拮抗菌的筛选
以油茶炭疽菌CA17为指示菌(图10A),通过平板对峙培养5 d,筛选到2株内生细菌具有较宽的抑菌带,菌株BC07的平均抑菌率为37%(图10B),菌株BC11的抑菌效果较好,平均抑菌率为42%(图10C)。
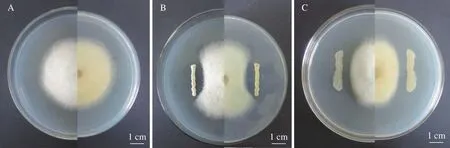
图10 内生拮抗细菌与菌株CA17平板对峙结果Fig.10 Confrontation effect of antagonistic endophytic bacteria against strain CA17
2.7 油茶叶片内生拮抗菌的分子鉴定
内生细菌 16S rRNA PCR 扩增可获得约 1 500 bp的特异性片段,基于16S rRNA构建的系统发育树结果表明,BC07与Streptomyces fulvissimus(LC551891)相似性最高(图11A),BC11与Bacillus mojavensis(JH600280)序列相似性最高(图11B),结合形态学特征确定了菌株的亲缘关系。

图11 基于16S rRNA构建内生拮抗菌的系统发育树Fig.11 Phylogenetic tree based on 16S rRNA sequence of antagonistic endophytic bacteria
3 讨论与结论
随着分子生物学的快速发展,从分子水平揭示菌株的差异和亲缘关系,使得分类和鉴定变得更加准确。核糖体RNA(rRNA)序列分析、DNA碱基组成 [(G+C) mol%]、限制性片段长度多态性 (RFLP)、随机扩增多态性DNA(RAPD)在真菌种级分类研究中有着重要的作用。对某些近缘种来说,ITS片段差异不大,利用ITS单基因序列对炭疽菌构建的系统发育树自展支持率不高,仍然不能准确地区分亲缘关系较近的种,对于炭疽菌的复合种就更加无法提供足够的支持率和区分度[14-15]。Carbone等[16]设计了蛋白基因的通用引物并用于丝状真菌的系统发育研究中,后续的研究中一些具有足够分辨率的基因序列被广泛的关注,如ACT、TUB2、CAL、GHS-1、GS和GAPDH等基因[17-19]。Liu等[9]学者在中国常见炭疽菌分子系统学最新研究报告中指出,基于ITS序列能将炭疽菌鉴定至复合种水平,但相近复合种与复合种内部物种的更准确地区分仍需要基于多位点的联合分析,该研究中多基因片段串联构建的系统发育树及全基因组特征分析的结果证实,ACT、TUB2、CAL、GHS-1、GS和GAPDH联合分析能有效区分acutatum、destructivum、orchidearum、truncatum和boninense等复合种,但gloeosporioides复合种的准确区分还需要依据ApMat和GS2个位点的串联分析。
本研究通过形态学特征及多位点序列联合构建系统发育树,经分析发现,胶孢炭疽菌C.gloeosporioides是云南省油茶炭疽病的主要病原菌,也是被广泛证实的油茶炭疽病的病原,但之前的研究普遍是基于ITS的单一片段分析,加之NCBI中无效序列的存在,导致很多胶孢炭疽菌的近缘种类未能得到准确区分[5]。暹罗刺盘孢C.siamense作为gloeosporioides复合种已在包括油茶在内的多种植物上被报道,因其形态多变,分类单元一直有争议,刘威[18]和李河等[20]的研究证实了C.siamense在茶属植物中的存在,菌株CA17与C.siamense聚为一小进化支共同聚在gloeosporioides复合种进化支内,菌株CA07在形态上与帅小春等[21]描述的菌株形态特征相似,在系统发育树中与C.kahawae聚为一支,也共同聚在gloeosporioides复合种进化支内,因此,在后续的研究中还需依据ApMat和GS2个位点对鉴定做进一步地完善[5,9]。松针刺盘孢C.fioriniae之前被认为是尖孢炭疽菌C.acutatum的变种,刘威[18]报道了该种在我国福建和云南等地的山茶属植物中存在,秦绍钊等[22]等报道了该种在贵州省的油茶中存在,并通过ACT-GAPDH串联进行分子鉴定。本研究构建的多基因系统发育树中,C.fioriniae与C.acutatum位于不同的2个分支共聚为acutatum复合种进化支。喀斯特炭疽菌C.karstii可危害多种植物,刘威[18]和王玉春[5]在我国福建省、江苏省、湖南省及云南的临沧地区报道了茶树上的C.karstii,本研究在云南油茶上报道了C.karstii,与Sharma等[23]的报道相吻合,该种属于博宁炭疽菌复合种。
作为一个稳定的微生态环境,植物能被多种内生菌定殖,其中,厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、α-/β-/γ-变形菌门 (α-/β-/γproteobacteria)和拟杆菌门(Bacteroidetes)被认为是内生菌的优势类群[24]。内生菌与致病菌的区别在于内生菌在宿主植物的生长过程中发挥着重要的作用,其中促生和抗逆作用是目前的研究热点。有报道指出由微生物产生的抗生素近一半由放线菌产生,其中链霉素、氯霉素和四环素等广泛应用于农林业及临床等领域。Golinska等[11]对植物内生放线菌的功能进行综述,结果表明内生放线菌包含了超过20个天然产物合成基因簇,其中pks基因和nrps基因是被报道最多的2类基因家族,大多数内生链霉菌属菌株能产生抗菌化合物抑制植物病原物的生长。陈东波等[25]在分离西双版纳3种有毒植物内生放线菌的同时检测了pks、nrps、aph和cyp等7个化合物合成基因,从基因角度验证内生放线菌产生次生代谢物的能力。芽孢杆菌是被广泛证实和应用的防控植物病害的生物制剂,通过占据生态位、营养竞争、分泌细菌素及水解酶等次生代谢物抑制或杀死病原菌,或激活植物的防御系统抵抗病原菌的侵入[26-27]。Malik等[28]报道了S.fulvissimus分泌的抗菌蛋白对金黄色葡萄球菌等革兰阳性菌有抑制作用,王颖等[29]报道了马铃薯内生细菌Bacillus mojavensis发挥拮抗作用的同时能稳定地定殖于植物体内,且不影响土壤微生态中微生物群落的稳定。宏基因组学技术的快速发展为研究微生物群落结构及宿主与微生物相互关系提供了新的思路[30]。在后续试验中,可通过培养组、基因组与代谢组联用的方式阐述健康油茶与染病油茶根系内的差异菌株,筛选出高效拮抗菌,分析拮抗菌的作用靶标及活性成分的代谢途径。
本研究首次对云南3个地区的栽培油茶进行炭疽病的调查,其中,德宏州的炭疽病发生较重,保山市次之,文山州发病较轻,结合形态学特征与多位点序列分析结果表明,云南省油茶炭疽病菌有5 种,分别为胶孢炭疽菌C.gloeosporioides、卡哈瓦炭疽菌C.kahawae、喀斯特炭疽菌C.karstii、松针刺盘孢C.fioriniae和暹罗刺盘孢C.siamense。通过柯赫氏法则验证病原菌致病性结果表明,菌株CA17暹罗刺盘孢C.siamense的致病力较强。同时,以强致病菌CA17为指示菌筛选到2株拮抗效果较好的内生菌,分别为BC07 (S.fulvissimus)和BC11 (B.mojavensis)。本研究可为油茶炭疽病的田间诊断、病原鉴定及其绿色防控提供依据。
