精子DNA碎片指数对首次IUI临床结局的影响
2022-08-02周文周欢群李思楠陈旭龙谢妍倪运萍陆杉
周文,周欢群,李思楠,陈旭龙,谢妍,倪运萍,陆杉
目前男性不育的诊断是基于WHO第五版定义的精液常规参数,如精液量、浓度、活力、总数及形态等,但对男性不育的诊疗价值有限。精子DNA碎片在自然妊娠和辅助生殖中对受精、胚胎发育和父方遗传信息传递都有重要影响[1]。精子DNA碎片是评估男性不育非常有价值的工具,但在预测辅助生殖技术结局方面的临床意义仍不确定。关于精子DNA碎片指数(DNA fragmentation index,DFI)与辅助生殖结局的关联,报道集中于体外受精(in vitro fertilization,IVF)、卵胞浆内单精子注射(intracytoplasm sperm injection,ICSI),对宫腔内人工授精(intrauterine insemination,IUI)的报道较少,精子DFI对IUI临床结局的预测价值存在较大的争议,且难以确定预测IUI结果的阈值[2]。其次,关注点主要集中于精子DFI对IUI临床妊娠率、自然流产的影响[3],而与活产率、新生儿身长、体重相关性的报道较少。本研究对广东省中医院生殖医学科近4年完成的首次IUI临床结局资料及术前3个月内的精子DFI数据进行回顾性分析,主要探讨精子DFI对IUI临床妊娠率、流产率、活产率及新生儿指标的影响。
1 资料与方法
1.1 一般资料
对2016年12月至2020年2月广东省中医院生殖医学科完成的首次IUI周期的临床结局资料及术前3个月内的精子DFI数据进行回顾性分析,纳入条件:① 女性为第一个IUI周期,且丈夫术前3个月内完成了精子DFI筛查(SCD法);② 20岁<女性年龄<45岁;③ 临床结局资料随访至分娩,资料完善。排除条件:① 排除SCSA法、TUNEL法、Comet法检测精子DFI的患者;② 排除优化后PR精子总数<2×106/mL的患者;③ 排除严重精神疾病及其他系统性疾病的患者。最终纳入393例女性,年龄22~43岁,平均(30.91±1.79)岁;平均不孕年限(3.19±1.79)年;平均体质量指数(body mass index,BMI)(21.98±3.31) kg/m2。根据丈夫精子DFI分为以下两组:DFI<30%组(318例),DFI≥30%组(75例),两组男方年龄、女方年龄、女方BMI、不孕因素、流产史、处理后PR精子总数等一般资料有可比性(P>0.05),详见下页表1。
1.2 方法
1.2.1 临床资料收集
(1)一般资料收集:从生殖医学科IUI病历系统收集患者首次IUI时的年龄、不孕年限、不孕因素、BMI、流产史、方案及精液优化结果等临床资料。
(2)IUI临床结局资料收集:所有患者随访至分娩。从生殖医学科IUI病历系统随访模块收集患者首次IUI的临床结局资料,包括临床妊娠、生化妊娠、自然流产、异位妊娠、早产、活产、出生体重、出生身长、出生缺陷等。计算公式:临床妊娠率=临床妊娠周期数/总周期数×100%,自然流产率=自然流产周期数/临床妊娠周期数×100%,活产率=活产周期数/总周期数×100%。
(3)IUI治疗方案:
① 自然周期:监测卵泡发育;确定排卵日及选择夫精人工授精(artificial insemination by husband,AIH)时机:当主导卵泡直径达16~20 mm,血E2达到900~1 110 pmol/L(270~300 pg/mL),出现尿黄体生成素(luteinizing hormone,LH)峰或血LH水平上升到大于基础值2倍以上,12~36 h后行AIH。未出现尿LH峰或血LH水平未达到基础值2倍以上,使用人绒毛膜促性腺激素(human chorionic gonadotropin,hCG)5 000~10 000 U肌注诱导排卵,24~36 h后行AIH。
② 促排卵周期:促排卵方案包括:克罗米芬(clomiphene citrate,CC)/来曲唑+hCG、CC/来曲唑+人绝经期促性腺激素(human menopausal gonadotropin,hMG)+hCG、卵泡刺激素(follicle-stimulating hormone,FSH)/hMG +hCG。卵泡生长及子宫内膜监测:B超监测卵泡发育情况及子宫内膜的同步增长情况。注射hCG及AIH时机的选择:若1个卵泡直径≥18 mm,或2个卵泡直径≥17 mm,停用Gn,若未出现尿LH峰或血LH水平未达到基础值2倍以上,注射hCG10 000 U或GnRHa诱导排卵,24~36 h后行AIH;若前1天晚上尿中出现LH峰值,当日上午B超监测未排卵,当日上午注射hCG 10 000 U并行AIH 1次;若当日晨尿中出现LH峰值,当日上午B超监测未排卵,当日上午注射hCG10 000 U,当日下午行AIH。
③ 精液优化:密度梯度离心法优化精液,处理后精子重悬于0.3~0.5 mL G-VIF中备用。
④ IUI:人工授精管接注射器,吸取经洗涤优化处理的精液0.3~0.5 mL,超声引导下通过宫颈将人工授精导管插入宫腔,缓慢将精液推注宫腔。
⑤ 术后监测及处理:术后14~16 d,行尿妊娠试验检查或测血hCG水平。阳性者在术后30~35 d行B超检查受孕情况。黄体功能不足者行黄体支持。
⑥ 随访时间:人工授精术后14~16 d、术后30~35 d、术后50 d、孕12周、分娩后。
1.2.2 精子DFI检测(SCD法) 收集患者首次IUI术前3个月内的精子DFI数据。精子DFI均采用染色质扩散法(SCD法)检测,试剂盒为深圳华康精子核DNA完整性检测试剂盒(SCD法),主要步骤包括:制片、变性、裂解、脱水、染色、阅片等。于1 000×油镜下分别计数大晕环、中晕环、小晕环、无晕环精子数,总数不少于400条。精子DFI=(小晕环精子数+无晕环精子数)/计数精子总数×100%。
1.3 评价指标
1.3.1 比较DFI<30%组与DFI≥30%组患者的临床资料 包括男女方年龄、不孕年限、不孕因素、原发/继发不孕、女方BMI、流产史、自然/促排卵周期、处理后PR总数等指标。
1.3.2 比较DFI<30%组与DFI≥30%组患者的IUI临床结局 包括临床妊娠率、生化妊娠率、自然流产率、活产率、新生儿体重、新生儿身长等指标。
1.3.3 比较妊娠组与未妊娠组、活产组与未活产组患者的精子DFI。
1.3.4 ROC曲线分析精子DFI对IUI妊娠、活产的预测价值。
1.4 统计学方法
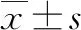
2 结果
2.1 两组临床资料比较
两组患者男方年龄、女方年龄、女方BMI、不孕年限、不孕因素、原发性不育/继发性不育、流产史、自然/促排卵周期、处理后PR精子总数比较,差异均无统计学意义(P>0.05),详见表1。

表1 两组临床资料比较
2.2 精子DFI对IUI临床结局的影响
两组临床妊娠率、自然流产率、活产率、出生体重、出生身长比较,差异均无统计学意义(P>0.05)。DFI<30%组生化妊娠7例、异位妊娠1例、早产3例、出生缺陷0例,DFI≥30%组生化妊娠0例、异位妊娠0例、早产0例、出生缺陷1例,样本量太少,未进行统计学分析,详见表2。

表2 精子DFI对IUI临床结局的影响
2.3 妊娠组、活产组精子DFI分析
妊娠组与未妊娠组精子DFI比较,差异无统计学意义(P>0.05)。活产组与未活产组精子DFI比较,差异亦无统计学意义(P>0.05),详见表3。

表3 妊娠、活产组精子DFI分析
2.4 精子DFI对IUI临床结局的预测价值分析
通过ROC曲线分析精子DFI对IUI临床结局的预测价值,结果显示精子DFI不能预测IUI临床妊娠(AUC=0.521,P=0.611,95%CI:0.439-0.603)或活产(AUC=0.502,P=0.985,95%CI:0.331-0.673),详见下页图1。
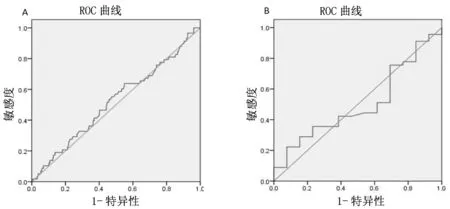
A:精子DFI预测IUI临床妊娠;B:精子DFI预测IUI活产
3 讨论
精子DNA碎片发生于精子发生和成熟的过程中[4]。受体内、外界多种因素的影响,精子细胞染色体和DNA完整性受损,导致DNA片段化。目前已知导致精子DNA损伤的主要因素有3个:精子染色质组装异常、精子细胞异常凋亡和过度氧化应激[4]。精子DNA损伤影响精子受精能力及胚胎发育潜能,已知高精子DFI男性生育力下降及伴侣自然流产率明显升高[5]。目前,精子DFI在预测IUI临床结局的意义仍不明确,文献报道存在较大差异;可能与低质量的证据有关,包括有缺陷的研究设计、有限的研究规模或潜在的混杂因素等。
关于精子DFI与IUI临床结局关联的报道较少,其中大部分研究认为精子DFI对IUI临床结局没有显著影响。Yang H等[6]对1 185个IUI周期进行回顾分析,结果显示DFI>30%、15%
本研究中DFI≥30%组与DFI<30%组出生婴儿体重、身长比较,差异均无统计学意义。刘玉林等[15]对4 080个IVF/ICSI周期分娩结局的研究显示,精子DFI升高可导致IVF/ICSI优胚率降低,但不影响新鲜周期的早产率、新生儿体重以及出生缺陷率。Bungum M等[16]对131例IVF/ICSI出生子代的健康与发育进行分析,结果显示高精子DFI对新生儿体重、孕周没有明显影响。以往认为IUI是辅助生殖技术中最接近于自然妊娠的一种手段,因此对IUI后代健康及发育的跟踪随访较少,几乎未见精子DFI对IUI子代影响的报道,结合以上两篇IVF/ICSI的报道及本研究的结果,预测精子DFI对IUI新生儿体重、新生儿身长应无明显影响,未来应加大样本量进行研究验证。本研究还发现DFI<30%组异位妊娠1例、早产3例、出生缺陷0例,DFI≥30%组异位妊娠0例、早产0例、出生缺陷1例,但由于样本量太少,数据未能进行统计学分析,因此对于异位妊娠、早产、出生缺陷的比较还需更大样本量的研究。综上所述,本研究发现精子DFI≥30%对IUI临床结局没有显著影响,可能原因为密度梯度离心可剔除部分高DFI精子,显著降低处理后精液中的DFI,从而降低DFI差异对IUI结局的影响。此外,本研究分别对妊娠组/未妊娠组、活产组/未活产组的精子DFI进行比较,差异无统计学意义,也提示IUI妊娠及活产与精子DFI无明显关联;ROC曲线显示精子DFI不能预测临床妊娠及活产。
本研究存在以下优势,即仅对首次IUI周期临床结局进行分析,排除累计妊娠结局对统计的影响。此外,还对活产率、胎儿体重身长等指标进行统计,从分娩数据分析DFI对IUI结局的影响。SCSA法虽然是检测精子DFI的金标准,但仍存在局限性,如目标细胞群的选择、门的设置及结果计算仍存在一些争议[15],而SCD法结果评估直观简单,虽然存在主观性,但在质控充分的基础上也可保证结果的准确性。然而,本研究的不足主要为样本量偏少可能影响统计结果,尤其是流产、活产的统计结果,样本量少也使得异位妊娠、早产、先天畸形等指标无法统计。尽管本研究中高DFI与低DFI组的一般资料差异无统计学意义,但并未细分混杂因素,例如男方因素、女方因素的具体病因以及促排卵方案的具体策略等。
综上所述,本研究证实了高精子DFI对IUI临床妊娠、自然流产、活产及部分新生儿指标无明显影响。未来将对更多的IUI周期数进行统计,包括单次周期及重复周期,分别探讨DFI对首次IUI结局及累计IUI结局的影响。此外,术前3个月内的DFI数据难以反映IUI手术时的DFI,未来将考虑分析IUI前后的DFI与妊娠结局的关联,通过增加样本量深入研究精子DFI预测IUI临床分娩结局的价值及可能的截取值。
