肉鸡屠宰环节中金黄色葡萄球菌的流行及分子特征和耐药性
2022-08-02张鹏飞杨雪微寇明莹阮傅倩万阳丽
张鹏飞,徐 旭,王 婷,杨雪微,张 萌,寇明莹,阮傅倩,万阳丽,吴 倩,王 新,*
(1.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100;2.绵阳师范学院,四川 绵阳 621000)
金黄色葡萄球菌是一种常见的人畜共患病原微生物,常存在于人和动物的皮肤和黏膜。它也是葡萄球菌属中致病性较强的菌种之一,可引发多种禽类疾病,包括关节炎、葡萄球菌败血症、滑膜炎、脐炎和卵黄囊感染。由于金黄色葡萄球菌是人类和家畜共生菌群的一部分,被金黄色葡萄球菌定植的鸡常常没有任何症状而在市场流通。这表示定植金黄色葡萄球菌的鸡在屠宰和售卖过程中不仅有污染其他产品的风险,也可能通过食品链传播给人类。人们通常食用加热后的食物,高温虽然可以杀死病原微生物,金黄色葡萄球菌产生的毒素如肠毒素,在100 ℃处理30 min后,仍具有生物活性。当食用20~100 ng的肠毒素即可引发食物中毒。目前已有27 种肠毒素被发现,包括5 种经典肠毒素(~)和22 种新型肠毒素(~)。
近些年动物饲养过程中抗生素的使用已受到严格的控制,但耐药菌引发的感染一直在稳步上升。动物被认为是耐药细菌的储库,与动物密切接触的兽医、屠夫、家畜养殖户等也常常检测到相关耐药细菌。无症状携带耐药金黄色葡萄球菌的家畜,不仅增加了病原菌通过动物到人传播的风险,也可能造成食品污染。此外,较差的屠宰场环境及加工人员的个人卫生,也可加重肉类的污染,并沿着生产链条进一步传播。研究表明屠宰场中的金黄色葡萄球菌流行率明显高于在农场的流行率。耐药细菌沿农场、加工环节到食物链,对公共卫生安全构成间接风险。因此,对屠宰环节食源性致病菌的耐药性监测具有重要意义。
分子分型技术已广泛应用于医院、社区、动物和食品的金黄色葡萄球菌流行病学分析。分子分型能较好地解释金黄色葡萄球菌分离株的遗传多样性和菌株间的关系。目前,一些分型基于聚合酶链式反应(polymerase chain reaction,PCR)快速、简便的特点,被广泛应用于分离菌株的鉴定,包括葡萄球菌蛋白A(staphylococcal protein A,SPA)分型、多位点序列分型(multilocus sequence typing,MLST)和肠杆菌科基因间重复序列PCR(enterobacterial repetitive intergenic consensus-PCR,ERIC-PCR)分型等。其中SPA和MLST分型重复性高、国际标准命名等优点,已被广泛使用,适用于长期追踪菌株间遗传关系。通过对世界各地不同来源克隆类型的比较,可以了解疾病和特定克隆之间的相关性及亲缘关系,也有助于确定克隆起源和找到特定克隆的独特特征。例如,欧美地区生猪主要流行的分子型为ST398,而亚洲包括中国在内主要分子型ST9。此外,有报道称特定的分子类型与SEs之间具有高度的相关性。ST5型菌株与基因簇(、、、、和),ST6-t701型菌株与和ST59型菌株与-有高度相关性。另外,ERIC-PCR分型基于重复的DNA序列被一个引物扩增,产生多条DNA图谱,适用于各实验室快速准确追踪某些菌株的传播,加快传播分析和方便感染控制。通过不同方法分型,可以了解菌株的毒力、传播能力变化,进而推导出菌株的致病性特点,提早预防菌株对人类造成的危害。
目前,已有对零售鸡肉中金黄色葡萄球菌的相关报道。但关于屠宰环节中金黄色葡萄球菌污染的报道还比较少,尤其是对不同加工环节。因此本研究旨在调查肉鸡屠宰过程中活鸡肛拭、浸烫、预冷、分割和贮存环节的金黄色葡萄球菌的污染情况;评估不同生产环节是否存在交叉污染;了解不同屠宰环节分离株分子特征及耐药性。通过对不同环节的监测,识别加工环节污染的关键控制点,可以有效预防及控制食源性疾病的暴发。
1 材料与方法
1.1 材料与试剂
为了解肉鸡屠宰场在不同屠宰环节中金黄色葡萄球菌的污染情况及菌株的分子特征和耐药性,本研究于2016年12月—2017年3月对陕西省某肉鸡屠宰场不同屠宰环节进行4 次样本的采集。此次,从5 个屠宰环节中,共收集样本144 份,包括:活鸡肛拭子(G)20 份、浸烫褪毛后整鸡胴体样本(J)30 份、预冷池后整鸡胴体样本(Y)30 份、分割后冷冻前鸡胸脯肉样本(F)32 份和贮存过程鸡胸脯肉样本(P)32 份,具体样品采样信息如表1所示。
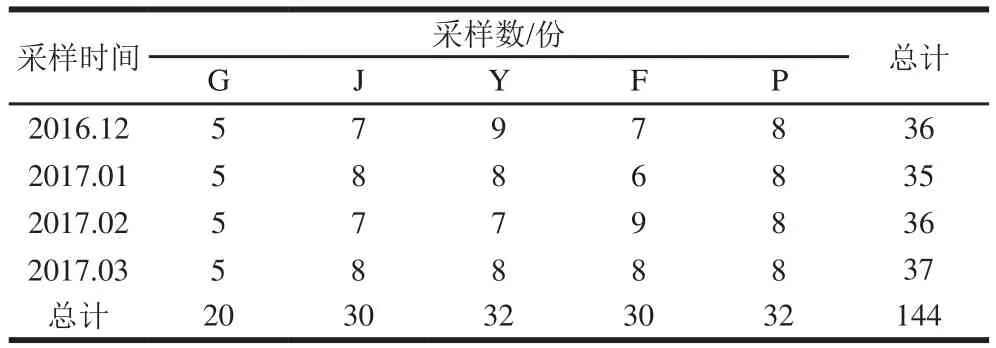
表1 样品采集时间、类型和数量Table 1 Sample collection times, types and quantities
胰蛋白胨大豆琼脂(tryptic soy agar,TSA)、胰蛋白胨大豆肉汤(tryptic soy broth,TSB)、甘露醇高盐琼脂、Baird-Parker培养基基础、亚碲酸盐卵黄增菌液、缓冲蛋白胨水(buffered peptone water,BPW)、7.5%氯化钠肉汤和Mueller-Hinton琼脂(mueller-hinton agar,MHA) 青岛高科园海博科技生物技术有限公司;PCR所用试剂 南京诺唯赞生物科技有限公司;药敏试验16 种待测抗生素 北京索莱宝科技有限公司;引物均由北京奥科鼎盛生物科技有限公司合成。
1.2 仪器与设备
ZHWY-221B恒温培养振荡摇床 上海智成分析仪器制造有限公司;GNP-9080隔水式恒温培养箱 上海精宏实验设备有限公司;580BR-7101 PCR仪、GEL DOC XR+凝胶成像 美国伯乐公司;UPHW-IV-90T超纯水机 四川优普超纯科技术有限公司;MDF-U5411高压灭菌锅 上海申安高压仪器设备有限公司。
1.3 方法
1.3.1 样本采集
主要针对活鸡肛拭、浸烫、预冷、分割、贮存环节进行样本的收集,每个环节收集(7f2)个样本,并将收集的样本置于无菌Stomacher3500塑料袋(鸡胴体或鸡胸脯肉)或50 mL无菌离心管(肛拭子),记录相关信息后,低温运至实验室,其间隔不超过4 h。
1.3.2 样品处理
鸡胴体或鸡胸脯肉:向采样袋中加入一定量的无菌BPW(500 mL/kg),充分揉搓肉鸡各个部位4~5 min。
肛拭子:向装有肛拭子样本的50 mL离心管中加入20 mL无菌BPW。
1.3.3 菌株的分离鉴定
参照Wang Xin等的方法对样本中金黄色葡萄球菌进行分离鉴定。首先将处理好的样本于空气摇床37 ℃、100~120 r/min培养18~24 h。接着,挑一环增菌液于Baird-Parker平板37 ℃培养16~18 h。挑取菌落直径为2~3 mm,颜色呈灰色到黑色,边缘为淡色,周围为一混浊带,在其外层有一透明圈的菌落,划线于甘露醇高盐琼脂平板37 ℃培养18~24 h。挑取颜色呈黄色的菌落纯化于TSA平板37 ℃培养18~24 h。最后,通过PCR扩增金黄色葡萄球菌特异性基因进行鉴定。将鉴定为阳性菌株于-80 ℃冰箱保存备用。
1.3.4 DNA提取
挑单克隆于无菌TSB肉汤中220 r/min,37 ℃振荡培养12~16 h,取1 mL细菌培养液于无菌EP管内,12 000 r/min离心2 min,弃上清液,余下操作严格按Biospin细菌基因组DNA提取试剂盒说明书进行。最后将提取的DNA模板至于-20 ℃冰箱保存。
1.3.5 毒素编码基因及耐药基因检测
运用PCR技术对分离的菌株进行23 种毒素编码基因和27 种耐药基因检测。其中23 种毒素编码基因包括:21 种肠毒素编码基因(、、、、、、、、、、、、、、、、、、、和)、中毒休克综合征毒素编码基因()和杀白细胞毒素编码基因();27 种耐药基因包括:大环内酯类耐药基因(、、、、和)、四环素耐药基因(、、和)、氨基糖苷类耐药基因(’/’’、’和’)、氯霉素耐药基因(、、、和)、甲氧苄啶耐药基因(、、和())、-内酰胺类耐药基因(和)和糖肽类耐药基因(、和/)。
参照Li Guanghui等描述引物序列进行引物合成。扩增反应的最终体积为25 μL,其中引物F/R(100 mmol/L)各1 μL、GreenMix 12.5 μL、模板DNA 5 μL和双蒸馏水5.5 μL。PCR条件为:94 ℃预变性5 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,35 个循环;72 ℃终延伸5 min。最后PCR产物经1.0%(g/100 mL)琼脂糖在0.5hTris-Borate-EDTA缓冲液中进行电泳,并在凝胶成像仪上拍照观察。
1.3.6 耐药性检测
参照美国临床实验室标准化委员会(Clinical and Laboratory Standards Institute,CLSI)推荐的琼脂稀释法对32 株分离株菌株进行16 种常用抗生素耐药性实验。具体使用药物及最小抑制浓度(minimum inhibitory concentrations,MICs)见表2。此外,药敏实验质控菌株为金黄色葡萄球菌ATCC 29213和大肠杆菌ATCC 25922,均由实验室保存。

表2 药敏测定用抗生素及MICsTable 2 MICs of antibiotics tested for susceptibility
1.3.7 分子分型
所有金黄色葡萄球菌分离株均进行SPA、MLST和ERIC-PCR分型。MLST分型:通过对7 个管家基因(、、、、、和)进行扩增和测序,对测序结果通过金黄色葡萄球菌MLST数据库(http://saureus.mlst.net/)比对获得ST型。SPA分型:通过扩增基因并对扩增产物进行测序,将序列通过金黄色葡萄球菌SPA数据库(https://www.spaserver.ridom.de/)比对分析,获得SPA分型。ERIC-PCR分型:通过对基因进行扩增,扩增产物经1.5%琼脂糖凝胶电泳后获得电泳图谱。ERIC-PCR图谱使用Bionumerics 3.0软件的UPGMA和Dice参数进行聚类分析,确定不同屠宰环节金黄色葡萄球菌分离株亲缘关系。DNA Marker 2000作为参考条带。ERIC-PCR扩增条件为:94 ℃预变性5 min;94 ℃变性1 min,35 ℃退火1 min和72 ℃延伸4 min,35 个循环;72 ℃终延伸10 min;4 ℃保存。
1.4 数据处理
利用Minitab16.2.3对实验数据进行处理,用检验对不同环节金黄色葡萄球菌阳性样本数、毒素编码基因、耐药基因和耐药分离株阳性数进行差异分析,并对分离株常见分子分型与毒素编码基因之间的相关性进行分析,<0.05,差异显著。
2 结果与分析
2.1 金黄色葡萄球菌检出情况
由表3可知,对收集到的144 份样品进行选择培养和基因鉴定,共有32 份样品被金黄色葡萄球菌污染,污染率为22.2%(32/144)。除肛拭样本未有金黄色葡萄球菌检出外,其余环节均有检出。其中浸烫环节(40.0%,12/30)检出率最高,其次为分割环节(26.7%,8/30)、预冷环节(21.9%,7/32)和配送贮存环节(15.6%,5/32)。不同屠宰环节中,金黄色葡萄球菌阳性样本数差异显著(<0.05),包括浸烫环节样本金黄色葡萄球菌检出明显高于肛拭和配送环节样本,预冷和分割样本高于肛拭样本。
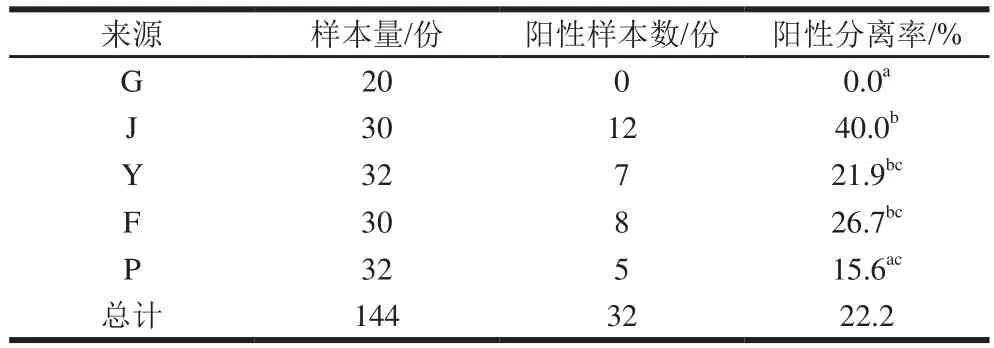
表3 不同屠宰环节中金黄色葡萄球菌的流行情况Table 3 Prevalence of S.aureus in different slaughtering stages
2.2 毒素编码基因检出情况
由表4可知,23 种被检毒素编码基因中16 种毒素编码基因被检出,其中基因检出率最高,为53.1%(17/32),其次为(43.8%,14/32),、i、、和(34.4%,11/32),(31.3%,10/32),、和(18.8%,6/32)和、、、和(3.1%,1/32)。7 种毒素编码基因、、、、、和未被检出。此外,96.9%(31/32)的菌株至少携带1 种毒素编码基因,共有7 种毒素编码基因谱。其中频繁检出的毒素编码基因谱为(25.0%,8/32)、-----(21.9%,7/32)、(18.8%,6/32)、---(15.6%,5/32)和------(15.6%,5/32)。不同环节样本分离株毒素编码基因携带情况,无显著差异(>0.05)。

表4 不同屠宰环节中金黄色葡萄球菌毒素编码基因携带率Table 4 Carrying rates of virulence genes in S.aureus at different slaughtering stages
2.3 耐药情况
由表5可知,27 个所测耐药基因中,仅有4 个耐药基因被检出。其中检出最高87.5%(28/32),其次为81.3%(26/32)、和’/’’56.3%(18/32)。此外,32 株分离株共有4 种耐药基因谱,其中,最常检出的耐药基因谱为---’/’’(50.0%,16/32),其次为-(31.3%,10/32)和--’/’’(6.3%,2/32)。不同环节样本分离株耐药基因携带情况,无显著差异(>0.05)。
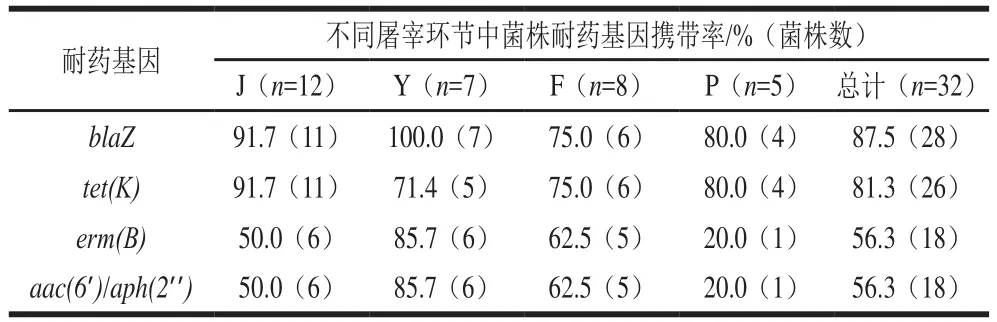
表5 不同屠宰环节中金黄色葡萄球菌的耐药基因携带率Table 5 Carrying rates of drug resistance genes in S.aureus at different slaughtering stages
由表6可知,所有菌株对所测抗生素均表现出不同程度的耐受,都至少耐受4 种抗生素。其中对T/S耐药最为普遍(100.0%,32/32),其次为AMP和PEN(96.9%,31/32)、TET(78.1%,25/32)、ERY(62.5%,20/32)、GEN(31.3%,10/32)、CIP(28.1%,9/32)、FOX和FOP(3.1%,1/32)。所有菌株对OXA、CHL、RIF、VAN、A/C、AMK和LZD等抗生素敏感。此外,32 株分离株共有8 种耐药谱,其中,最常检出的耐药谱为AMP-TET-T/S-PEN(34.4%,11/32),其次为AMP-ERY-TET-CIP-T/S-PEN(28.1%,9/32)、AMPERY-T/S-PEN-GEN(18.8%,6/32)、AMP-ERY-TETT/S-PEN-GEN(6.3%,2/32)、AMP-ERY-T/S-PEN、AMP-ERY-TET-T/S-PEN、ERY-TET-T/S-PEN和AMPTET-FOX-FOP-T/S-PEN-GEN(3.1%,1/32)。不同环节样本分离株耐药情况无显著性差异(>0.05)。

表6 不同屠宰环节中金黄色葡萄球菌耐药率Table 6 Drug resistance rates of S.aureus at different slaughtering stages
2.4 分子分型
对所有的分离株进行SPA、MLST和ERIC-PCR分型,结果如图1所示。32 株分离株共有5 种SPA分型、3 种ST型和4 种ERIC-PCR分型。对于SPA分型,主导分子型为t091(14/32,43.8%),其次为t010(31.3%,10/32)、t437(18.8%,6/32),t002和t441(3.1%,1/32)。对于ST分型,主导分子型为ST7(43.8%,14/32),其次为ST5(34.4%,11/32)和ST59(21.9%,7/32)。对于ERIC分型,32 株分离株ERIC-PCR图谱扩增条带清晰,条带大小在100~2 000 bp之间,扩增条带数介于4~6 条。采用Bionumerics分析软件对ERICPCR图谱进行聚类分析,结果显示32 株分离株共分为4 个簇。其中I3簇分离株最多占所有分离株的46.9%(15/32),其次为I4簇(21.9%,7/32),I1簇和I2簇(15.6%,5/32)。此外,4 个簇中均存在不同屠宰环节样本分离株(I1~I4)。
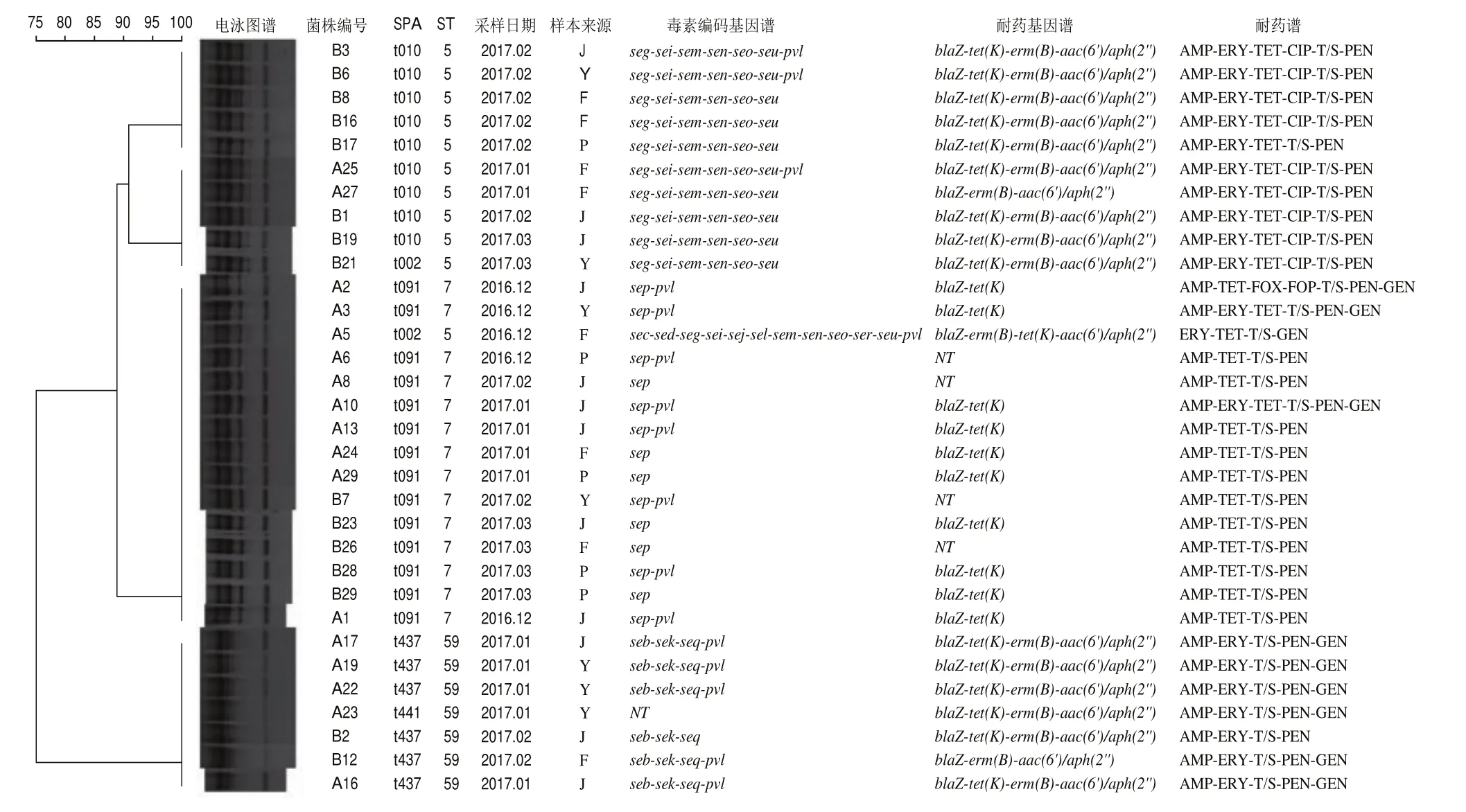
图132 株金黄色葡萄球菌ERIC-PCR、SPA、ST分型、毒力编码基因谱、耐药基因谱和耐药谱的聚类图Fig.1 Dendrogram showing ERIC-PCR, SPA, ST typing, virulence gene profiles, resistance gene profiles and antimicrobial resistance profiles of 32 S.aureus isolates
2.5 分子型与毒素编码基因相关性分析
由表7可知,对不同分型与携带肠毒素编码基因之间的关系进行分析,结果表明金黄色葡萄球菌的主要分子型与肠毒素编码基因之间关联性存在统计学意义(<0.05)。ST7-t091、ST5-t010和ST59-t437分别携带、-----和--基因谱。

表7 分离株分子型与毒素基因相关性分析Table 7 Correlation analysis between molecular types and virulence genes of isolates
3 讨 论
在中国,鸡肉是仅次于猪肉的第2大肉类消费品。随着鸡肉消费量的增多,鸡肉安全就显得尤为重要。目前,屠宰加工环节被认为是食物污染的关键环节。而金黄色葡萄球菌作为人类共生菌定植在人皮肤和黏膜,在食品加工过程中很可能造成食物污染。此外,金黄色葡萄球菌也常常定植在加工设备,在食物加工过程中存在安全隐患。
本研究对陕西省某肉鸡屠宰场不同屠宰加工环节进行金黄色葡萄球菌污染监测,144 份样本中32 份(22.2%)检测到金黄色葡萄球菌。谢建华和王琳等分别对重庆和山东不同屠宰环节监测中,均发现肉鸡样本中存在金黄色葡萄球菌污染。Sadiq等报道巴基斯坦屠宰场也有金黄色葡萄球菌检出,且耐甲氧西林金黄色葡萄球菌检出率达39.3%(118/300)。由此说明,国内外鸡屠宰环节中普遍存在金黄色葡萄球菌的污染。此外,有研究报道称屠宰环节金黄色葡萄球菌的检出率与季节存在明显的联系。夏秋两季屠宰环节金黄色葡萄球菌的检出率要高于春季和冬季。本研究屠宰环节金黄色葡萄球菌的检出率明显低于谢建华等报道夏秋两季59.25%。这可能由于春节前后温度较低,不利于微生物生长。
对活鸡肛拭、浸烫、预冷、分割和贮存5 个环节进行监测,发现除活鸡肛拭样本无检出外,其余样本均有检出。王会生等对甘肃省两个城镇5 个养鸡场的研究中,肛拭子样本也无金黄色葡萄球菌检出。这一结果表明活鸡金黄色葡萄球菌的携带率较低,后期屠宰加工环节是造成鸡胴体污染的主要原因。在屠宰环节中,浸烫环节被认为是污染的主要环节,本研究浸烫褪毛后鸡胴体金黄色葡萄球菌的检出高于与其他环节。这可能是因为附着于羽毛、皮肤、鼻腔等外表皮的金黄色葡萄球菌,在褪毛时沾染在加工设备表面,造成鸡胴体污染。且褪烫环节褪毛不彻底时,需增加人工作业,人工携带病原体或人工沾染病原体后继续工作均会造成重复污染。预冷环节中消毒剂可以杀死鸡胴体表面的金黄色葡萄球菌。本研究预冷环节鸡胴体金黄色葡萄球菌的检出率明显低于浸烫褪毛环节,但仍有21.9%的样本被污染,这可能与消毒池内消毒剂的浓度有关。王琳等也在预冷环节鸡胴体中检测到了金黄色葡萄球菌。因此,实时监测预冷池中消毒剂的有效浓度是很有必要的。分割环节中金黄色葡萄球菌检出率又有所升高,这一结果与谢建华等的报道一致。王琳等对屠宰环节金黄色定量评估研究中指出,工人手部和刀具等环境因素中的金黄色葡萄球菌都会额外增加生产线上鸡肉的污染风险。此外,贮存环节15.6%样本检测为金黄色葡萄球菌阳性,提示需加强对屠宰加工环节的关键污染点进行预防和控制,防止致病菌进入食物链,对人体健康造成威胁。
近年来,耐多药金黄色葡萄球菌在食物中检出的报道越来越多,尤其是动物源食品。这是一个由众多因素造成的全球性问题,特别是抗生素的滥用和误用。在美国、埃及、中国等国家零售鸡肉中耐多药金黄色葡萄球菌已有报道。本研究,所有菌株至少同时对4 种所测抗生素耐受,60%以上菌株分别对氨苄西林、青霉素、复方新诺明、四环素和红霉素耐药和30%左右菌株分别对庆大霉素和环丙沙星耐药。已有研究报道,来自家禽养殖、加工和贮存环境分离株普遍耐受四环素。这与四环素便宜、副作用小等特点,普遍在世界范围内广泛应用于家禽养殖有关。且家禽金黄色葡萄球菌分离株编码四环素耐药表型的基因常为,也与本研究一致。此外,分离株对红霉素抗生素耐药也很普遍,不同的是其他研究报道中最常检出编码基因为,而本研究仅有基因被检出。这一结果表明具有相同耐药表型的金黄色葡萄球菌株可能携带不同的耐药基因。此外,Ogundipe等对尼日利亚西南部家禽养殖场和活禽市场中的人、鸡、鸡肉和环境样本中进行耐药性检测,发现鸡肉分离株主要对四环素和甲氧苄啶/磺胺甲恶唑耐药,而人源分离株主要对红霉素和庆大霉素耐药。考虑到红霉素常用于人类被细菌感染时的治疗,因此,推测在加工过程中定植于人类的致病菌可能通过加工环节污染鸡胴体及其制品。此外,本实验发现氨苄西林、红霉素、四环素和庆大霉素耐药菌株的表型和基因型并不总一致。菌株对抗生素耐受是一个复杂的过程,可能还存在其他因素介导菌株耐药。
本研究中除一株不携带任何毒素编码基因外,其余均至少携带一种毒素编码基因。其中96.9%(31/32)的菌株携带新型肠毒素编码基因。美国俄克拉荷马州和土耳其国家对鸡源金黄色葡萄球菌的研究中,也检测到了新型肠毒素编码基因,国内陈瑶、徐本锦等检出新型肠毒素编码基因且占比靠前。尽管,经典肠毒素是引发食物中毒的主要原因,新型肠毒素编码基因近些年在不同食物中的频繁检出,不应忽视。已有报道食用新型肠毒素污染的食物引发人食物中毒。此外,本研究还发现分子型与毒素编码基因显著相关(<0.05)。携带基因的菌株,分子型均为ST7-t091。与之相似的,ST5-t010/t002分子型菌株均携带完整基因簇基因(-----)和ST59-t437型菌株均携带--基因谱。由于大部分肠毒素编码基因位于可移动的遗传元件上,不同遗传谱系携带特定肠毒素编码基因。不同毒力基因或毒力基因的组合也赋予了该类型菌株独特的致病性和感染力。Yang Xiaomei等报道,ST7-t091是我国食物中毒分离株优势分子型,且该分型分离株普遍携带基因。与本研究不同的是ST7-t091仅携带基因,与拥有相近的序列且均位于φSa3致病岛,导致食物中毒的危害不容忽视。基因簇基因位于vSaβ致病岛,被报道与中毒性休克综合征、猩红热和人类特应性湿疹有关。Gu Feifei等报道,在上海某医院中ST5型菌株已经超越ST239成为主要分子型菌株。被报道可以加重鼻黏膜屏障的破坏和肺炎感染,与和同位于SaPI3致病岛上,且常常发现于亚洲社区感染的主要克隆系ST59-t437菌株中。
32 株分离株共鉴定出5 种分子型,ST7-t091、ST5-t010/t002和ST59-t437/t441。其中ST7-t091检出最高,这与Krupa等的研究中鸡源金黄色葡萄球菌的优势分型一致。Ayeni等在尼日利亚南部的家禽样本中也发现t091型菌株。由此推测,ST7-t091可能是禽肉中的优势分子型。另一种家禽常见的分型为ST5,在褪毛、预冷、分割和贮存环节样品中均有检出。与本研究不同的是,ST5型菌株常被检出的SPA型为t002,而本研究中11 株ST5型菌株仅有1 株为t002,其余均为t010。此外,在本研究还发现了与社区感染相关的分子型ST59-t437,ST59-t437分型菌株的检出也提示在动物屠宰过程也会受到外源性病原体的污染。ST7-t091、ST5-t010和ST59-t437分型菌株均在浸烫褪毛环节开始出现,在后续环节中几乎连续检出,这说明浸烫褪毛环节是金黄色葡萄球菌污染的关键环节。不同采样批次且不同屠宰环节样本分离株存在相同ERIC-PCR图谱、分子型、耐药谱、毒素和耐药基因,由此推断鸡肉屠宰加工中存在交叉污染的可能性。
4 结 论
肉鸡屠宰过程中普遍存在金黄色葡萄球菌污染,且不同屠宰环节存在交叉污染,其中浸烫褪毛环节被认为是污染的关键环节。禽肉中优势分子型ST7-t701和ST5-t002/t010在本研究中也有较高检出率。此外,社区型ST59-t437菌株的检出,提示人们在屠宰加工环节中存在外源病原体的入侵。因此,保持屠宰卫生,定期对胴体进行微生物监测,实施良好生产规范,以及建立一个食品安全体系,如HACCP体系,是将对消费者的风险降到最低的必要措施。
