高通量测序技术分析西藏不同海拔地区曲拉微生物多样性
2022-08-02卢灏泽张洋铭张凤杰
薛 蓓,卢灏泽,,杨 帆,,张洋铭,罗 章,张凤杰,薛 洁,*
(1.西藏农牧学院食品科学学院,西藏 林芝 860000;2.中国食品发酵工业研究院,北京 100015)
曲拉,藏语意为干奶渣,是西藏地区牧民家庭自制的一种奶酪制品,其营养丰富,便于贮藏,具有独特的口感与特殊的风味。曲拉带有浓重的地域特色,已逐渐成为青藏高原上的特色农产品。曲拉的制作工艺基本如下:将牦牛乳煮沸脱脂后,接种酸乳清,在自然条件下发酵,排出乳清后自然风干而成。在自然发酵条件下,由于生产环境的差异,会造成成品曲拉中微生物菌群组成的差异。导致成品曲拉品质不稳定,安全性也不能保证。
张蓓利用传统培养方法,对不同制作阶段的曲拉进行分析,发现酵母菌和乳酸菌是整个发酵过程中的优势微生物。卿蔓君等将曲拉中的微生物进行分离纯化,优势菌属为毕赤酵母属()、克鲁维酵母属()。文鹏程等从牦牛曲拉中分离出性能较好、不同菌属的乳酸菌。由于传统培养方法费时费力、部分微生物难以培养、操作复杂易出错等缺点,不能完整地表现出曲拉中微生物的多样性。已有研究对采自中国不同地区的多个传统发酵乳样品的分析结果表明,不同样品中的微生物多样性与地理环境密切相关,不同地区的发酵乳制品中微生物群落结构不同,且存在明显的差异。
曲拉自然发酵的生产过程决定了其风味与微生物组成有很大关系,由于不同地域的微生物组成不同,可能对曲拉在发酵过程中产生的风味造成影响。研究曲拉微生物多样性,对探明其群落结构以清晰了解不同微生物在曲拉中的分布情况、鉴别有无致病菌保证曲拉安全性有重要意义。此外,可以发掘曲拉中的高原特色微生物,对优良菌种进行开发利用,丰富菌种资源。本研究利用高通量测序技术,分析西藏不同海拔地区曲拉中微生物的群落结构,以期探明不同海拔地区曲拉中微生物差异情况,并为曲拉中微生物的开发提供理论依据。
1 材料与方法
1.1 材料与试剂
采集自西藏不同海拔地区的40 份牦牛曲拉(牦牛品种为西藏高山牦牛,年龄在5~6 岁,该品种在西藏数量多,分布广,适应性强,是西藏牦牛的重要代表),采于2021年3月,样品信息见表1。
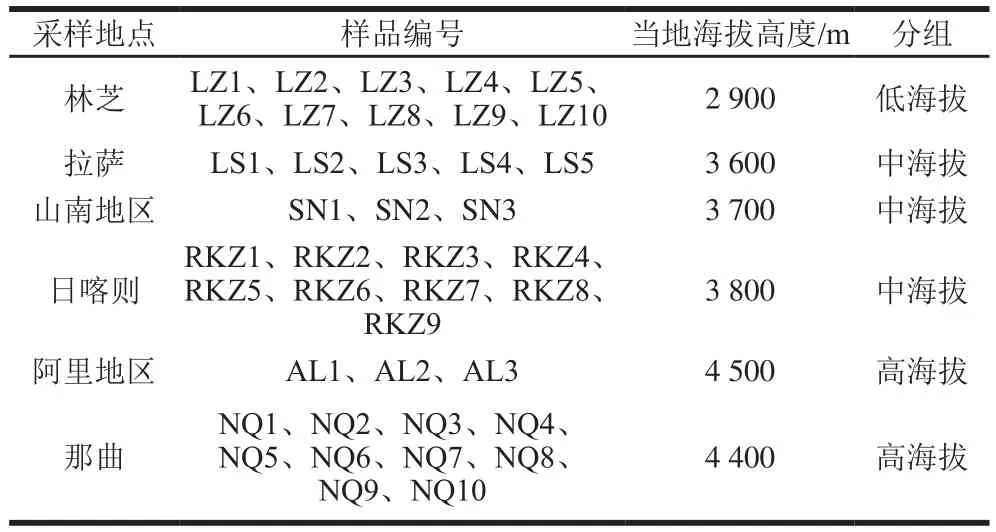
表1 样品名称及分组信息Table 1 Coding and grouping of Qula samples from different altitudes
E.Z.N.A.Soil DNA试剂盒 美国Omega BioTek公司;AxyPrep DNA凝胶回收试剂盒 美国Axygen公司;聚合酶链式反应(polymerase chain reaction,PCR)所用试剂 大连宝生生物公司。
1.2 仪器与设备
PCR仪、凝胶成像系统 美国伯乐公司;台式离心机湖南恒诺仪器公司;电泳仪 北京六一仪器厂;高通量测序仪 美国Illumina公司。
1.3 方法
1.3.1 样品采集与分组
按照表1所示采样地点,采集曲拉样品,将样品放置于无菌采样袋中,冰袋低温下保存,尽快送回实验室,4 ℃保存备用。根据样品采样地点海拔高度,将所有样品分为3 组:低海拔组当地海拔高度为3 000 m以下;中海拔组当地海拔高度在3 000~4 000 m;高海拔组当地海拔高度为4 000 m以上。
1.3.2 DNA提取
样品的总DNA提取利用试剂盒,按照试剂盒内的使用说明进行具体操作。
1.3.3 PCR扩增
PCR体系:10hPCR buffer(Mgplus)2.5 μL,dNTP Mixture 2.0 μL,上游引物1.0 μL,下游引物1.0 μL,DNA模板1.0 μL,rDNA聚合酶(5 U/μL)0.3 μL,ddHO 17.2 μL。
细菌V3-V4区域的通用引物为338F(5’-ACTCCTACGGGAGGCAGCAG-3’)、806R(5’-GGACTACHVGGGTWTCTAAT-3’)。PCR扩增条件:95 ℃预变性3 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,扩增30 个循环;72 ℃再延伸10 min,4 ℃保存。PCR产物用0.8%琼脂糖凝胶电泳检测。
真菌ITS区域的通用引物为ITS1F(5’-CTTGGTCATTTAGAGGAAGTAA-3’)、ITS2R(5’-GCTGCGTTCTTCATCGATGC-3’)。PCR扩增条件:95 ℃预变性3 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,扩增35 个循环;72 ℃再延伸10 min,4 ℃保存。PCR产物用0.8%琼脂糖凝胶电泳检测。
1.3.4 高通量测序
将PCR产物送至美吉生物公司,后续的文库构建与上机测序由该公司的Illumina MiSeq PE300测序平台进行。
1.4 数据处理
使用Trimmomatic软件对原始序列进行质控与过滤,舍去质量较低的序列,用FLASH软件对原始序列进行拼接,使用UCHIME软件剔除嵌合体。使用UPARSE软件,根据97%相似性对序列进行可操作分类单元(operational taxonomic units,OTU)聚类。将所有优化序列map至OTU代表序列,选出与OTU代表序列相似性在97%以上的序列,生成OTU表格,在美吉生物云平台进行数据分析。根据多样性指数,分析不同组样品的多样性。根据OTU数量的Venn图,分析不同组样品含有的OTU数量,根据样品在属水平下的物种相对丰度图,分析不同组样品的优势微生物与群落结构,根据主成分分析(principal component analysis,PCA)与非加权组平均法(unweighted pair-group method with arithmetic means,UPGMA)层级聚类分析不同组样品间差异情况。
2 结果与分析
2.1 不同曲拉样品中微生物α多样性分析
多样性可反映出不同样品间物种多样性与丰富度的差别,本研究对3 组曲拉样品中微生物的多样性进行分析,结果如表2、图1所示。可得低海拔组与中海拔组、高海拔组样品的细菌多样性指数与丰富度指数都存在显著差异(<0.05),中海拔组与高海拔组差异不显著。随着海拔高度的上升,曲拉样品中细菌的多样性指数与丰富度指数都呈下降趋势。造成该现象的原因可能是随着海拔高度的上升,温度逐渐降低、降水逐渐减少、大气压降低。这些环境因素的改变对微生物会造成较大影响,导致对不良环境耐受性较差的微生物不能生长。
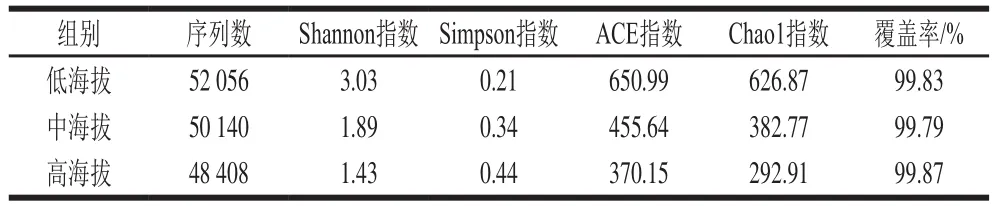
表2 曲拉样品中细菌测序数据统计Table 2 Statistics of bacterial sequencing data of Qula samples
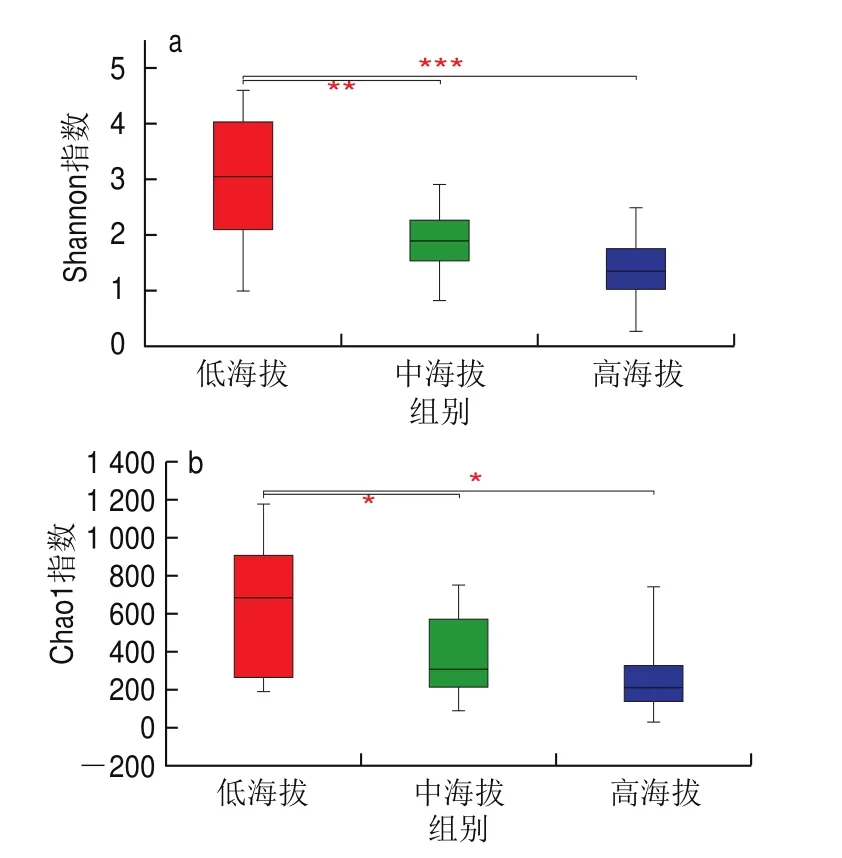
图1 细菌Shannon指数(a)和Chao1指数(b)箱式图Fig.1 Bacterial Shannon index (a) and Chao1 index (b)
结合表3、图2可得,3 组样品间真菌多样性指数差异不显著,但低海拔组与中海拔组、高海拔组样品的真菌丰富度指数存在显著差异(<0.05),中海拔组与高海拔组差异不显著。与细菌相比,真菌对不良环境的耐受性更强,因此海拔变化对真菌的影响较细菌小。但随着海拔高度的上升,各种环境因素的改变导致了微生物生长条件变差,中海拔组与高海拔组的微生物多样性都比低海拔组要低。
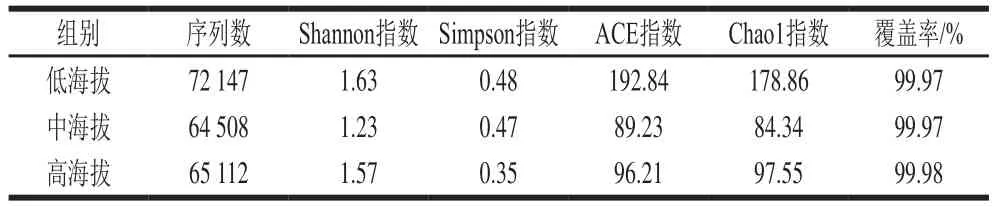
表3 曲拉样品中真菌测序数据统计Table 3 Sequencing data statistics of fungi in Qula samples
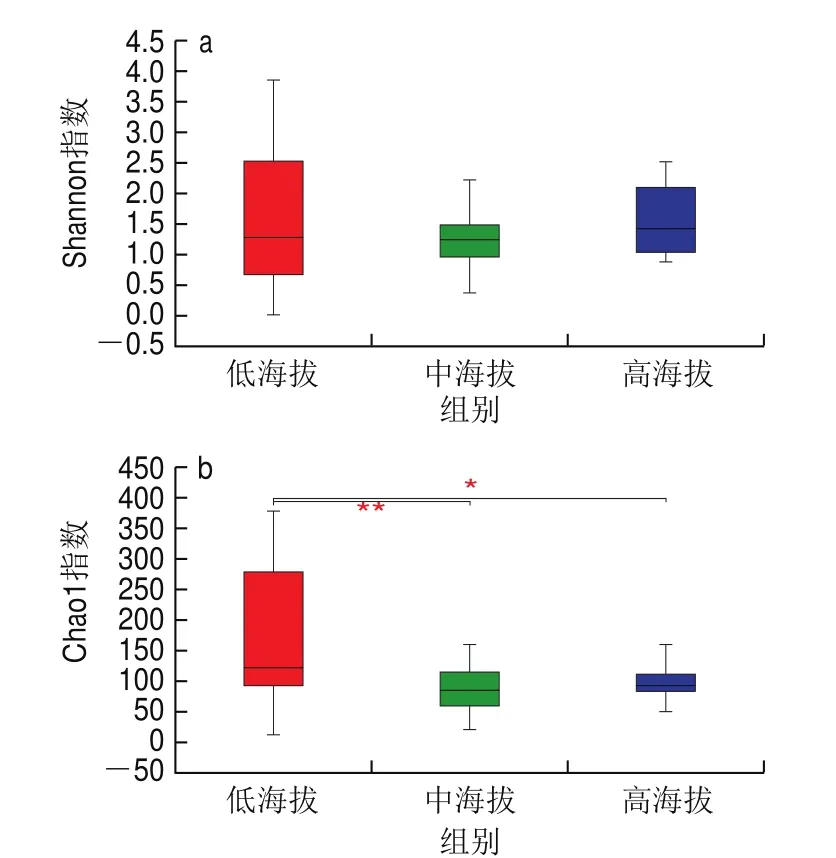
图2 真菌Shannon指数(a)和Chao1指数(b)箱式图Fig.2 Fungal Shannon index (a) and Chao1 index (b)
2.2 样品所含OTU数量分析
为了研究不同海拔地区的曲拉样品中微生物多样性,需要对不同组样品的序列按97%的一致性聚类为OTU,然后进行分析。通过聚类操作,按照RDP贝叶斯算法分析不同水平中OTU代表序列,利用R软件,绘制Venn图。
由图3可知,低海拔组含有细菌OTU 2 411 个、中海拔组含有细菌OTU 1 391 个、高海拔组含有细菌OTU 1 197 个,其中低海拔组与中海拔组共有的细菌OTU 473 个、低海拔组与高海拔组共有的细菌OTU 217 个、中海拔组与高海拔组共有的细菌OTU 75 个,3 组共有的细菌OTU 715 个。低海拔组含有细菌OTU数量最多、中海拔组次之、高海拔组最少。
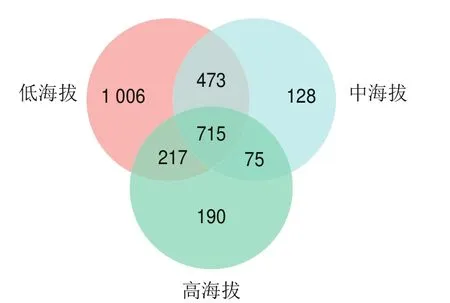
图3 曲拉样品细菌群落Venn图Fig.3 Venn diagram showing shared and unique bacterial OTUs among Qula samples
由图4可知,低海拔组含有真菌OTU 801 个、中海拔组含有真菌OTU 343 个、高海拔组含有真菌OTU 399 个,其中低海拔组与中海拔组共有的真菌OTU 64 个、低海拔组与高海拔组共有的真菌OTU 75 个、中海拔组与高海拔组共有的真菌OTU 17 个,3 组共有的真菌OTU 173 个。低海拔组含有真菌OTU数量最多、高海拔组次之、中海拔组最少。
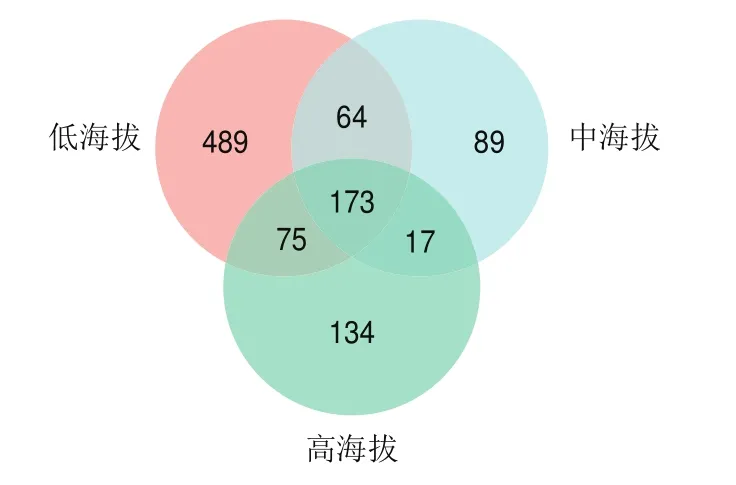
图4 曲拉样品真菌群落Venn图Fig.4 Venn diagram showing shared and unique fungal OTUs among Qula samples
2.3 不同样品在属水平的比较
在样品中检出的众多微生物中,由于许多物种含量过少,不具有代表意义。因此在群落组成分析中,将相对丰度小于1%的物种归为其他类(others),相对丰度大于1%的物种按丰度大小进行绘图。
由图5所示,共检出23 种相对丰度大于1%的属,随着海拔高度的上升,样品中优势微生物的种类减少。其中低海拔组17 种,中海拔组11 种,高海拔组7 种。不同组样品共有的优势属为乳球菌属()、乳杆菌属(),平均相对丰度为34.0%和18.4%。在低海拔组中,优势菌属为红球菌属()13.1%、12.2%、考克氏菌属()9.5%、6.4%、醋酸菌属()5.9%。中海拔组中,优势菌属为54.6%、12.8%、10.4%。在高海拔组中,优势菌属为40.9%、30.2%、9.4%。除低海拔组外,和在样品中占有绝对优势。在各组样品中,明串珠菌属()、片球菌属()、肠球菌属()、链球菌属()、魏斯氏菌属()、双歧杆菌属()也有较高的丰度,这些乳酸菌也常见于各种发酵乳制品、泡菜等传统发酵食品,在生产过程中代谢产生乳酸、促进发酵,抑制有害菌,并产生各种风味物质,最终使传统发酵食品具有其典型的特征。
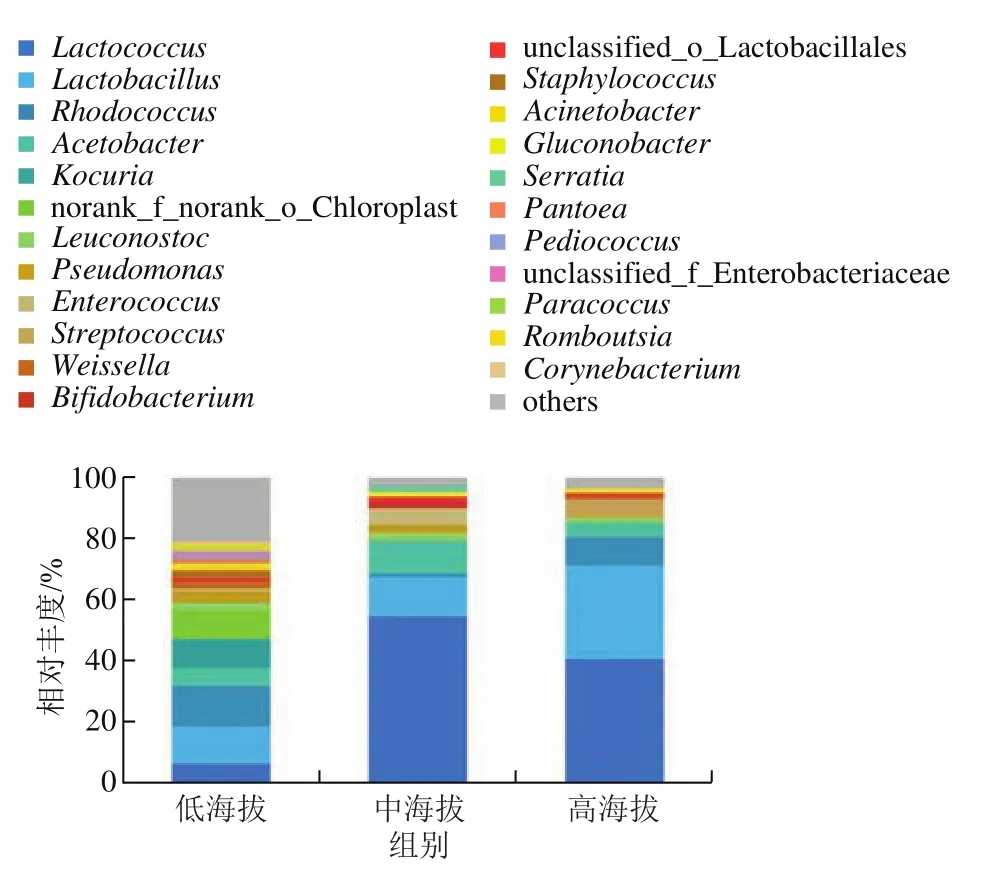
图5 曲拉样品在属水平的细菌群落组成Fig.5 Bacterial community composition of Qula samples at the genus level
如图6所示,共检出23 种相对丰度大于1%的属,其中低海拔组11 种,中海拔组12 种,高海拔组13 种。不同组样品间优势微生物的种数差异不明显。不同组样品共有的优势属为地霉属(),平均相对丰度为33.8%。白地霉()是奶酪中常见的真菌,在发酵过程中产生挥发性物质,影响奶酪的风味。在低海拔组中,优势菌属为曲霉属()21.1%、20.0%、青霉属()16.7%。在中海拔组中,优势菌属为48.0%、毕赤酵母属()8.15%。在高海拔组中,优势菌属为33.6%、7.4%。在各组样品中,克鲁维酵母属()、、假丝酵母属()也有较高的丰度,这些酵母菌常见于各种奶酪制品中,对奶酪的风味产生重要影响。此外,未鉴定出的属在不同组样品中也有较高的丰度。
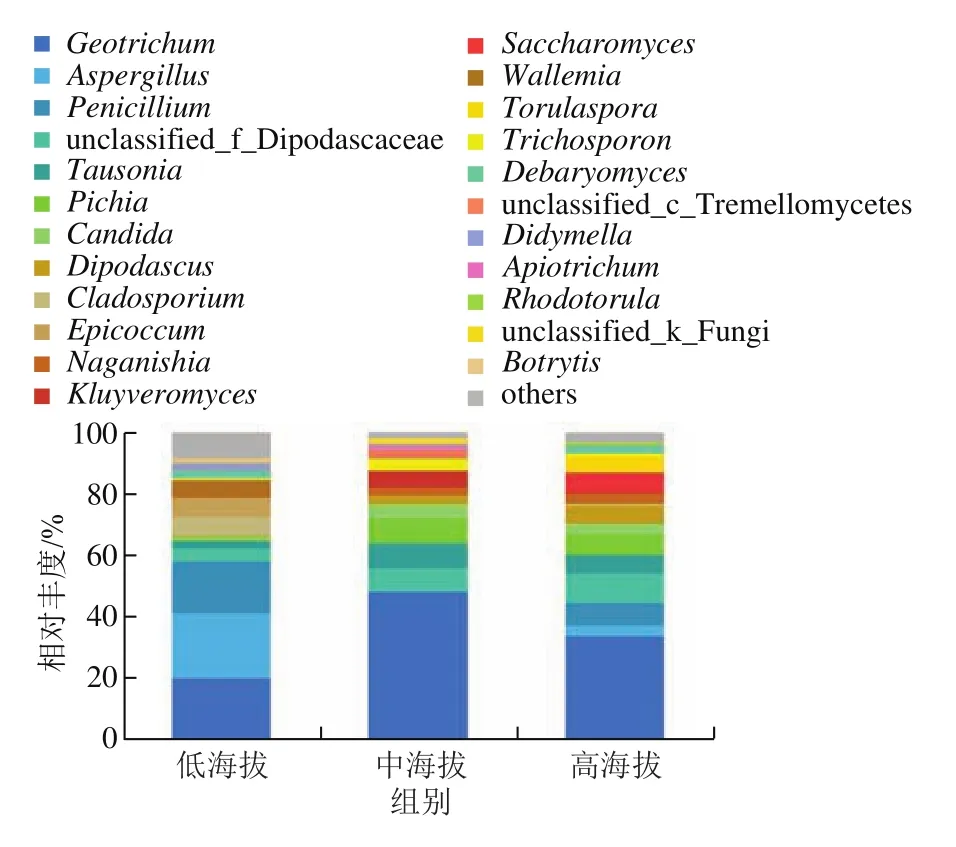
图6 曲拉样品在属水平的真菌群落组成Fig.6 Fungal community composition of Qula samples at the genus level
2.4 不同曲拉样品中微生物β多样性分析
利用SPSS软件,分析曲拉样品的细菌、真菌群落。由图7a可得出,低海拔组样品在PCA图中的位置集中,距离紧密,样品间相似度较高,有明显的聚类趋势。中海拔组样品在PCA图中的位置比较集中,距离接近,高海拔组的样品在PCA图中较为分散,距离较远。图7b为基于unweighted_unifrac距离的UPGMA聚类分析图,低海拔组的样品聚类较为集中,树枝间的长度较短,样品间相似度较高,且与中海拔组、高海拔组的距离较远。中海拔组、高海拔组的样品树枝间长度较长,样品间相似度较低。与PCA所得出的结论一致。
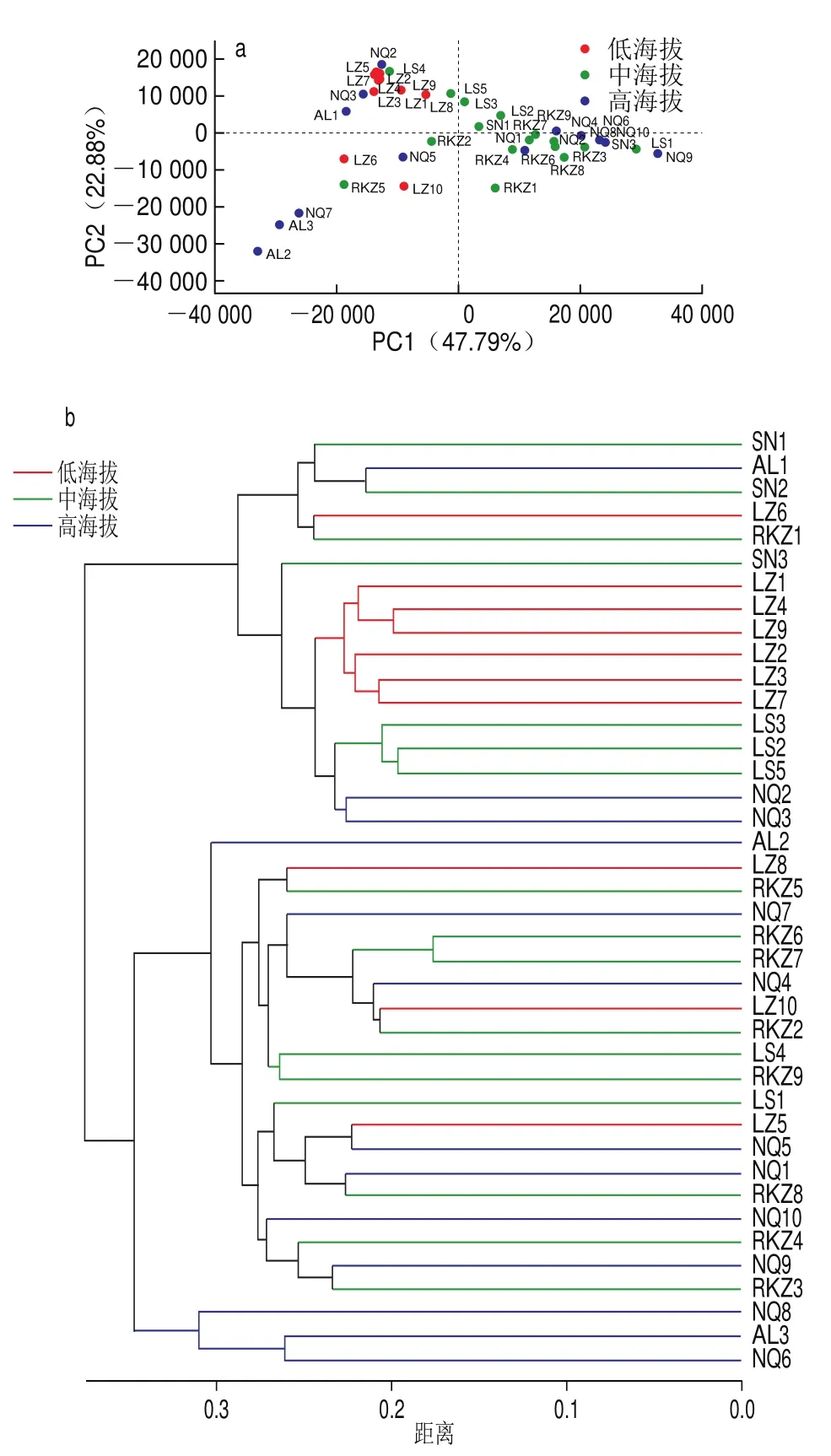
图7 不同组样品的细菌群落PCA(a)与层级聚类分析(b)Fig.7 PCA plot for bacterial communities in samples from different groups (a) and hierarchical cluster analysis (b)
由图8a可见,低海拔组样品在PCA图中的位置分散,距离较远,样品间相似度较低,中海拔组、高海拔组的样品在PCA图中位置集中,距离较近,样品间相似度较高。图8b中,低海拔组样品树枝间的长度较长,样品间相似度较低,与中海拔组、高海拔组差异较大。中海拔组、高海拔组的聚类较为集中,树枝间的长度较短,样品间相似度较高。与PCA所得出的结论一致。
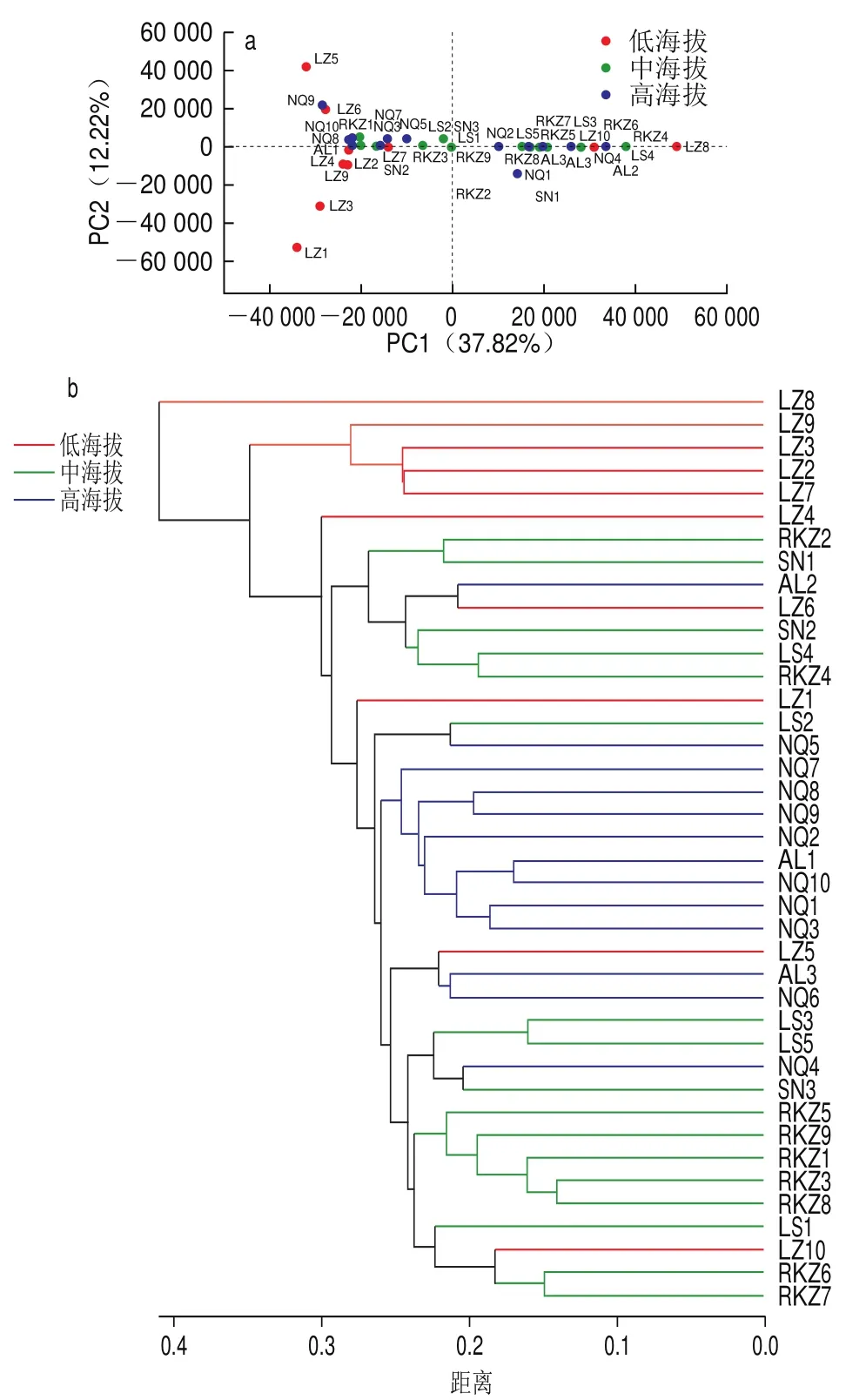
图8 不同组样品的真菌群落PCA(a)与层级聚类分析(b)Fig.8 PCA plot for fungal communities in samples from different groups (a) and hierarchical cluster analysis (b)
3 讨 论
曲拉作为我国传统发酵食品,属于酸凝型奶酪,往往在自然条件下经过多菌种的共同发酵制成。曲拉中微生物群落结构对曲拉的风味影响重大:乳酸菌是曲拉中细菌的核心菌群,在曲拉生产过程中,乳酸菌代谢产生乳酸促进凝乳、生成多种风味物质。多种乳酸菌协同发酵可减少发酵时间,提高生产效率,改善曲拉的整体品质。酵母菌则与蛋白质水解、脂类降解等代谢途径密切相关,改善曲拉的质地与风味。一些霉菌也对曲拉的品质有重要影响。但曲拉在自然粗犷的生产条件下,多微共酵的发酵方式有可能使致病菌生长繁殖,导致其安全性受到严重影响。因此,探明发酵过程中的部分关键微生物,对改进曲拉生产工艺、促进风味物质产生、保证曲拉安全性等有重要意义。
自然发酵乳制品有很高的微生物多样性,是由其发酵环境决定。本研究中,和为不同组样品共有的优势菌群,这与曹磊、刘振东等对不同产地牦牛曲拉的细菌群落结构进行比较,发现、为优势菌属的结论一致。Wafa等在对丹麦生产的奶酪的细菌多样性分析中发现,和均为奶酪中的优势菌属。Quigley等研究发现在爱尔兰奶酪中是优势菌属。乳酸菌按照其在乳制品中的作用,又可分为发酵剂乳酸菌和非发酵剂乳酸菌,发酵剂乳酸菌在牛乳中产酸速率高,促进凝乳。非发酵剂乳酸菌在奶酪生产过程中产酸作用弱或不产酸,主要起加快奶酪成熟、改善奶酪风味的作用。一些嗜温型乳酸菌如、等在奶酪成熟过程中作为产香菌,可加快成熟过程并产生风味物质,对奶酪的整体风味起修饰作用。乳酸菌在各种发酵乳制品中,所占比例均较大,在整个生产发酵过程中,对成品的质量与风味都起到了重要作用。李先胜等对采自西藏牧民家庭的曲拉进行分离纯化,筛选出的优势酵母菌为马克斯克鲁维酵母(s),该菌同样为青海酸牦牛奶中的优势菌群。马龙等发现、、是天然开菲尔粒中的优势酵母,这些酵母菌也广泛存在于各种奶酪中,在发酵过程中产生挥发性风味物质,影响着奶酪的风味。曲拉的自然发酵是一个复杂的过程,其中包括各种乳酸菌与酵母菌的共同作用,各种菌群间的协同或抑制作用广泛存在,造成曲拉的风味受到较大影响,如果发酵时的卫生条件较差,还有可能感染各种致病菌,导致其安全性下降。由于发酵过程受环境影响较大,不同批次的产品品质波动较大。自然发酵的乳制品具地方特色,深受当地群众喜爱,有较大的改进空间与市场前景。因此,对于自然发酵乳制品中的各种微生物的作用还需深入研究。
4 结 论
利用高通量测序技术,对西藏不同海拔地区的40 份曲拉样品的微生物群落结构进行分析。研究表明,不同海拔地区的曲拉样品中微生物群落结构有所差异。低海拔地区的曲拉样品中微生物多样性较高,中海拔地区的曲拉样品中微生物多样性较低,高海拔地区的曲拉样品中的微生物多样性最低。随着海拔高度上升,曲拉样品中的微生物多样性下降。
