遵义细菌型自然发酵干豆豉菌群结构及风味品质分析
2022-08-02聂黔丽王修俊刘林新陈颜红包欢欢何春霞
聂黔丽,王修俊*,刘林新,陈颜红,包欢欢,何春霞
(贵州大学酿酒与食品工程学院,贵州省发酵工程与生物制药重点实验室,贵州 贵阳 550025)
豆豉主要以黄豆或黑豆为原料,经过微生物群落作用发酵而成。因其独特风味及营养价值而成为我国四大传统发酵豆制品之一,长期食用还具有助消化、增强肝脏排毒、预防癌症等生理功能。细菌型豆豉主要在山东、贵州及云南等地较为常见,这类豆豉主要通过细菌在蛋白酶作用下分解蛋白质进行有氧发酵,利用食盐、高浓度白酒改变微生物生长环境减缓其生长速度,此外还通过添加姜粉、胡椒粉去豆腥增加发酵风味物质在无氧环境后熟发酵,干燥既得成品细菌型豆豉。遵义细菌型干豆豉作为遵义的一种特色美食,常与腊肉、折耳根搭配成为遵义地方特色菜,深受人们喜爱。
豆豉的质量、风味与发酵过程中的微生物密切相关,而目前遵义细菌型自然发酵豆豉主要以家庭式或者手工作坊式自然发酵,涉及的菌群多、菌群产物复杂,发酵主要贡献菌群无法控制,发酵出来的豆豉品质无法保障。针对这一问题,目前大多数研究都采用高通量测序对自然发酵豆豉的菌群结构及多样性进行分析,该技术不需分离纯化样品中的微生物,能够有效避免纯培养挑菌过程中的主观性,并且能客观反映样品中微生物群落结构和组成,因此被广泛应用于传统发酵食品的菌群研究中。赵文鹏等利用高通测序技术研究得到曲霉型豆豉发酵中细菌群落组成和演替规律;李薇等则对毛霉型豆豉的微生物群落结构及动态演替规律进行了分析;邓高文等以贵州水豆豉为研究对象,利用该技术对其细菌菌群结构及多样性进行研究。但是目前的研究大多集中于对霉菌型豆豉的研究,关于细菌型豆豉仍然较少,并且都只是侧重于分析豆豉的菌群结构及多样性,关于豆豉微生物菌落结构多样性及其与风味品质的相关性的研究甚少。
传统的遵义细菌型自然发酵豆豉,发酵周期长、发酵过程复杂,难以判断其发酵周期。因此本研究以发酵成熟的干豆豉为原料,依托高通量测序分析遵义细菌型豆豉样品的菌落结构,揭示遵义细菌型自然发酵干豆豉的微生物菌落结构多样性,并对遵义细菌型豆豉的风味品质进行分析,从而为遵义细菌型豆豉微生物菌群结构影响其风味物质形成的机理提供重要参考及为后续生产工艺提供理论依据。
1 材料与方法
1.1 材料与试剂
自然发酵干豆豉成品(以下简称豆豉) 遵义新嘉裕食品有限公司;土壤基因组提取试剂盒 美国Omega公司;Qubit 3.0 DNA检测试剂盒 美国Life公司;聚合酶链式反应(polymerase chain reaction,PCR)预混合液、Hieff NGS™基因分选磁珠 上海翊圣生物科技有限公司。
1.2 仪器与设备
Pico-21台式离心机 美国Thermo Fisher公司;ETC 811 PCR仪 北京东胜创新生物科技有限公司;Q32866Qubit3.0荧光计 美国Invitrogen公司;FR-1000凝胶成像系统 上海复日科技有限公司;DYCZ-21电泳槽、DYY-6C电泳仪 北京市六一仪器厂;TND03-H-H混匀型干式恒温器 深圳拓能达科技有限公司;ZHWY111B型恒温摇床 上海志城分析仪器有限公司;FA1004型电子精密天平 上海良平仪表有限公司;YX280B型手提式不锈钢蒸汽灭菌锅 上海三申医疗器械有限公司;LS-1F型超净化工作台 上海索普仪器有限公司;0.5~10 μL移液枪 罗德生物技术有限公司;SPX-250B-G型光照培养箱 上海博讯实业有限公司;78-1型磁力加热搅拌器 常州博远实验分析仪器厂;XHF-D高速匀浆机 宁波新芝股份有限公司;L-8800氨基酸分析仪 日本日立公司;50/30 μm CAR/PDMS/DVB手动固相微萃取装置 美国Supelco公司;HP6890/5975C气相色谱-质谱联用仪 美国安捷伦公司。
1.3 方法
1.3.1 高通量测序
1.3.1.1 样品预处理
随机取豆豉样品2.0 g,使用高温灭菌的剪刀将其剪碎后混合均匀,取0.5 g样品放入2.0 mL样品管,在组织破碎仪中进行破碎后提取,得到内切样品,命名为DC-1;将0.5 g样品加入无菌水混合均匀后离心留取适量沉淀后进行提取,得到表皮样品,命名DC-2。
1.3.1.2 豆豉样品DNA提取及PCR扩增
使用E.Z.N.AMag-Bind Soil DNA Kit提取试剂盒对样品中的DNA进行提取,提取方法参照试剂盒的说明进行,得到样品基因组DNA。
以Nobar_341F(CCTACGGGNGGCWGCAG)、Nobar_805R(CCTACGGGNGGCWGCAG)作为引物对细菌16S rRNA序列的V-V区域进行扩增。将PCR体系各组分于无菌离心管中混合均匀后短暂离心,之后将PCR管置于PCR仪中按照PCR条件进行扩增,最后将扩增产物用2%琼脂糖凝胶电泳检测文库大小,为了得到均匀的长簇效果和高质量的测序数据,使用Qubit 3.0荧光定量仪进行文库浓度测定,构建测序文库后委托生工生物工程(上海)股份有限公司于MiSeq平台测序。
1.3.1.3 多样性指数和系统发育分析
通过MiSeq得到含有barcode序列的双端序列数据,拼接、对比优化后质控过滤,参数为-O5-m50,使用cutadapt去除引物;TGGAATTCTCGGGTGCCAAGGAACTC再根据PE reads之间的overlap关系使用PEAR将成对reads拼接成一条序列;由barcode序列和引物序列从拼接对优化后相似度在97%相似度水平下的数据,利用RDP classifier、SINTAX、BLAST进行可操作分类单元(operational taxonomic units,OTU)分类学分析,以确定细菌型豆豉微生物分类信息。
1.3.2 自然发酵干豆豉风味品质分析
1.3.2.1 氨基酸测定
取粉末颗粒状豆豉样品1.00 g,按GB 5009.124ü 2016《食品中氨基酸的测定》方法,每组实验做3 个平行,结果取平均值。
1.3.2.2 游离脂肪酸测定
参照GB 5009.168ü2016《食品中脂肪酸的测定》,对总离子流图(total ion chromatogram,TIC)中的各峰经质谱计算机数据系统检索及核对Nist17和Wiley275标准质谱图,确定挥发性化学成分,用峰面积归一化法测定各化学成分的相对含量。
1.3.2.3 挥发性物质测定
将豆豉样品混匀剪碎,称取充分混匀豆豉样品2.0 g,通过气相色谱-质谱联用测定豆豉挥发性物质。
1.4 数据处理
通过mothur软件进行rarefaction分析,Excel 2019对其余数据进行处理。利用R软件、Excel 2019、Python的ete3 package软件分别绘制稀释曲线、相对丰度柱形图、系统树状图。
2 结果与分析
2.1 高通量测序结果
2.1.1 豆豉序列分析
经Illumina高通量技术对样品16S rRNA的V-V区域进行测序并对测序结果进行筛选后,共得到424 631 条长度大于400 bp的有效序列,细菌及真菌样品OTU覆盖率高达99%,表明豆豉样品中微生物种类几乎都被检测到,完全能够代表样本中细菌的真实情况;样品平均Chao指数为245.24,有效序列有133 587.5 条,OTU数为81,说明测序结果覆盖全面,长度大于分析标准序列,可用于序列测定分析(表1)。在OTU划分的基础上,按照97%相似性水平下对非重复序列(不含单序列)进行OTU聚类注释,再通过RDP和SINTAX将OTU代表序列鉴定后得到,豆豉中的微生物被鉴定为7 个门,15 个纲,20 个目,30 个科,44 个属。
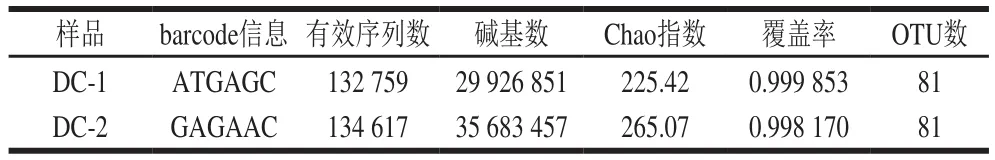
表1 豆豉序列数据Table 1 Bacterial sequencing data for douchi samples
2.1.2 豆豉的细菌多样性指数分析
基于QIIME,以样品在不同测序数量时的微生物多样性指数构建稀释曲线,从而反映样品在不同测序数量时的微生物多样性。曲线越平缓说明数据样本量越充足,由图1可看出,豆豉样品序列数大于10 000左右时,多样性指数稀释性曲线趋于平缓,OTU数目不再上升,达到饱和。表明测序量合理,并且随着序列数的增加豆豉样品中细菌多样性不会有太大改变,足以反映豆豉样品中大部分的微生物多样性。
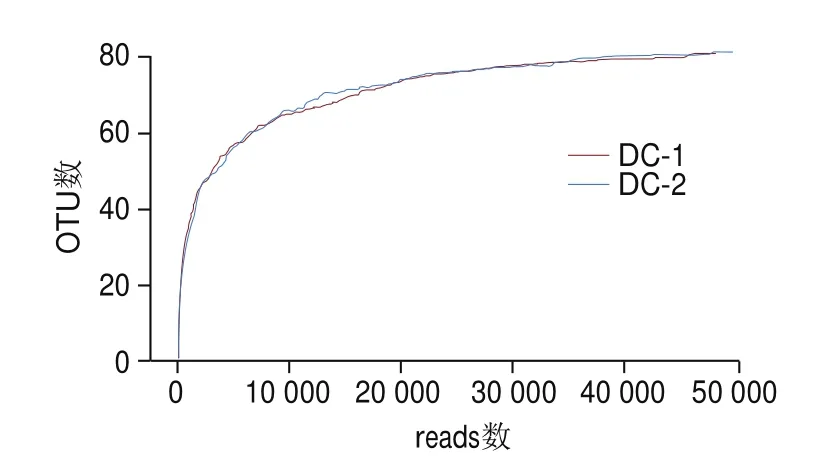
图1 细菌α多样性指数稀释性曲线图Fig.1 Rarefaction curves of bacterial α-index
2.1.3 豆豉的科、属水平相对丰度分析

由图2可知,豆豉的细菌在科水平上细菌种类有杆菌科(Bacillacea)、芽孢杆菌科-1(Paenibacillaceae-1)、球菌科(Planococcaceae)、拟杆菌科(Paenibacillaceae-2)、莫拉氏菌科(Moraxellaceae)、乳杆菌科(Lactobacillaceae)、肠球菌科(Enterococcaceae)及其他菌株,从科水平上分析豆豉中芽孢杆菌相对丰度接近50%,说明该地区豆豉主要贡献菌群为芽孢杆菌科。在属水平上,豆豉样品的优势菌属有芽孢杆菌属()、拟杆菌属()、梭形杆菌属()、短芽孢杆菌属()、无芽孢杆菌属()、厌氧杆菌属()、乳杆菌属()、肠球菌属()、未分类芽孢杆菌属(unclassified_Paenibacillaceae),其平均相对丰度为41.01%、27.23%、7.09%、8.44%、6.6%、2.02%、2.12%、1.58%、1.16%。可见遵义细菌型豆豉中杆菌属芽孢杆菌、拟杆菌、短杆菌占据绝对优势,其综合比例占比高达92.39%,含少量的乳杆菌。
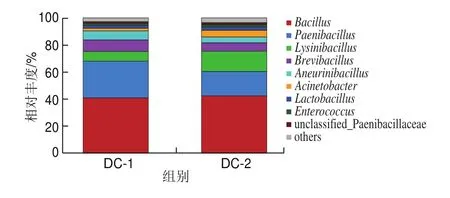
图2 细菌在科水平和属水平相对丰度柱状图Fig.2 Relative abundance of bacteria at the family and genus levels
2.1.4 豆豉系统发育菌株种占比分析
从图3可看出,豆豉菌群隶属于两个门,分别为厚壁菌门(Firmicutes)和变形菌门(Proteobacteria),相对含量94.33%和5.39%。其核心优势菌群隶属于厚壁菌门的杆菌纲,而芽孢杆菌科在该地区干豆豉中占绝对优势,其相对丰度为41.85%。另外虽然乳杆菌在科水平上的相对丰度仅为2.23%,但是其对豆豉的滋味有重要影响。董蕴等在对细菌类群对豆豉品质的研究中发现,酸味是不同豆豉之间形成差异的最大感官指标,并得到乳杆菌与豆豉的酸味呈正相关;陈浩等研究发现,添加了乳杆菌发酵的豆豉,其产品理化特性及挥发性物质均优于未添加乳杆菌组;Liu Chenjian等在云南细菌型豆豉中发现大量乳杆菌,且是该地区豆豉发风味形成的主要贡献者;另外在李晓然等对云南地区细菌型豆豉的菌群结构研究中,乳杆菌属相对丰度占绝对优势,在豆豉发酵中起重要作用,其次10%左右的芽孢杆菌也是该地区豆豉发酵的重要菌;而宋园亮在乳杆菌和枯草芽孢杆菌混合发酵豆豉的研究中发现,植物乳杆菌能显著减少由纯种枯草芽孢杆菌发酵豆豉所产生的氨味,使豆豉具有浓厚的酯香,在感官评价中接受度最好。另外在郭娅、邓高文、黄晓润等对贵州地区特色水豆豉菌群结构的分析中,均未检出乳杆菌,这可能与豆豉的类型有关。因此本研究可以得出,遵义细菌型干豆豉主要由芽孢杆菌和乳杆菌共同作用,协同发酵出具有独特酱香的遵义细菌型干豆豉。
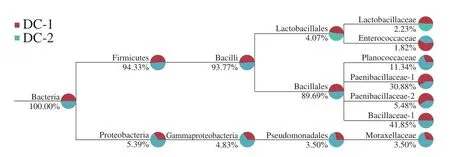
图3 样品系统组成树状图Fig.3 Dendrogram of bacterial communities in douchi samples
2.2 豆豉风味品质分析
2.2.1 豆豉游离氨基酸分析
由表2、图4可知,豆豉中总氨基酸含量为24.828 mg/g,共检测16 种氨基酸,均包括人体所需的6 种必需氨基酸。不同菌株发酵豆豉对豆豉中氨基酸种类及含量有显著影响,这主要在与不同微生物的发酵周期不同,进而影响蛋白质水解程度,而发酵豆制品中的鲜味和苦味物质主要是由于蛋白质水解产生,当不同滋味的物质在一起时会发生味道的相消、相乘等作用,从而形成了干豆豉独特的滋味。由表2可以看到,豆豉呈现鲜味氨基酸分别为0.198 mg/g和4.147 mg/g,占0.79%及17.80%;甜味氨基酸苏氨酸、丝氨酸、甘氨酸、丙氨酸及组氨酸含量总和占总氨基酸比率为4.67%;苦味氨基酸缬氨酸、酪氨酸和精氨酸的总和占总氨基酸含量的51.65%,鲜、甜、苦3 种滋味相互作用,呈现了遵义细菌型干豆豉独特的滋味。
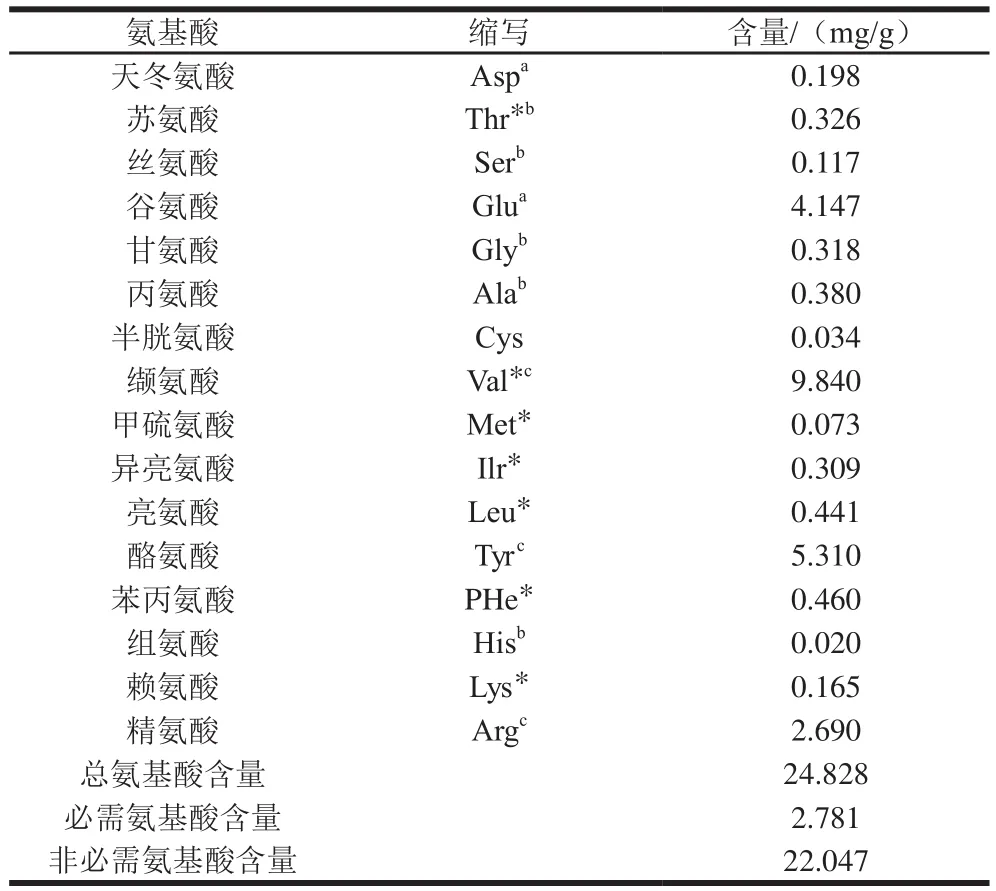
表2 豆豉游离氨基酸组成变化Table 2 Free amino acid composition of douchi

图4 豆豉游离氨基酸分离谱图Fig.4 Chromatogram showing the separation of free amino acids in douchi
2.2.2 豆豉游离脂肪酸分析
根据图5和表3可知,豆豉中共检测出26 种游离脂肪酸,其中饱和脂肪酸15 种,硬脂酸含量最高,占总脂肪酸的47.64%。脂肪酸在豆豉风味形成过程中作为重要的前提物质对细菌型发酵豆豉的营养和香气成分有重要影响,例如硬脂酸、棕榈酸等可以在多种酶的作用下发生氧化产生酮类等风味物质;而饱和脂肪酸有调节人体免疫能力、促进细胞分化等作用,当摄入不足会对人体健康产生影响,尤其是硬脂酸不但是-3系多不饱和脂肪脂肪酸重要补充来源,而且还可以改善豆豉口感,是众多风味物质的前提发酵物质。此外该豆豉中不饱和脂肪酸占总脂肪酸含量的25.26%,其中-3系多不饱和脂肪酸亚麻酸占不饱和脂肪酸总量的93.09%,-6系多不饱和脂肪酸亚油酸占0.929%。不饱和脂肪酸具有降低胆固醇、改善癌症患者免疫能力和促进癌细胞死亡、抑制癌细胞生长及产后调剂等多种作用,其中亚麻酸、亚油酸等含量可以作为影响食品营养价值的重要参考标准之一,因此这也是豆豉具有生理保健功能的重要来源之一。

图5 豆豉游离脂肪酸TICFig.5 TIC chromatogram of free fatty acids in douchi

表3 豆豉游离脂肪酸组成变化Table 3 Free fatty acid composition of douchi
2.2.3 豆豉挥发性物质分析

续表4

续表4
由图6、表4可知,自然发酵豆豉由于发酵菌株不确定性和多样性,挥发性物质种类丰富,共检测出91 种挥发性物质,其中酸类物质、酮类物质及烯烃类物质种类最多;从挥发性物质相对含量上看,该豆豉酸类物质最高达到44.529%,其次是含氮类物质12.386%,吡嗪类物质占10.622%,醇类物质占0.995%。

图6 挥发性物质的TICFig.6 TIC chromatogram of volatile substances in douchi
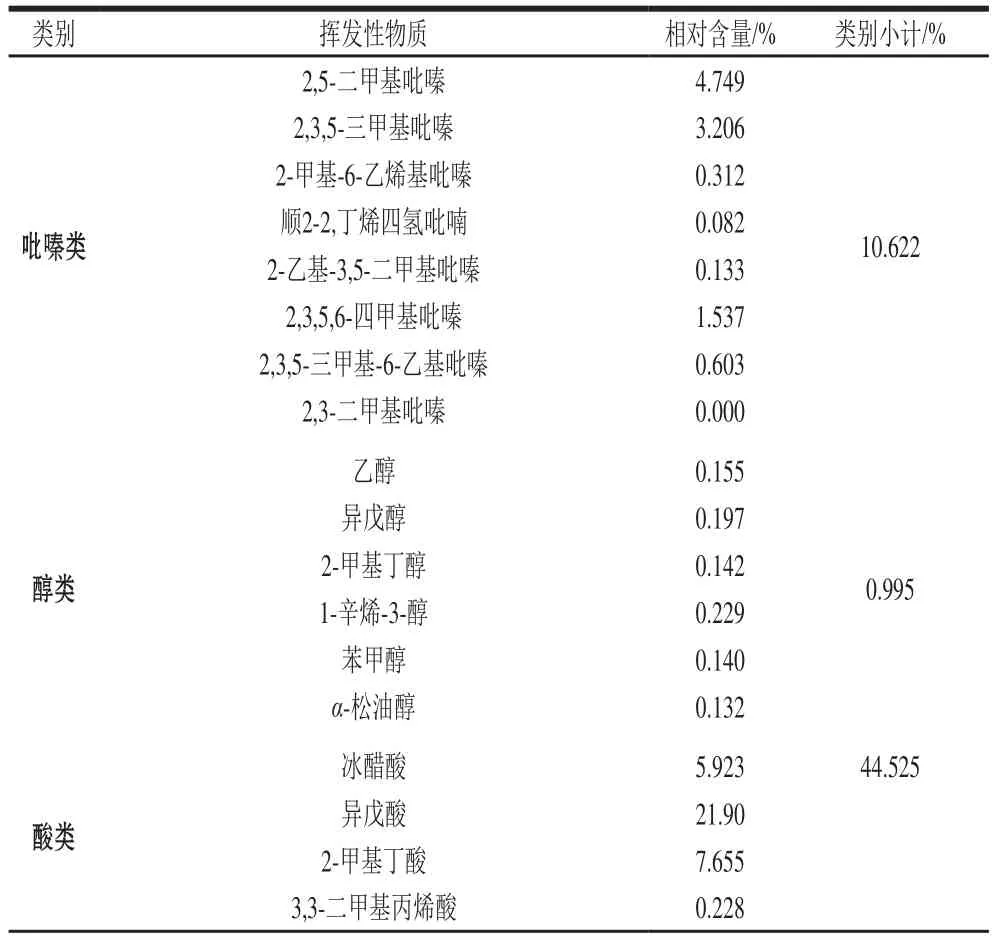
表4 豆豉挥发性物质相对含量Table 4 Relative contents of volatile substances in douchi
吡嗪类物质含量在该豆豉中仅次于酸类物质,是其风味物质的主要成分之一。其中2,5-二甲基吡嗪、2,3,5-三甲基吡嗪、2,3,5,6-四甲基吡嗪阈值极低,会产生可可香气、烤面包香气及令人愉悦的烤花生香气;这类物质主要通过影响硫代谢、氨基酸代谢从而对该豆豉风味产生极大影响。
醇类、酮类及酯类物质在该豆豉中含量较少,但是对其风味的影响也是极大的。例如醇类物质赋予了豆豉典型的豉香酱香风味,其中异戊醇、2-甲基丁醇及1-辛烯-3-醇对豆豉形成特有酱香风味有显著贡献,苯甲醇有苦杏仁和浓郁的樱桃香味。酮类化合物一般呈果香风味,由脂肪酸氧化作用后,其阈值低且增香能力强。在该豆豉中酮类化合物占比4.926%,2-丁酮、2-甲基-3-戊酮、3-甲基-2-戊酮、4-甲基-3-己酮、6-甲基-3-庚酮、6-甲基-2-庚酮、2-壬酮、苯基丙酮等物质对豆豉风味物质具有较高贡献度。
结合对遵义细菌型豆豉的高通量测序结果中芽孢杆菌和乳杆菌为豆豉发酵过程的核心菌群,而有研究报道,豆豉中挥发性物质中酸类物质大多由乳杆菌发酵产生,产吡嗪类物质的微生物多数为枯草芽孢杆菌,此外醇类、酯类等的大部分化合物由枯草芽孢杆菌和乳杆菌共同产生,由此可见遵义细菌型干豆豉的芽孢杆菌及乳杆菌对其风味有着极大影响。
3 结 论
结合遵义细菌型干豆豉的稀释曲线及相对丰度图可以看出,该地区干豆豉的细菌组成比较丰富:共检出7 个门、15 个纲、20 个目、30 个科、44 个属;杆菌属芽孢杆菌、拟杆菌、短杆菌为该豆豉的主要贡献菌群,在相对丰度中占据绝对优势,少量的乳杆菌在其发酵过程中也有重要作用,协同发酵出具有独特豉香的遵义细菌型干豆豉。此外对该干豆豉风味品质分析得到,该豆豉中共存在16 种氨基酸,均包括人体所需的6 种必需氨基酸,总氨基酸含量为24.828 mg/g;共检测出26 种游离脂肪酸,其中饱和脂肪酸15 种,不饱和脂肪酸11 种;利用气相色谱-质谱联用技术从豆豉中检测出了91 种挥发性物质,以主要影响豆豉风味的酯类、酮类、酸类、醇类及吡嗪类化学物质作为参考对主要贡献香气成分相对含量及阈值进行比较,酸类物质含量最高,其次是含氮类物质,醇、酮及酯类物质含量较少。本研究促进了遵义细菌型自然发酵干豆豉微生物菌群结构和风味品质相关性的基础研究,在一定程度验证了遵义细菌型豆豉的风味主要由芽孢杆菌和乳杆菌共同作用产生,从而为遵义型细菌型豆豉的后续生产及直投式复合发酵菌剂的研究提供理论依据。
