基于亲水色谱-电雾式检测器-电喷雾-飞行时间质谱技术的西洋参不同部位单糖组成的对比分析
2022-08-01赵志国张敏敏李月王岱杰杨国红王晓赵恒强
赵志国,张敏敏,李月,王岱杰,杨国红,王晓,赵恒强*
(齐鲁工业大学(山东省科学院) a.山东省分析测试中心;b.药学院,山东 济南 250014)
西洋参别名花旗参、洋参、美国人参等,是五加科人参属多年生草本植物,原产于美国和加拿大,为世界名贵药材[1]。近年来,我国山东、陕西、东北三省等地均已引种成功,为解决西洋参的药源开辟了新的途径。西洋参多糖是西洋参中一类具有特殊生物活性的物质,在西洋参根中含量达10%左右,具有明确的抗衰老、抗肿瘤、调节免疫、调节血糖、调控造血、抗微生物、提高免疫力等作用[2-6]。不同的生物学活性与多糖的结构存在密切联系,而各单糖的种类与比例对进一步探究多糖的物理化学性质、结构和构效关系至关重要[7]。多糖的单糖组成是反映多糖结构和活性的重要参数,对于多糖的结构表征及进一步开发利用具有重要意义。Cheong等[8]采用化学衍生气相色谱-质谱联用仪(GC-MS)法测定了西洋参、人参和三七多糖的单糖组成,发现其均由鼠李糖、阿拉伯糖、半乳糖醛酸、甘露糖、葡萄糖和半乳糖组成,西洋参和人参中阿拉伯糖、半乳糖醛酸、葡萄糖和半乳糖含量高于鼠李糖和甘露糖,而三七中含有较多的葡萄糖、半乳糖和阿拉伯糖。另外,西洋参的主要药用部位是主根,而芦头和参须则往往弃之不用。对西洋参不同药用部位化学成分进行对比分析,对进一步提高西洋参资源利用率具有重要意义。目前为止,有关西洋参不同部位人参皂苷的对比研究报道较多[9-11],而有关其单糖组成的对比研究未见报道。
液相色谱法是单糖组成分析较常用的方法[12],但由于单糖的极性较强,在普通反相色谱柱上难以保留且没有紫外吸收,电离响应弱,一般需要经过衍生化之后再接入紫外检测器或质谱进行分析[13-15]。而亲水色谱法(hydrophilic interaction liquid chromatography,HILIC)则是以强极性材料为固定相,对水溶性和极性成分具有较好的吸附和分离效果,对糖类成分的分离分析表现良好[16-17]。电喷雾式检测器(charged aerosol detector,CAD)具有灵敏度高、适合梯度洗脱、特别适合没有紫外吸收成分的检测等特点[18-20]。本课题组在前期开展了基于HILIC-CAD技术的单糖组成分析[21],表现出良好的应用潜力。
本研究建立了亲水色谱-电雾式检测器-电喷雾-飞行时间质谱(HILIC-CAD-ESI-TOF/MS)测定西洋参多糖的单糖组成的方法,并用于西洋参不同部位单糖组成的对比分析,以期为西洋参的单糖组成分析及不同药用部位的开发利用提供方法和数据参考。
1 仪器与材料
1.1 仪器
色谱柱为Waters Xbridge Amide柱(4.6 mm×250 mm,5 μm)(美国沃特世公司);Bruker Impact II ESI-TOF-MS质谱仪(德国布鲁克公司);赛默飞世尔Ultimate 3000高效液相色谱仪(美国赛默飞世尔公司);SBL-10DT型恒温超声波清洗机(宁波新芝生物科技股份有限公司);TG16-WS台式高速离心机(湖南湘仪实验室仪器开发有限公司);十万分之一电子分析天平(德国赛多利斯公司)。
1.2 材料
对照品:葡萄糖(批号S10S9I69833)、阿拉伯糖(批号AJ0702FA14)、鼠李糖(批号SJ0715GA13)、果糖(批号S05A6G3)、木糖(批号B02M6W1)、岩藻糖(批号TM0312QB14)、甘露糖(批号AJ0603LA14)、葡萄糖醛酸(批号K14J7S9017)、半乳糖醛酸(批号AJ0603LA14),均购于上海源叶生物科技有限公司(纯度大于98%)。乙腈、乙酸铵(瑞典欧森巴克化学公司,色谱纯),95%乙醇(山东禹王实业有限公司化工分公司,分析纯),三氟乙酸(天津市科密欧化学试剂有限公司,分析纯),其余试剂均为分析纯,实验用水为娃哈哈纯净水,西洋参样品均来自山东文登西洋参种植基地,其中,ZG1-10为主根,LT 1-5为芦头,SX1-5为参须。
1.3 多糖的提取
将西洋参置于真空干燥箱中(60 ℃)烘干,将不同部位分开,粉碎,过筛。准确称取0.5 g样品粉末置于带塞三角瓶中,加入30 mL纯净水,于超声提取器中(功率300 W,温度90 ℃)提取40 min,放冷15 min,离心10 min(6 000 r/min),抽滤,滤液定容至30 mL。采用Sevage法除蛋白,反复萃取直至无蛋白析出。滤液加适量的95%乙醇,使乙醇的最终浓度为80%,放于冰箱中(12 h),用于沉淀粗多糖,离心15 min(6 000 r/min),上清液倒掉,沉淀物依次经95%乙醇、无水乙醇、丙酮、乙醚多次洗涤,之后水浴蒸干,热水复溶,再次离心15 min(6 000 r/min),取上清液,备用。
1.4 多糖的完全水解
参考文献[21]的方法并作适当修改,吸取700 μL的多糖溶液于水解管中,加入5.0 mol/L的三氟乙酸(trifluoroacetic acid,TFA)溶液700 μL,加盖密封后超声(温度90 ℃,功率300 W)酸解2 h。酸解产物用氮气吹干并用甲醇多次洗涤,以除去TFA残留。
1.5 对照品溶液的配制
分别精密称取木糖、果糖、葡萄糖、甘露糖、岩藻糖、鼠李糖、阿拉伯糖、半乳糖醛酸和葡萄糖醛酸对照品适量,各置于1 mL容量瓶中,作为对照品溶液。
1.6 供试品溶液的配制
1.7 色谱条件
Waters Xbridge Amide柱(4.6 mm×250 mm,5 μm,美国沃特世公司),流动相A为乙酸铵水溶液,B为乙腈溶液。洗脱梯度0~31 min,90%~75%B。流速0.8 mL/min;进样量10 μL;柱温40 °C。CAD检测参数:气体源为N2,压力8.8 kPa,Filter 2.0 sec,雾化器温度60 °C。混合对照品及样品的UPLC-CAD色谱图见图1。
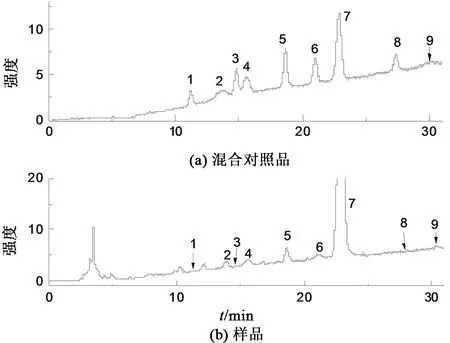
注:1—鼠李糖; 2—岩藻糖; 3—木糖; 4—阿拉伯糖;5—果糖;6—甘露糖;7—葡萄糖;8—葡萄糖醛酸;9—半乳糖醛酸。图1 混合对照品和样品的UPLC-CAD色谱图Fig.1 UPLC-CAD of the standards and sample
1.8 质谱条件
高分辨飞行时间质谱电喷雾正、负离子模式;质量扫描范围m/z100~1 500;干燥气流速8.0 L/min;干燥气温度200 °C;毛细管电压2.5 kV;喷雾气压0.2 MPa;碰撞能量8.0 eV;传输时间300 μs。根据各化合物在负离子模式下产生的母离子、子离子的精确分子量信息,结合对照品和参考文献,分别对其进行定性鉴别,结果见表1。
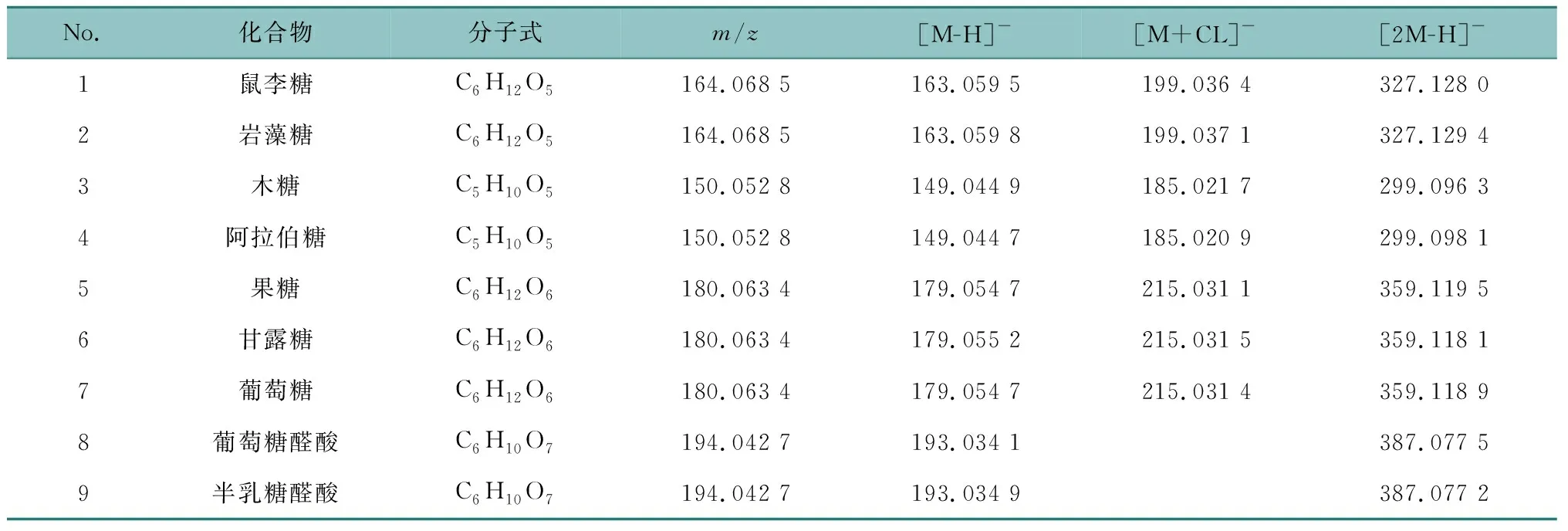
表1 化合物的ESI-TOF/MS精确质量测量结果Table 1 Accurate mass measurements of compounds obtained using ESI-TOF/MS
1.9 数据处理
MS/MS方法数据的分析在Bruker Impact II ESI-TOF-MS质谱仪软件上进行处理。实验数据分别采用Excel 2010、SPSS 17.0软件和Origin 7.5软件进行处理和绘图分析。
2 结果与讨论
2.1 方法学考察
2.1.1 标准曲线与检出限
分别吸取配好的9种对照品溶液适量至容量瓶中,充分混匀后稀释至不同浓度,按1.7项下色谱条件进样分析。以各对照品质量浓度的对数为横坐标(X),以峰面积的对数为纵坐标(Y),绘制标准曲线,结果见表2。由表2可知,9种成分标准曲线的相关系数均大于0.999 0,说明其线性关系良好。检出限在0.03~0.13 μg/mL之间,定量限在0.10~0.42 μg/mL之间,说明方法灵敏度较高。
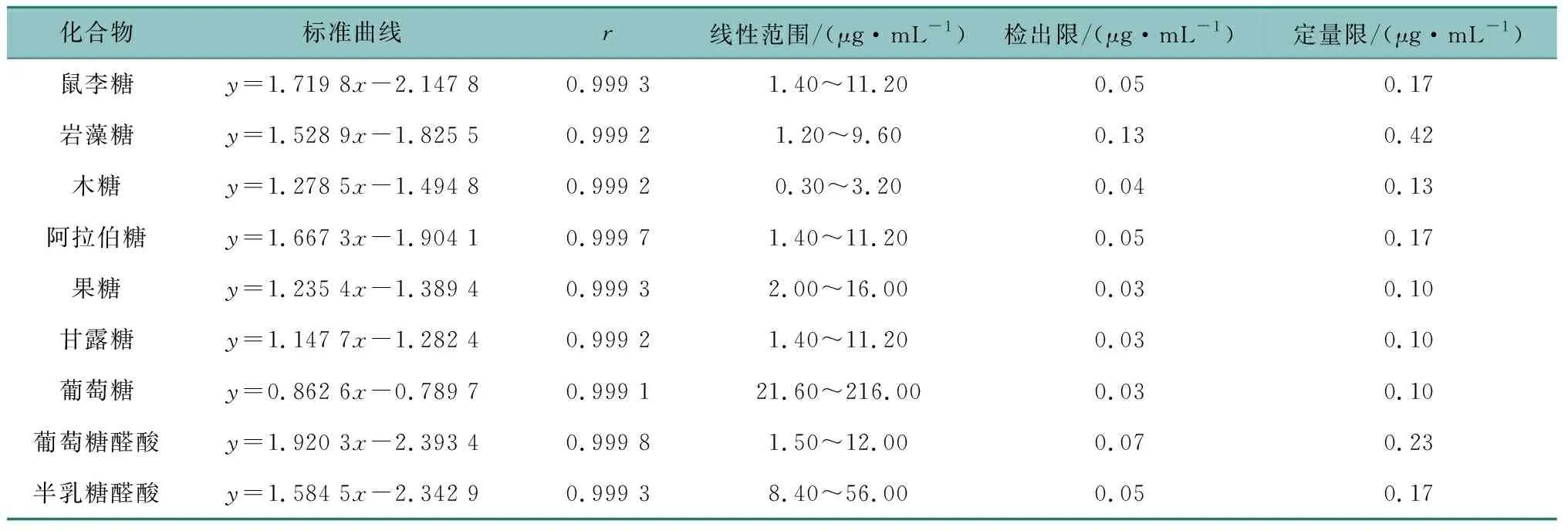
表2 线性关系考察Table 2 The results of calibration
2.1.2 精密度试验
取同一供试品溶液,按1.7项下色谱条件连续进样6次,测得9种成分的保留时间相对标准偏差(RSD)分别为0.24%、0.27%、0.19%、0.24%、0.12%、0.14%、0.08%、0.07%、0.28%,均小于1%;峰面积RSD分别为4.08%、3.00%、2.65%、2.73%、2.63%、2.71%、2.21%、2.53%、2.96%,均小于5%。表明仪器精密度良好。
2.1.3 重复性试验
取同一批次多糖样品,按1.6项下方法制成6份供试品溶液,按1.7项下色谱条件进行测定,测得9种成分峰的保留时间RSD分别为0.06%、0.32%、0.16%、0.20%、0.10%、0.06%、0.08%、0.06%、0.28%,均小于1%;峰面积RSD分别为4.30%、3.47%、4.00%、3.85%、3.35%、1.76%、1.43%、1.80%、3.76%,均小于5%。表明方法重复性良好。
2.1.4 稳定性试验
取同一供试品溶液分别于0、3、6、12、18、24 h按1.7项下色谱条件进样分析,测得9种成分的保留时间RSD分别为0.20%、0.51%、0.27%、0.19%、0.15%、0.20%、0.15%、0.15%、0.09%,均小于1%;峰面积RSD分别为2.46%、3.38%、2.62%、2.17%、1.58%、2.35%、1.15%、3.23%、2.14%,均小于5%。表明供试品溶液在24 h内稳定性良好。
2.1.5 加样回收率试验
精密称取已知含量的同一批次多糖样品3份,分别精密加入不同量的鼠李糖、岩藻糖、木糖、阿拉伯糖、甘露糖、葡萄糖、果糖、葡萄糖醛酸、半乳糖醛酸对照品适量,按1.4项下方法进行水解,并按1.6项下方法制成供试品溶液后,按1.7项下色谱条件进行分析检测,计算加样回收率(表3),9种成分的加样回收率在94.17%~107.15%之间,具有较好的方法准确性。
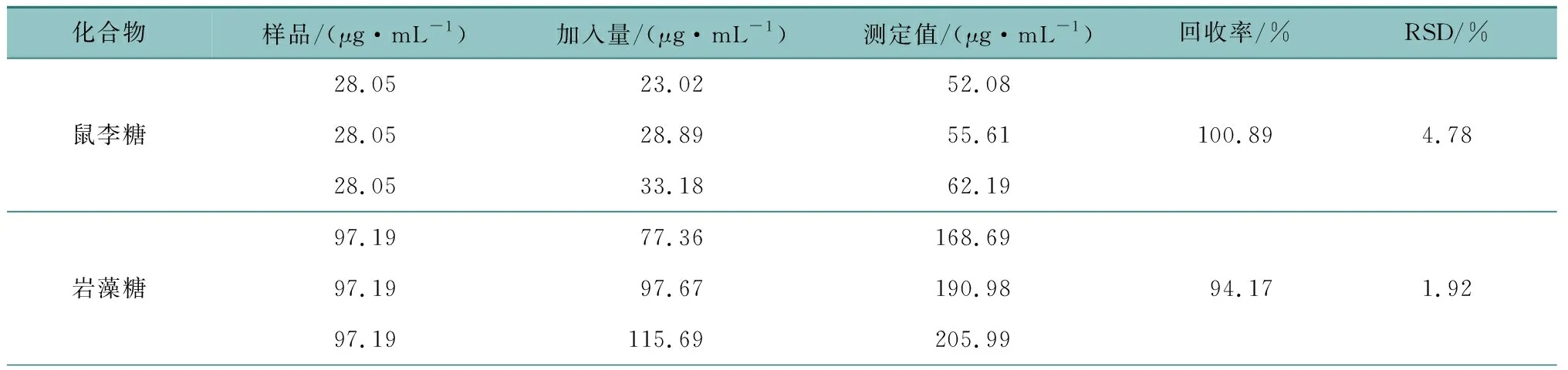
表3 加样回收率试验(n=3)Table 3 Sample recovery test (n=3)
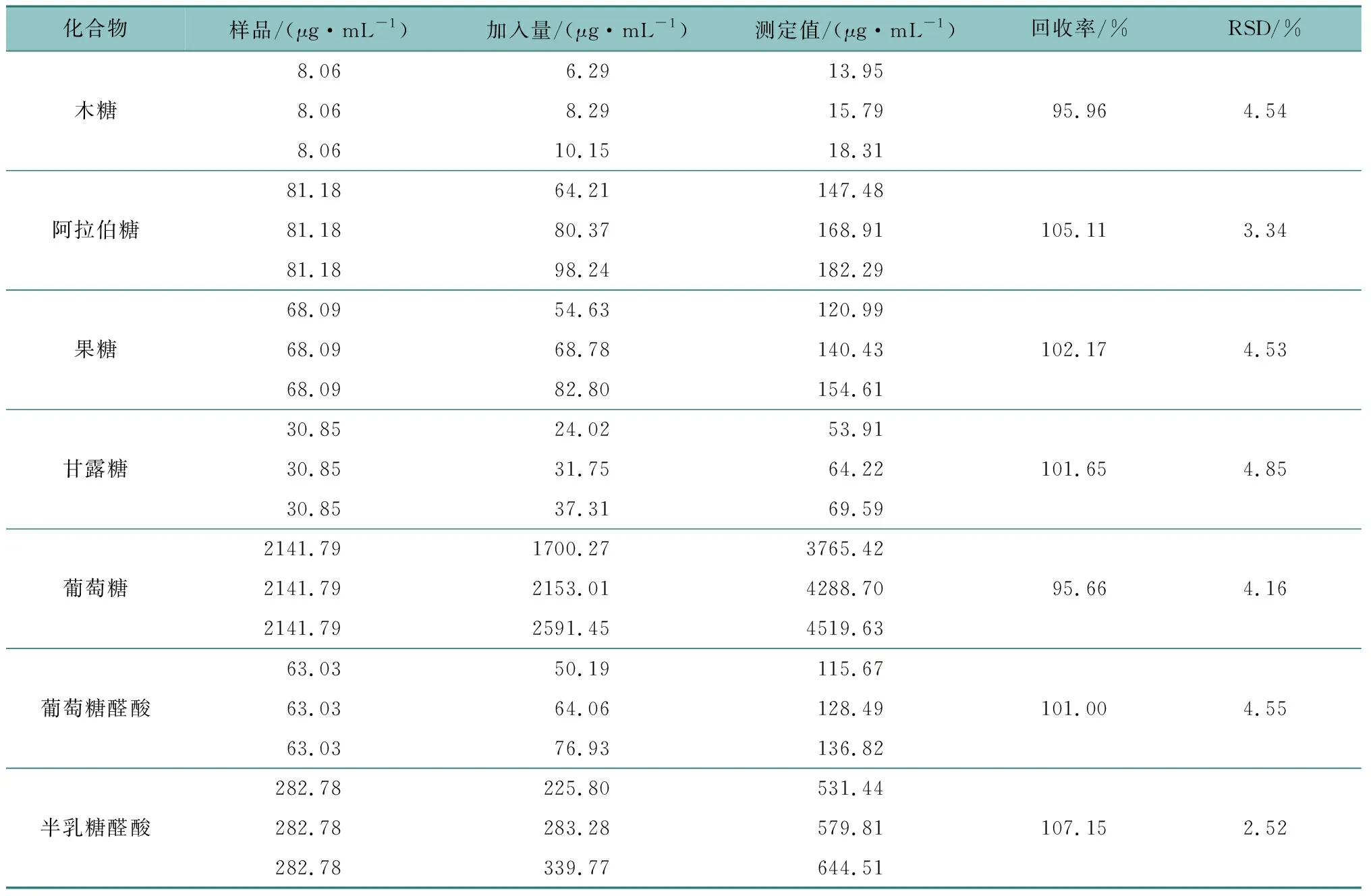
表3(续)
2.2 不同部位单糖组成
采用本试验方法对提取的西洋参多糖样品经1.4项下方法水解后,按1.6项下方法制成供试品溶液,根据1.7项下色谱条件分别测定20批次样品中9种成分的含量。西洋参各部位(主根、芦头、参须)多糖水解产物均由鼠李糖、岩藻糖、木糖、阿拉伯糖、果糖、甘露糖、葡萄糖、葡萄糖醛酸、半乳糖醛酸等共同组成(图2),其中葡萄糖的含量最高,各部位平均含量依次为(2.123±0.070)mg/g、(1.237±0.245)mg/g、(0.805±0.095)mg/g。其次是半乳糖醛酸,各部位平均含量依次为(0.322±0.045)mg/g、(0.376±0.096)mg/g、(0.280±0.030)mg/g。木糖含量最低,各部位平均含量依次为(0.008±0.001)mg/g、(0.008±0.001)mg/g、(0.008±0.002)mg/g。
西洋参不同部位中各单糖含量分布存在一定特征性。主根中葡萄糖含量较高,其平均值为(2.123±0.070)mg/g;芦头中鼠李糖、阿拉伯糖、果糖、甘露糖、葡萄糖醛酸、半乳糖醛酸含量较高,其平均值分别为(0.037±0.006)mg/g、(0.179±0.023)mg/g、(0.158±0.028)mg/g、(0.036±0.006)mg/g、(0.069±0.007)mg/g、(0.376±0.096)mg/g;参须中岩藻糖含量较高,其平均值为(0.120±0.005)mg/g。不同部位中9种单糖含量见图2所示。

图2 西洋参不同部位单糖组成Fig.2 Composition of monosaccharides in the different parts of Panacis Quinquefolii Radix
2.3 主成分分析
采用SPSS等数据分析软件,以西洋参中9个化合物的含量测定结果作为变量,对西洋参不同部位进行主成分分析(principal component analysis,PCA),以综合评析这3个不同部位的差异性。
通过SPSS数据处理系统对西洋参3个不同部位中的9个成分进行PCA处理,以此为依据对西洋参不同部位进行综合评析。根据西洋参主成分矩阵结果,建立西洋参质量评价模型,计算每个样本的综合评价得分,通过综合评价得分对比可以看出西洋参的主根、芦头、参须不同部位之间可以明显地区分。说明西洋参不同部位的单糖组成存在一定的差异,有望作为化学标记物用于其区分判别,详见图3。
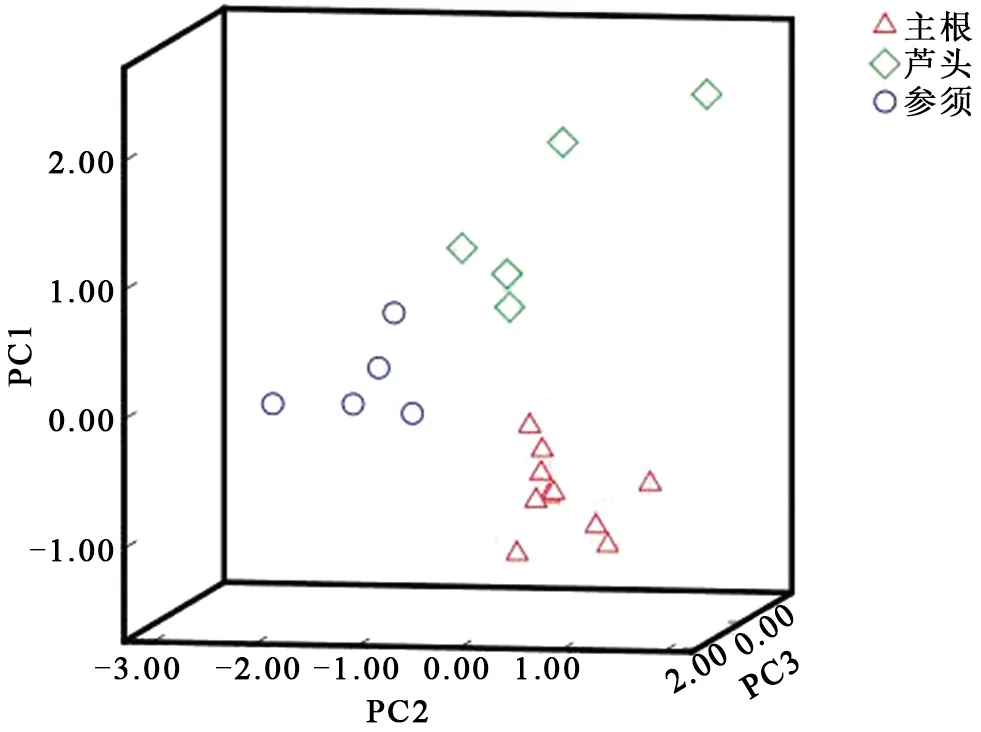
图3 西洋参不同部位的PCA三维图谱Fig.3 Three-dimensional map of PCA analysis for the different parts of Panax quinquefolii Radix
3 结论
本研究建立了亲水色谱-电雾式检测器-电喷雾-飞行时间质谱法分析测定西洋参多糖单糖组成的方法,结果表明,该方法样品处理速度快、灵敏度较高。对西洋参各部位单糖组成的分析检测,发现其不同部位多糖均由鼠李糖、岩藻糖、木糖、阿拉伯糖、果糖、甘露糖、葡萄糖、葡萄糖醛酸、半乳糖醛酸等组成,但不同部位含量却存在一定的差异,主根中葡萄糖含量较高,芦头中鼠李糖、阿拉伯糖、果糖、甘露糖、葡萄糖醛酸、半乳糖醛酸含量较高,参须中岩藻糖含量较高。采用单糖含量结合PCA分析可以实现对西洋参不同部位的正确区分。本研究为西洋参多糖的单糖组成分析提供了方法和技术支持,并可为不同药用部位的开发利用提供依据。
