基于超分子自组装策略定性和定量检测奶粉中的三聚氰胺
2022-08-01察爽爽牛金盆刘川枫严杰朱敏张雯胡明友
察爽爽,牛金盆,刘川枫,严杰,朱敏,张雯,胡明友
西安交通大学化学学院,西安 710049
1 引言
在2008年曝出的毒奶粉事件中,有数万婴幼儿因奶粉中掺杂三聚氰胺而受到肾损伤[1,2]。三聚氰胺虽然只有低毒性,但长期摄入,会形成无法溶解的三聚氰胺氰尿酸(氰尿酸又称三聚氰酸,可通过三聚氰胺在人体内代谢产生)沉淀,进而导致严重的肾结石[3–5]。国家标准(GB/T 22388–2008)规定的高效液相色谱法[6,7]、气相色谱-质谱联用法[8,9]、液相色谱-质谱联用法[10]等检测原料乳与乳制品中三聚氰胺含量的方法优点明显:检测限低,测量结果准确;但缺点也相当突出:样品的前处理十分复杂且耗时较长,检测费用高。而这一实验设计使用分光光度法测定吸光度值,快速检测出三聚氰胺含量,原料易得,仪器造价低,该法易在实验室及基层普及,具有一定的实际应用价值。
1987年诺贝尔化学奖得主J.M.Lehn在获奖演讲中首次提出“超分子化学”的概念[11]。超分子化学是研究多个分子通过非共价键作用形成的功能体系的科学,即通过分子间相互作用,实现分子间的识别和自组装[12–14]。本实验将超分子自组装的方法引入实验教学中,利用三聚氰胺和氰尿酸形成的超分子对亚甲基蓝的包裹作用,采用测量吸光度的方法,对奶粉中的三聚氰胺进行定性和定量检测。操作过程简单,现象明显,适合教学实验,除涉及基础实验基本操作外,加入红外光谱、高效液相色谱等多种表征手段,使学生更好地适应现代科学表征技术的发展,激发学生兴趣。同时实验内容可模块化选择进行,满足不同层次的实验教学需求。
2 实验部分
2.1 实验原理
分子自组装即利用分子识别,通过非共价作用形成具有特定排列顺序的分子聚合体[3,15]。三聚氰胺与氰尿酸通过分子识别,在氢键诱导下即可实现自组装形成超分子,如图1所示[16]。

图1 三聚氰胺与氰尿酸形成交联超分子[16]
在该过程中,若自组装以氢键为主要驱动力,则任何破坏或者促进氢键作用的化合物都会改变组分的自组装能力[17,18],亚甲基蓝作为常见的指示剂,其自身的强极性会诱导三聚氰胺与氰尿酸进行自组装交联(图2)。在该体系中,亚甲基蓝被包裹于超分子中,从而导致颜色变化明显。而不同浓度的三聚氰胺溶液产生的自组装体系对亚甲基蓝的包裹情况不同,导致反应离心后得到的清液中亚甲基蓝的浓度不同,进而导致吸光度的不同。研究不同浓度三聚氰胺反应体系吸光度的变化,绘制吸光度曲线,可达到对奶粉中三聚氰胺定性定量检测的目的。

图2 亚甲基蓝对交联超分子形态的影响
2.2 试剂或材料
实验所用试剂详见表1。

表1 实验试剂表
2.3 仪器和表征方法
实验所用仪器详见表2。
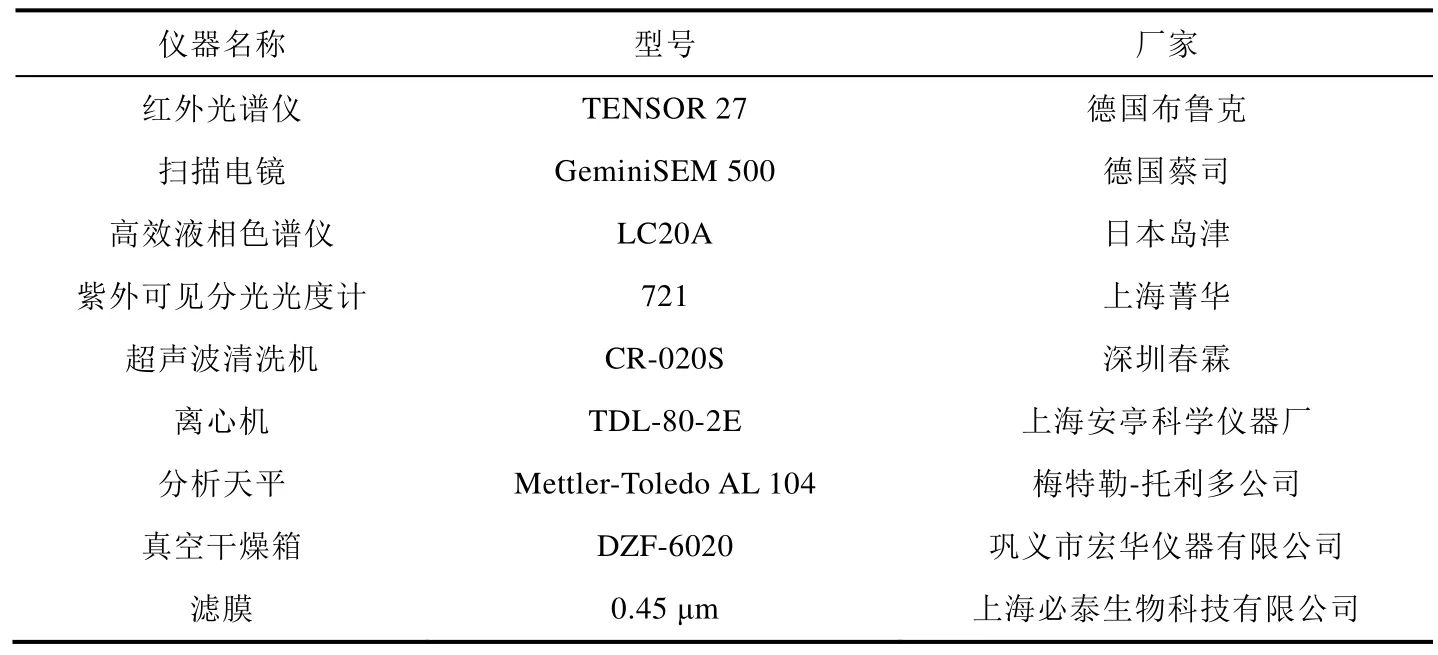
表2 实验仪器表
2.4 实验步骤/方法
本实验内容如果用于教学,可模块化进行,研究三聚氰胺浓度与吸光度的关系,即进行至2.4.3,约需要6个学时;若继续对奶粉中三聚氰胺进行定性和定量分析,即进行至2.4.6,实验学时延长至8学时;若继续进行仪器表征,即进行至2.4.11,延长至12学时,可满足不同层次的实验教学需求。
2.4.1 溶液的配制
三聚氰胺标准溶液的配制:准确称取三聚氰胺标准品3.0000 g,用适量水溶解后,转移至1000 mL容量瓶,用水定容至刻度,配制成三聚氰胺标准溶液。
氰尿酸饱和溶液的配制:称取稍过量氰尿酸标准品,在烧杯中用适量水溶解得到饱和氰尿酸溶液。
亚甲基蓝溶液的配制:准确称取亚甲基蓝0.1000 g,用适量水溶解,转移至100 mL容量瓶,用水定容至刻度,配制成亚甲基蓝标准溶液。
三聚氰胺溶液的稀释:使用移液枪准确移取一定量三聚氰胺标准溶液至100 mL容量瓶,稀释成浓度分别为0.0、2.0、5.0、10.0、15.0、20.0、25.0、30.0、35.0、40.0 mg·L-1的三聚氰胺标准溶液。
2.4.2 亚甲基蓝与奶粉清液最大吸收波长的确定
分别取亚甲基蓝标准溶液和奶粉清液于比色皿中,以水为参比液,在波长330–900 nm区间,测定其吸光度,绘制工作曲线以确定最大吸收波长。
2.4.3 标准曲线的绘制(除浊)
使用移液枪准确移取5 mL不同浓度的三聚氰胺标准溶液于玻璃瓶中,加入100 μL的亚甲基蓝标准溶液,再使用移液枪准确移取5 mL氰尿酸饱和溶液于玻璃瓶中,反应15 min,混匀后离心5 min。
在对照组中,移取等量同样浓度的三聚氰胺与氰尿酸溶液,反应15 min,混匀后离心5 min,以该上层清液作为参比,测定吸光度,绘制标准曲线。
2.4.4 奶粉处理方法
为了定量分析奶粉中三聚氰胺的浓度,对奶粉样品进行处理,方法如下:准确称取10.0 g奶粉样品于试管中,加入100 mL 30 °C的水溶解奶粉,超声振荡10 min。使用离心机在4000 r·min-1的条件下离心5 min,并用0.45 μm的滤膜进行过滤,得到奶粉清液。
2.4.5 奶液中三聚氰胺标准曲线的绘制
将不同质量三聚氰胺与奶粉进行混合溶解,对奶粉溶液进行处理,得到含有不同浓度三聚氰胺的奶粉清液。
使用移液枪准确移取5 mL不同浓度的三聚氰胺奶粉溶液于玻璃瓶中,加入100 μL亚甲基蓝标准溶液,使用移液枪准确移取5 mL氰尿酸饱和溶液,反应15 min,混匀离心5 min。
在对照组中,移取等量同样浓度的三聚氰胺奶粉溶液与氰尿酸溶液,反应15 min,混匀离心5 min,以该上层清液作为参比,测定吸光度,绘制标准曲线。
2.4.6 奶粉中三聚氰胺检测
向奶粉中混有一定量的三聚氰胺,对奶粉进行处理,使用移液枪准确移取5 mL处理后的奶粉清液,加入100 μL亚甲基蓝标准溶液,使用移液枪准确移取5 mL氰尿酸饱和溶液,反应15 min,混匀离心5 min。
在对照组中,使用移液枪移取等量奶粉清液与氰尿酸溶液,反应15 min,混匀离心5 min,以该上层清液作为参比,测定吸光度,测定奶粉中三聚氰胺的含量,计算检出率。
2.4.7 红外光谱分析
将1–2 mg试样与200 mg纯KBr研细均匀,压成透明薄片,等待测定。在电脑上进入OPUS,运行操作软件,设置保存峰位、输入样品名称以及扫描波长范围,开始测试,等待结果。
2.4.8 SEM分析(扫描电子显微镜)
充分干燥样品,在硅片上粘贴导电胶并蘸取适量样品涂抹于导电胶表面,放入喷金机中喷金,固定样品,抽真空,设定工作电压为15 kV,工作距离为8.2 mm,放大样品并进行调焦,找到清晰视野进行拍照。
2.4.9 XPS分析(X射线光电子能谱)
充分干燥样品,在铝箔上粘贴双面胶并蘸取适量样品涂抹于双面胶表面,压片,使样品固定紧实,在X射线最大功率100 W和最大束斑500 μm条件下对样品表面进行扫描。
2.4.10 XRF分析(X射线荧光光谱)
将制好的试样进行特征元素S和Cl分析,打开分析测试仪器软件,预热30 min,放入分析样品;设定相应参数,校正仪器,分析测试样品,并记录测试结果。
2.4.11 反相高效液相色谱处理
将配制好的氰尿酸溶液、三聚氰胺溶液、亚甲基蓝溶液、反应后的奶粉清液与流动相进行脱气过滤,在波长238 nm下,选择甲醇为流动相,流动相流量为1 mL·min-1,柱温为室温后开始测试,每次进样10 μL,测试等待结果。
3 结果与讨论
3.1 红外光谱分析
三聚氰胺、氰尿酸及不含亚甲基蓝产物红外光谱见图3,可以看出反应产物的红外特征峰(C=O伸缩振动:1736 cm-1;三聚氰胺NH2弯曲振动:1663 cm-1)相较于三聚氰胺(N―H伸缩振动:3334–3419 cm-1)和氰尿酸(C=O伸缩振动:1722 cm-1)的特征峰明显向低波数区发生移动,且峰形变宽,说明三聚氰胺与氰尿酸反应后产生了氢键,二者以氢键为驱动力发生了自组装。

图3 三聚氰胺、氰尿酸及不含亚甲基蓝产物红外光谱对比图
比较含亚甲基蓝产物与不含亚甲基蓝产物的谱图(图4),可以看出特征峰无论峰形还是位置,均无明显变化,说明亚甲基蓝诱导三聚氰胺与氰尿酸进行自组装,仍是氢键作用,未有新键形成。
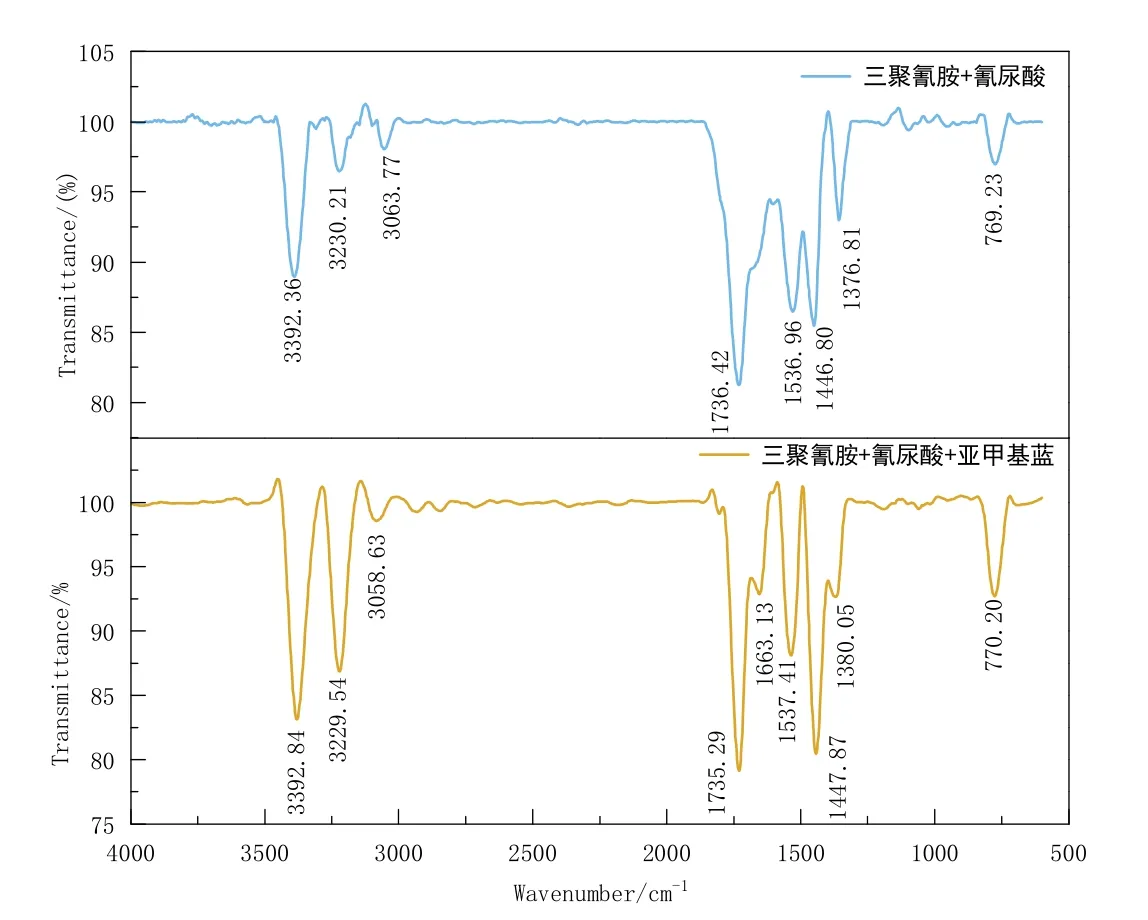
图4 含亚甲基蓝产物与不含亚甲基蓝产物红外光谱对比图
3.2 SEM分析
未加入亚甲基蓝时,三聚氰胺与氰尿酸形成的寡聚物在电镜下主要呈棒状,随后棒状聚集体进一步聚集堆叠成较大尺寸的超分子聚集体,棒状形貌占主体(图5);加入亚甲基蓝后,三聚氰胺与氰尿酸形成的寡聚物主要为不规则球状,球状进一步聚集堆叠成大尺寸的超分子聚集体(图6)。亚甲基蓝加入前后的电镜形貌有显著区别,这是由于亚甲基蓝占据部分氢键位点,影响了组装的规整程度,从而改变了三聚氰胺与氰尿酸所形成寡聚物的聚集形貌。

图5 ME与CA形成交联超分子SEM图

图6 ME、MB与CA形成交联超分子SEM图
3.3 XPS分析
为说明亚甲基蓝在体系中的存在状态,对产物进行XPS分析,获得全谱如图7所示,对XPS全谱进行积分处理并结合各元素轨道谱进行分析,发现全谱中不含S、Cl元素轨道谱的成分,说明超分子表面没有亚甲基蓝存在。

图7 反应产物XPS全谱
3.4 XRF分析
在明确表面无亚甲基蓝后,对反应产物进行了XRF分析,结果显示在产物中,元素含量S : Cl =47.9% : 52.1%,说明在该反应体系中的确存在亚甲基蓝。由于前面XPS已说明产物表面并未出现亚甲基蓝,因而在反应产物中,亚甲基蓝是被不规则小球(图6)包裹而并非被吸附。
3.5 亚甲基蓝吸光度曲线
如图8,在波长665 nm处,亚甲基蓝有最大吸收峰,而在该波长下(图9),奶粉清液基本无吸收,对亚甲基蓝的吸收影响较少,因而在后续实验流程中可采用这一波长为工作波长。
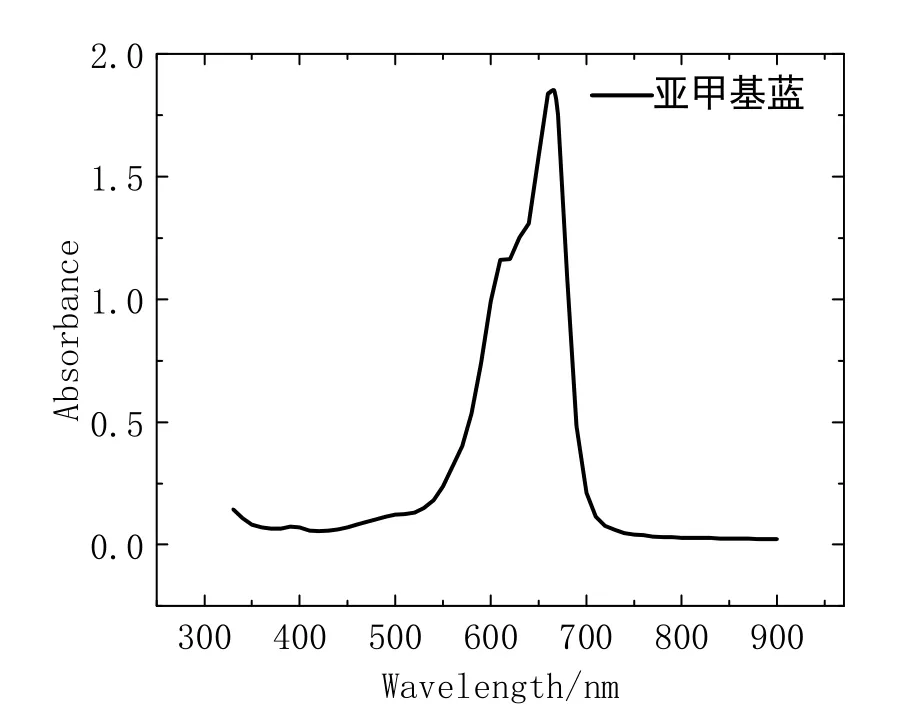
图8 亚甲基蓝吸光度-波长曲线

图9 奶粉清液吸光度-波长曲线
3.6 标准曲线的绘制
测定不同浓度三聚氰胺反应体系的吸光度曲线,如图10所示。曲线与三聚氰胺浓度呈现极好的负相关,说明反应可行。

图10 反应液吸光度标准拟合曲线
3.7 奶液中三聚氰胺标准曲线的绘制
测定奶液中不同浓度三聚氰胺反应体系的吸光度,绘制标准吸收曲线,曲线与三聚氰胺浓度呈现极好的负相关,可对奶粉中的三聚氰胺进行定量检测。
3.8 定性检出限的确定
根据三聚氰胺吸光度的标准曲线,已知定量检出限为2 mg·L-1(2–40 mg·L-1为线性关系,小于2 mg·L-1则不再出现线性),现对三聚氰胺的定性检出限进行探讨,已知三聚氰胺浓度为0时,吸光度为0.855,标准差为0.002,根据IUPAC建议的检出限计算公式AL=A0± 3S(其中A0代表吸光度,AL代表检出限,S代表标准差),检出限对应吸光度数值应低于0.849。根据检测数据,三聚氰胺浓度为0.1 mg·L-1时,检出全部为阳性。
综上,可确定本实验定性检出限为0.10 mg·L-1(由实验过程中奶粉与三聚氰胺的混合比例可将浓度转化为质量比,即2.0 mg·kg-1),根据2019年国家卫生部公布的三聚氰胺添加标准(2.5 mg·kg-1),说明该检测方法可基本满足三聚氰胺检测要求。
3.9 检出率
向奶粉中混入一定量三聚氰胺,进行预处理后,测定体系的吸光度(图11),根据奶粉中三聚氰胺的吸光度曲线计算得到三聚氰胺的理论含量,计算检出率。对含有三聚氰胺的奶液体系进行反复检出,计算得到检出率为95%–99%。
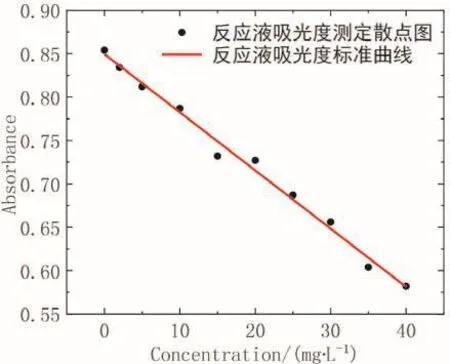
图11 加入预处理奶液的反应液吸光度标准拟合曲线
3.10 反相高效液相色谱分析
由图12可以确定三聚氰胺、氰尿酸和亚甲基蓝标准液的出峰位置,确定三者的保留时间(图13),氰尿酸保留时间为2.745 min,三聚氰胺保留时间为2.876 min,亚甲基蓝保留时间为7.364 min (因无影响已除去)。

图12 三聚氰胺定性检出限散点图

图13 三聚氰胺、氰尿酸、亚甲基蓝及反应后清液色谱图
由图14可以看到反应后的清液不存在三聚氰胺特征峰,说明其中基本不含有三聚氰胺,这也侧面说明了利用三聚氰胺与氰尿酸反应的自组装机理对三聚氰胺进行定量检测,检出效率高。
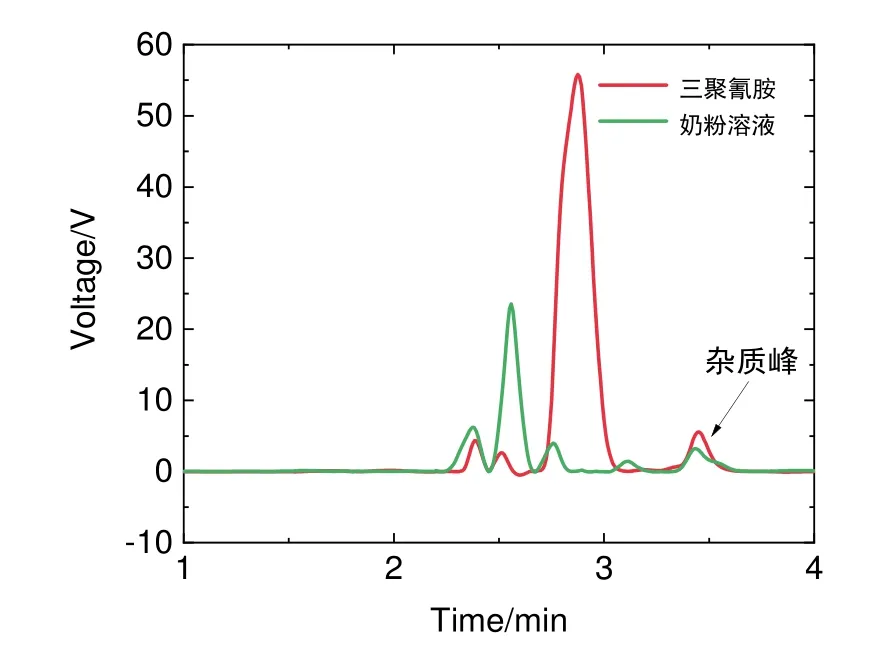
图14 三聚氰胺及反应后清液色谱图
4 条件优化
4.1 温度对实验的影响
分别在不同温度条件下,对混有三聚氰胺的奶粉进行前处理,测定吸光度(图15),在奶液标准曲线中读取三聚氰胺浓度,比较不同温度下的检测效果,说明温度对检测结果的影响。

图15 吸光度-温度关系
在温度为25 °C时,吸光度最小,检测出三聚氰胺的浓度最大,相较于其他温度效果较好,因而在实验教学中,可以采取室温作为反应条件。
4.2 时间对实验的影响
在不同反应时间下开展实验,测定不同反应时间反应体系中吸光度的变化,观察反应时间对检测结果的影响(图16)。随着反应时间的延长,吸光度逐渐降低,三聚氰胺的检测浓度随之升高,而在反应15 min后,吸光度基本不变。因而可以采取15 min作为反应条件。

图16 吸光度-时间关系
5 结语
本实验基于超分子自组装原理,利用亚甲基蓝对三聚氰胺与氰尿酸交联形成超分子的诱导作用,提出了一种新型的定性和定量检测三聚氰胺的方法,实验内容丰富,同时结合社会实际问题,有利于拓宽学生的知识面,激发化学研究的兴趣。
本实验操作简便,绿色环保,实验现象明显,同时涉及多种基本实验操作与表征方法,对学生实验技能的训练和提高有很大帮助。本实验可模块化教学,满足不同学时的实验要求,适合作为本科教学实验进行推广。
6 创新性/特点/特色声明
(1) 引入超分子自组装概念,将研究热点与实验教学相结合;
(2) 综合运用超分子化学、分析化学、有机化学等多学科知识和多种表征手段与方法,解决社会实际问题;
(3) 可模块化教学,开展不同学时实验,适合于本科教学培养。
