绿鳍马面鲀微卫星标记开发及在丝背细鳞鲀中的通用性检测
2022-08-01王九龙徐文刚杜荣斌刘立明
王九龙, 徐文刚, 杨 沛, 杨 婕, 杜荣斌, 刘立明
绿鳍马面鲀微卫星标记开发及在丝背细鳞鲀中的通用性检测
王九龙, 徐文刚, 杨 沛, 杨 婕, 杜荣斌, 刘立明
(烟台大学 海洋学院, 山东 烟台 264005)
为充分挖掘绿鳍马面鲀()基因组资源, 开发可用于群体遗传学研究的分子标记, 本研究利用NCBI数据库中公布的绿鳍马面鲀全基因组序列筛查微卫星位点并在野生群体中验证, 在85个选取的位点中筛选得到30个新的多态性较高的微卫星标记。每个微卫星标记的等位基因数为4~16, 平均为8.5个; 观测杂合度范围为0.207~0.916, 平均值为0.685; 期望杂合度范围为0.315~0.971, 平均值为0.756; 多态信息含量范围为0.301~0.898, 平均值为0.716, 其中属于高度多态的位点有26个, 占总位点数的86.67%; 经过Bonferroni校正后, 有7个位点显著偏离Hardy-Weinberg平衡。将30个绿鳍马面鲀多态性微卫星标记在丝背细鳞鲀()中进行通用性检测, 其中13个位点成功扩增, 9个位点具有多态性。本研究开发的微卫星标记可用于绿鳍马面鲀及相关物种的遗传多样性分析、QTL定位以及系统进化等研究。
绿鳍马面鲀(); 丝背细鳞鲀(); 微卫星标记; 通用性
绿鳍马面鲀()俗称扒皮鱼、象皮鱼、马面鱼等, 广泛分布于中国、日本、朝鲜半岛沿海, 为外海暖温性底层鱼类, 栖息于水深50~120 m处, 主要以浮游生物和底栖生物为食[1]。绿鳍马面鲀具有味道鲜美、营养丰富等优点, 经济价值较高[2]。绿鳍马面鲀曾是中国主要的海洋捕捞对象之一, 但由于过度捕捞和产卵场生态环境受到破坏, 造成绿鳍马面鲀的资源量急剧下降[3]。目前, 中国已经突破绿鳍马面鲀苗种规模化繁育技术[4-5], 为保护中国绿鳍马面鲀种质资源、促进其养殖业可持续发展提供了重要保障。

绿鳍马面鲀和丝背细鳞鲀()同为单角鲀科(Monacanthidae), 分别隶属于马面鲀属()和细鳞鲀属()。丝背细鳞鲀作为具有较高开发前景的经济鱼类, 国内仅见有对其外部形态特征及染色体核型分析的报道, 研究基础薄弱, 分子遗传资源严重缺乏。目前, 作者所在科研团队正对该两种经济鱼类开展养殖技术、繁育生物学和分子遗传学等方面的研究。通过开发、筛选在丝背细鳞鲀中通用的微卫星标记, 可为开展丝背细鳞鲀群体遗传多样性分析和遗传改良等工作提供必要的分子标记资源。此外, 通用标记的开发与验证也可为阐明两种鱼类之间的系统进化关系提供新的研究角度。本研究通过对绿鳍马面鲀全基因组序列进行挖掘, 筛选并开发了30个新的多态性较高的绿鳍马面鲀微卫星标记, 并将微卫星标记在丝背细鳞鲀中进行了通用性检测。
1 材料与方法
1.1 材料
绿鳍马面鲀野生群体捕自山东烟台近海, 丝背细鳞鲀养殖群体采集于烟台市莱州顺昌水产有限公司。绿鳍马面鲀和丝背细鳞鲀各取48尾, 剪取尾鳍置于无水乙醇中。采用苯酚-氯仿法提取样品基因组DNA, 使用分光光度计Nano Drop 2000(Thermo Fisher Scientific, 美国)测定基因组DNA的浓度和纯度, 采用1%琼脂糖凝胶电泳检测DNA的完整度。提取的基因组DNA使用超纯水稀释至50 ng/μL, 保存在–30 ℃冰箱备用。
1.2 微卫星筛查和引物设计
从美国国家生物信息中心网站(https://www.ncbi. nlm.nih.gov/)下载绿鳍马面鲀全基因组序列(GenBank: GCA_009823395.1)。基因组总长度约为474.3 Mb, 包含20条染色体以及135条scaffolds。采用微卫星识别工具MISA(Microsatellite identification tool, http://pgrc. ipk-gatersleben.de/misa/)在参考基因组中搜索微卫星位点, 搜索所采用的参数如下: 单核苷酸重复次数≥10次、二、三、四、五、六核苷酸重复次数≥5次。
利用Primer3 V2.3.6分别对搜索到的微卫星序列两端设计引物, 扩增片段长度控制在100~400 bp, 扩增片段位置为重复序列前1个碱基到重复序列后5个碱基, 其他参数默认。因少量不同的微卫星序列距离较近, 同一对引物的扩增产物中包含多个微卫星序列, 会对后续条带判读造成影响, 故需将这些距离较近的微卫星位点剔除, 筛选出扩增片段中只含有一个微卫星位点的引物。选取85对引物送至生工生物工程(上海)股份有限公司合成, 所选微卫星位点不与已发表的微卫星标记重复。
1.3 微卫星标记的引物筛选及特性分析
随机选取绿鳍马面鲀6个野生个体的基因组DNA模板进行初步筛选, 得到能稳定扩增且呈多态性的微卫星位点, 再通过温度梯度PCR进行退火温度的优化。利用绿鳍马面鲀48个个体, 对初筛中呈多态性的微卫星位点进行特性分析。PCR反应在Bio-Rad T100™ PCR仪中进行。PCR反应体系总体积为10 μL, 包括10×PCR buffer 1 μL, 0.6 μL MgCl2(25 mmol/L), 0.8 μL dNTP mix(2.5 μmol/L), 正反向引物各0.4 μL (10 μmol/L), DNA模板1 μL(50 ng/μL), 0.05 μL rTaq DNA聚合酶(5 U/μL, Takara), 超纯水补充总体积至10 μL。PCR反应程序为: 95 ℃预变性5 min, 95 ℃变性30 s, 退火反应30 s, 72 ℃延伸1 min, 35个循环, 最后72 ℃延伸10 min。PCR扩增产物首先利用1.5%的琼脂糖凝胶电泳检测, 对能扩增出单一条带的位点不进行测序验证, 直接利用6%变性聚丙烯酰胺凝胶电泳检测多态性, 银染显影进行条带判读后扫描保存。
1.4 微卫星标记通用性检测
利用在绿鳍马面鲀中筛选得到的微卫星标记, 首先以丝背细鳞鲀6个个体的DNA为模板进行PCR扩增, 经1.5%的琼脂糖凝胶电泳检测筛选可稳定扩增的微卫星引物; 再对丝背细鳞鲀48个个体进行多态性分析, 经6%变性聚丙烯酰胺凝胶电泳检测, 银染染色后扫描保存。
1.5 数据统计与分析
利用Genepop 4.0软件检验微卫星位点间的Hardy-Weinberg平衡的偏离情况, 并经Bonferroni法校正(<0.05); 利用Cervus 3.0.7软件计算每个位点的等位基因数(number of allele,a)、观测杂合度(observed heterozygosity,o)、期望杂合度(expected heterozygosity,e)以及多态信息含量(polymorphism information content, PIC)。
2 结果
2.1 引物筛选及初步多态性检测结果
在绿鳍马面鲀基因组中共筛选得到566 561个完整型微卫星位点, 其中单碱基重复类型70 087个(12.37%); 二碱基重复类型数量最多, 有336 653个(59.42%); 三碱基重复类型113 998个(20.12%); 四碱基重复类型39 059个(6.90%); 五碱基重复类型3 694个(0.65%); 六碱基重复类型数量最少, 只有3 070个, 占所有微卫星位点的0.54%。
在选取的85对微卫星引物中, 18对引物扩增后无条带, 23对引物扩增后有非特异性扩增, 14对引物扩增后有单一条带但无多态性。最终, 共筛选得到30个可扩增出清晰条带且具多态性的微卫星标记(表1、图1)。

表1 30对绿鳍马面鲀微卫星引物信息
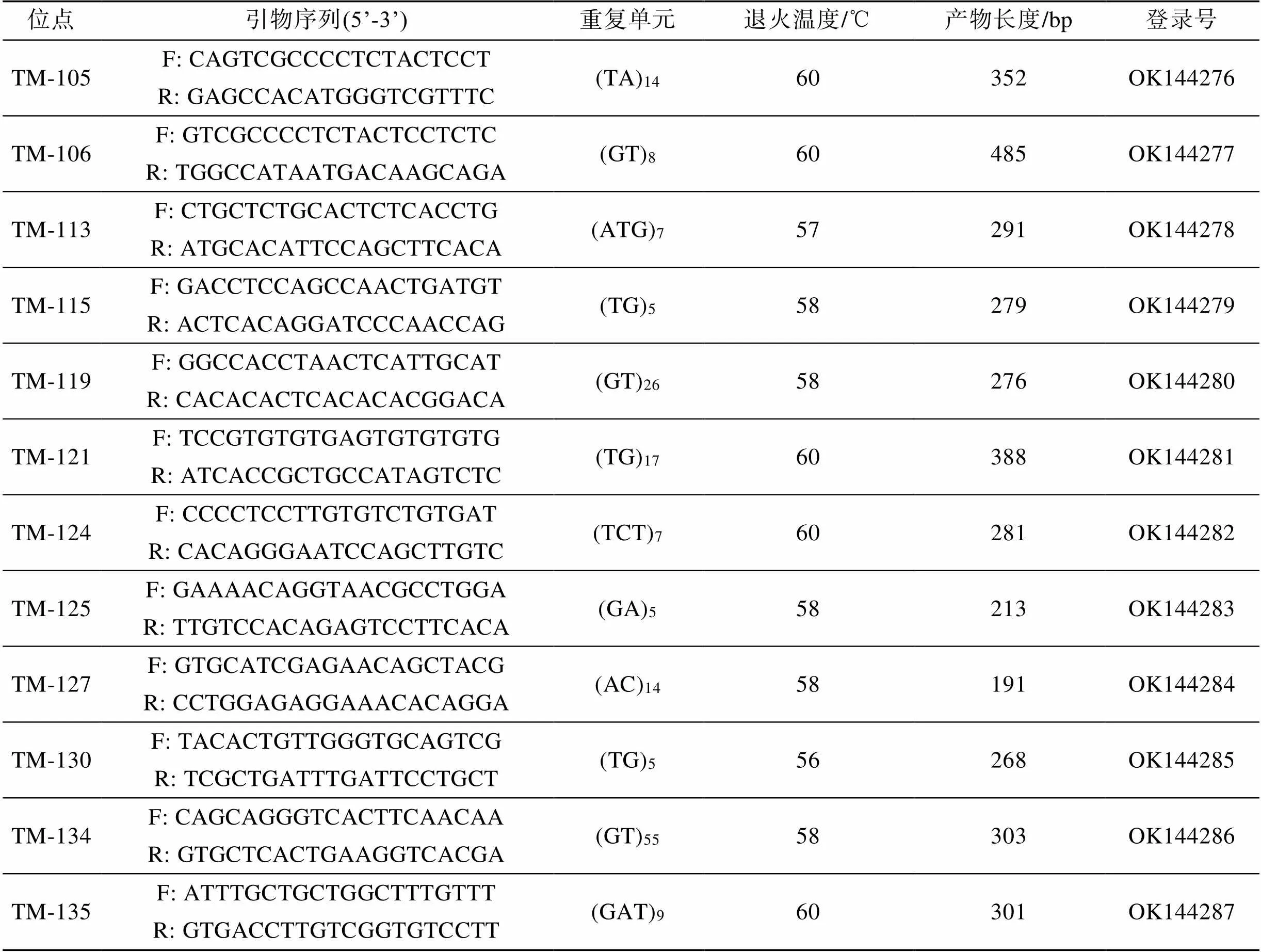
续表
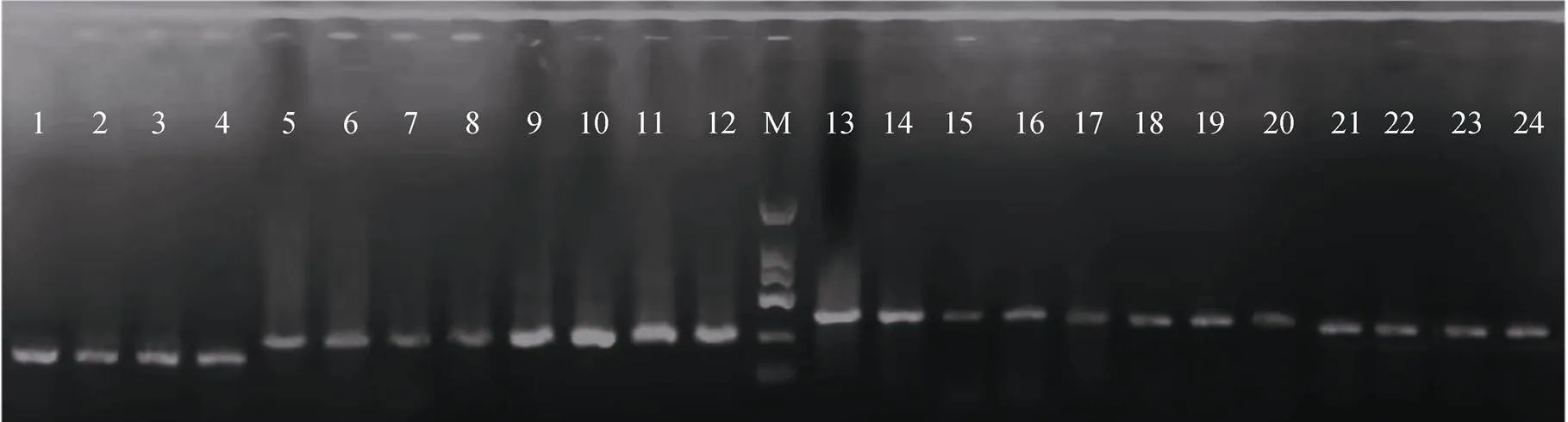
图1 微卫星标记的琼脂糖凝胶电泳图
M.DNA marker; 1-4. TM-68; 5-8. TM-70; 9-12. TM-74; 13-16. TM-78; 17-20. TM-94; 21-24. TM-115
2.2 微卫星标记在绿鳍马面鲀野生群体中的多态性分析
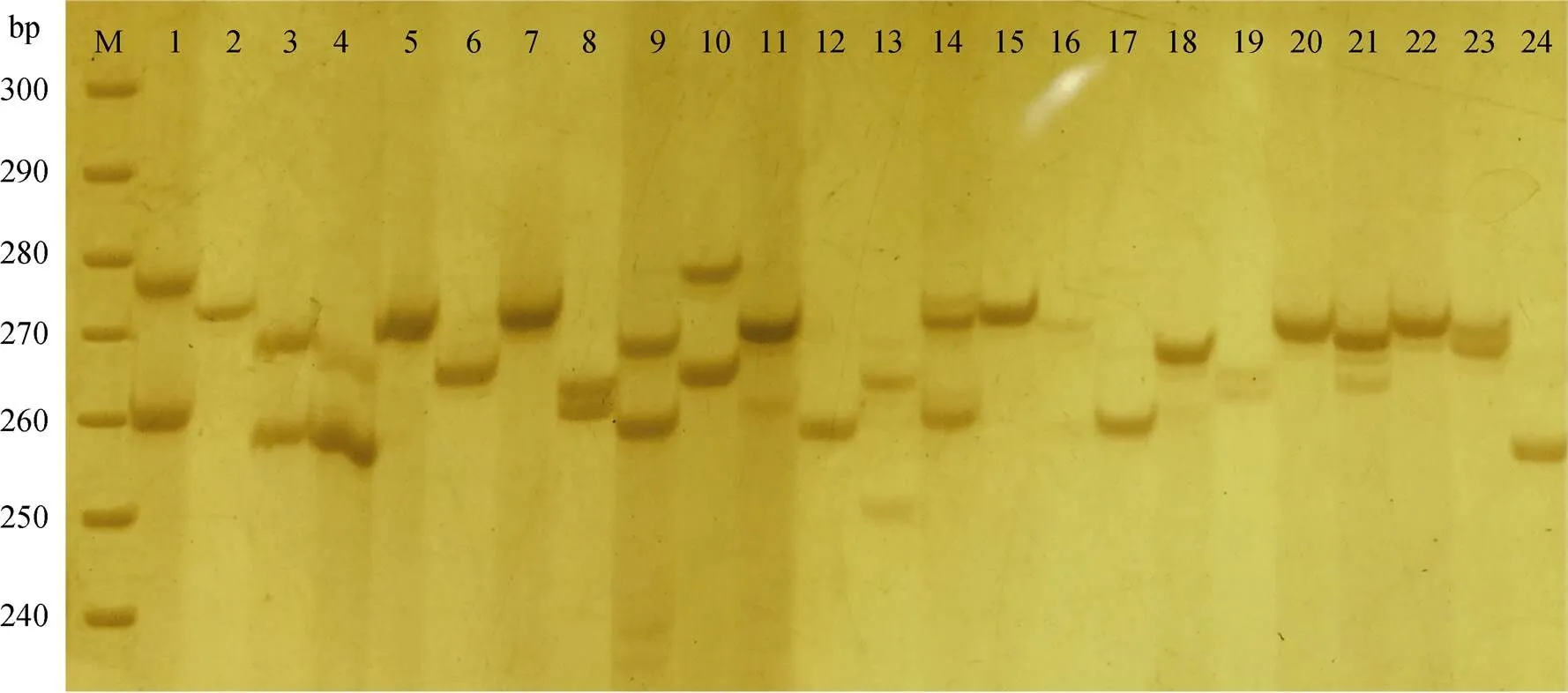
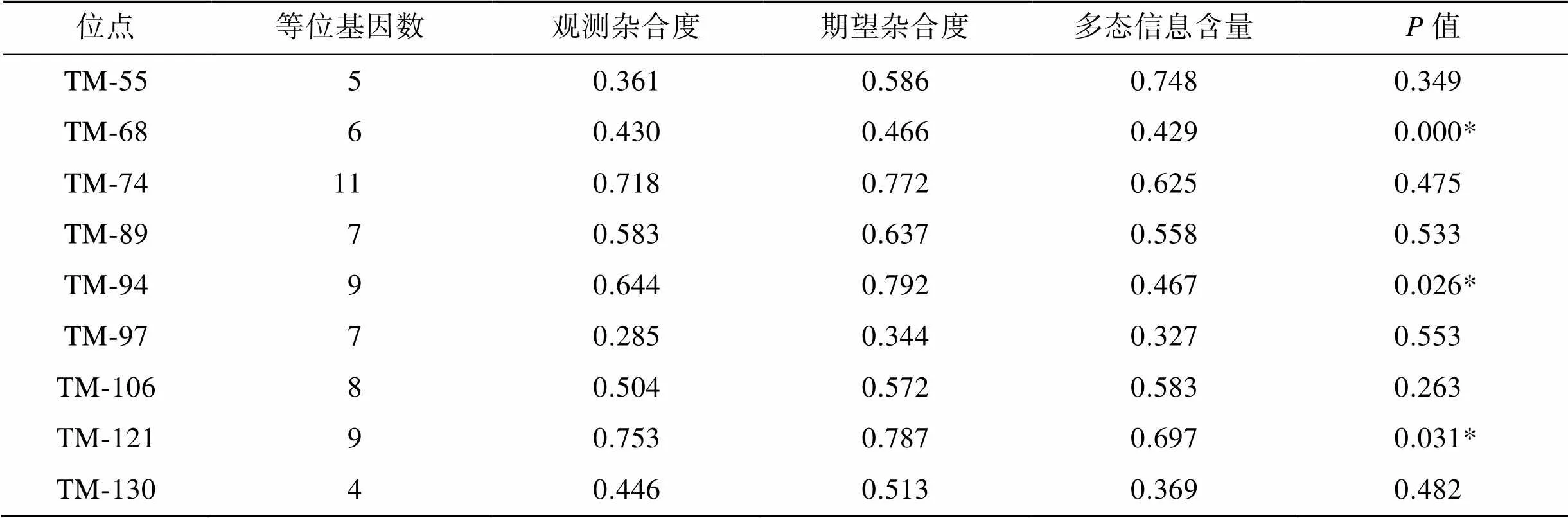
30个微卫星标记在绿鳍马面鲀野生群体中共扩增出254个等位基因, 平均等位基因数为8.5个, 其中位点TM-127等位基因数最少(4个), 位点TM-74等位基因数最多(16个)。观测杂合度平均值为0.685(0.207~0.916), 期望杂合度平均值为0.756 (0.315~0.971)。多态信息含量平均值为0.716(0.301~ 0.898), 其中高度多态(PIC>0.5)的位点有26个, 占总位点数的86.67%, 中度多态位点(0.25 表2 30个微卫星标记在绿鳍马面鲀野生群体中的遗传多样性参数 注: *差异显著, Hardy-Weinberg平衡检验经Bonferroni法校正(<0.05) 利用筛选出的30个绿鳍马面鲀微卫星标记在丝背细鳞鲀养殖群体中进行扩增, 其中17个位点无扩增产物或产生非特异性扩增, 剩余13个可扩增出清晰目的条带的位点中, 9个位点具有多态性, 通用率和多态率分别为43.33%和30.00%。 在丝背细鳞养殖群体中, 9个通用的微卫星标记共扩增出66个等位基因, 平均等位基因数为7.3个, 其中位点TM-130等位基因数最少(4个), 位点TM-74等位基因数最多(11个)。观测杂合度平均值为0.525 (0.285~0.753), 期望杂合度平均值为0.608 (0.344~0.792)。多态信息含量平均值为0.534(0.327~ 0.748), 其中高度多态的位点有5个, 占总位点数的55.56%, 中度多态位点有4个, 占44.44%(表3)。 Hardy-Weinberg平衡是群体遗传学的一个重要基本原理, 它指出“在没有外界因素干扰的情况下, 群体的基因型频率在世代间保持恒定”。在水产动物群体遗传学研究中, 微卫星标记偏离Hardy- Weinberg平衡的现象较为常见[26-27]。突变、自然选择、非随机交配、遗传漂变和基因流等因素都可能导致偏离Hardy-Weinberg平衡。在绿鳍马面鲀野生群体中, 7个微卫星标记偏离Hardy-Weinberg平衡且均表现为杂合子缺失(heterozygote deficiency), 其原因可能是野生群体在这7个位点受到了自然选择作用, 这些位点可能与适应环境能力有关。此外, 华伦德效应、存在无效等位基因以及近亲交配也是导致杂合子缺失的重要原因[28]。为全面、准确地掌握绿鳍马面鲀群体遗传多样性水平, 研究者应综合利用微卫星标记和线粒体DNA等多种类型的标记开展相关研究。 图2 微卫星标记TM-70的聚丙烯酰胺凝胶电泳图(M.DNA marker) 表3 9个通用微卫星标记在丝背细鳞鲀养殖群体中的遗传多样性参数 注: *表示差异显著, Hardy-Weinberg平衡检验经Bonferroni法校正(<0.05) 分子标记的多态信息含量、等位基因数以及杂合度是评价遗传多样性最重要的参数。根据BOTSTEIN等[29]提出的分类标准, 本研究开发的30个微卫星标记中有26个位点表现为高度多态性, 这些位点将为绿鳍马面鲀群体遗传学研究提供丰富的遗传信息; 此外, 等位基因数≥5的位点有29个, 表明这些位点具有较高的多态性, 实验所用野生绿鳍马面鲀群体遗传多样性较高。在徐亘博[14]和AN等[15-16]的研究中, 也得到野生绿鳍马面鲀群体遗传多样性较高的结果。此外, 本文与徐亘博[14]的研究采用的是聚丙烯酰胺凝胶电泳方法对微卫星标记进行基因分型, 两项研究中的微卫星标记在野生群体中检测到的平均等位基因数(8.5和4.36)显著低于AN等[15-16]研究中相应的平均值(15.18和13.35), 其原因可能是AN等利用分辨率更高的毛细管电泳技术对微卫星标记进行基因分型, 可以检测出更多片段长度相近的扩增产物[30]。基因杂合度可反映群体在多个基因上的遗传变异及群体遗传多样性的丰富度, 杂合度越高, 表明该群体的遗传变异越复杂[31]。微卫星标记的平均观测杂合度为0.685, 表明该绿鳍马面鲀野生群体仍处于较高的遗传变异水平, 这一结果为未来开展绿鳍马面鲀人工选育提供了一定理论依据。 由于微卫星侧翼序列在种间或属间具有一定保守性, 因此开发通用性标记应用于近缘物种成为可能。目前, 研究者已在多个水产动物中开展了微卫星标记通用性研究。如: 吴仁协等[23]利用SLAF-seq技术从黑棘鲷()中开发了49个高多态性的微卫星标记, 其中43个微卫星标记可在其他9种鲷科(Sparidae)鱼类中成功扩增; 张广明等[32]对虾夷扇贝()EST-SSR标记在栉孔扇贝()中的通用性进行了研究, 结果显示, 60个位点中有21个可在栉孔扇贝中扩增出特异性条带, 通用性比例为35.00%。本研究中, 来源于绿鳍马面鲀的微卫星标记在丝背细鳞鲀中的多态率为30.00%; 而在AN等[16]的研究中, 来源于绿鳍马面鲀的微卫星标记在丝背细鳞鲀中的多态率为60.00%(12/20)。不同研究中来源于绿鳍马面鲀的微卫星标记在丝背细鳞鲀中通用性差异较大, 其原因可能是用于检测的标记数量较少所致。分子标记的跨物种扩增通用性反映了检测物种间的遗传分化程度, 亲缘关系越远的物种, 种间分子标记的通用性越差、扩增成功率越低。如利用兰州鲇()的微卫星标记在鲇形目(Siluriformes)和鲤形目(Cypriniformes)的12种鱼类中进行跨物种通用性分析, 结果表明兰州鲇微卫星标记在近缘种中都表现出一定的通用性, 但随着亲缘关系变远, 其通用性降低[33]; 在巨蛎属牡蛎()中, 从长牡蛎()中开发的EST-SNP标记在葡萄牙牡蛎()、熊本牡蛎()、香港巨牡蛎()和有明巨牡蛎()的通用率分别为93.6%、82.5%、67.4%和67.1%, 这一结果与巨蛎属牡蛎之间遗传距离的远近相一致[34]。除相关物种间的亲缘关系远近外, 微卫星标记的来源也会影响通用率的高低。相比于从基因组中开发的微卫星标记(genomic SSR), 从基因转录区开发的EST- SSR标记侧翼序列更加保守, 引物在跨物种间扩增的成功率更高[31]。 本研究开发的30个微卫星标记可用于相关物种的遗传多样性评价、系统进化分析和比较基因组作图等研究。虽然本研究中绿鳍马面鲀的遗传多样性相对较高, 但考虑到未来市场对野生种群的需求和海洋生态环境变化对绿鳍马面鲀资源和种群结构的影响, 保护绿鳍马面鲀野生资源仍任重道远。下一步, 我们将结合简化基因组测序等技术对中国沿海多个地理群体的绿鳍马面鲀开展群体遗传学分析, 以期为制定科学的资源保护方案提供理论基础。 [1] 苏锦祥, 李春生. 中国动物志: 硬骨鱼纲-鲀形目、海蛾鱼目、喉盘鱼目、鮟鱇目[M]. 北京: 科学出版社, 2002: 125-132. SU Jinxiang, LI Chunsheng. Fauna Sinica: Osteichthyes-Tetraodontiformes, Pegasiformes, Gobiesociformes, Lophiiformes[M]. Beijing: Science Press, 2002: 125-132. [2] 徐大凤, 刘琨, 王鹏飞, 等. 绿鳍马面鲀肌肉营养成分分析和营养评价[J]. 海洋科学, 2018, 42(5): 122-129. XU Dafeng, LIU Kun, WANG Pengfei, et al. Analysis of nutritional composition in the muscle of[J]. Marine Sciences, 2018, 42(5): 122-129. [3] 郑元甲. 东海区马面鲀资源变动及其原因的初步研究[J]. 中国水产科学, 1997, 4(4): 19-25. ZHENG Yuanjia. A preliminary study on the stook variations and their causes of filefishesspp. in the East China Sea[J]. Journal of Fishery Sciences of China, 1997, 4(4): 19-25. [4] 张立宁, 邵鑫斌, 单乐州, 等. 绿鳍马面鲀规模化人工繁育技术[J]. 水产科技情报, 2020, 47(5): 258-260. ZHANG Lining, SHAO Xinbin, SHAN Lezhou, et al. Large-scale artificial breeding technology of[J]. Fisheries Science & Technology Information, 2020, 47(5): 258-260. [5] 姜良龙, 张哲, 王臻, 等. 绿鳍马面鲀工厂化早繁苗种培育关键技术[J]. 水产科学, 2021, 40(6): 801-809. JIANG Lianglong, ZHANG Zhe, WANG Zhen, et al. Key techniques of industrial seedling production forin earlier breeding season[J]. Fisheries Science, 2021, 40(6): 801-809. [6] 关健, 陈志信, 张家男, 等. 人工培育条件下绿鳍马面鲀胚胎发育的研究[J]. 海洋科学进展, 2011, 29(4): 498-505. GUAN Jian, CHEN Zhixin, ZHANG Jianan, et al. Investigation of embryonic development ofin artificial breeding condition[J]. Advances in Marine Science, 2011, 29(4): 498-505. [7] 张哲, 姜良龙, 王臻, 等. 绿鳍马面鲀早期生长发育与摄食特性的研究[J]. 海洋科学, 2021, 45(1): 1-13. ZHANG Zhe, JIANG Lianglong, WANG Zhen, et al. Growth, development, and feeding characteristics ofduring early stages[J]. Marine Sciences, 2021, 45(1): 1-13. [8] 边力, 王鹏飞, 陈四清, 等. 基于线粒体Cyt基因序列的绿鳍马面鲀6个野生群体的遗传结构分析[J]. 中国水产科学, 2018, 25(4): 827-836. BIAN Li, WANG Pengfei, CHEN Siqing, et al. Population genetic structure ofin China’s coastal waters based on mitochondrial Cytsequences[J]. Journal of Fishery Sciences of China, 2018, 25(4): 827-836. [9] YANG T, WANG Z, LIU Y, et al. Population genetics and molecular phylogeography of(Tetraodontiformes, Monachanthidae) in Northwestern Pacific inferred from variation of the mtDNA control region[J]. Aquatic Living Resources, 2019, 32: 18. [10] GWAK W S, ROY A. Genetic diversity and population genetic structure of Korean black scraperin Korea and Japan based on the mtDNA marker[J]. Ocean Science Journal, 2021: 1-9. [11] LIU F, QU Y K, GENG C, et al. Analysis of the population structure and genetic diversity of the red swamp crayfish () in China using SSR markers[J]. Electronic Journal of Biotechnology, 2020, 47: 59-71. [12] GUO X, LI Q, WANG Q Z, et al. Genetic mapping and QTL analysis of growth-related traits in the Pacific oyster[J]. Marine Biotechnology, 2012, 14(2): 218-226. [13] LIU T, LI Q, SONG J, et al. Development of genomic microsatellite multiplex PCR using dye-labeled universal primer and its validation in pedigree analysis of Pacific oyster ()[J]. Journal of Ocean University of China, 2017, 16(1): 151-160. [14] 徐亘博. 半滑舌鳎等九种海水鱼微卫星分子标记的开发和应用[D]. 青岛: 中国海洋大学, 2010: 37-50. XU Genbo. Development and application of microsatellite markers inand other eight crucial marine fish species[D]. Qingdao: Ocean University of China, 2010: 37-50. [15] AN H S, LEE J W, DONG C M, et al. Development and characterization of microsatellite markers for genetic analysis of the Korean black scraper,[J]. Genes & Genomics, 2011, 33(5): 499-504. [16] AN H S, KIM M, LEE W, et al. Novel polymorphic microsatellite loci for the Korean black scraper (), and their application to the genetic characterization of wild and farmed populations[J]. International Journal of Molecular Sciences, 2011, 12(6): 4104-4119. [17] 王娟娟, 赵明, 韩雨威, 等. 微卫星DNA标记开发技术进展及其在经济植物研究中的应用[J]. 生命科学研究, 2016, 20(3): 260-266. WANG Juanjuan, ZHAO Ming, HAN Yuwei, et al. Advances in development of microsatellite DNA markers and their applications in economic plant research[J]. Life Science Research, 2016, 20(3): 260-266. TANG Rongye, SU Mengyuan, YANG Wenshan, et al. Analysis of microsatellite distribution characteristics in the Channel catfish () Genome[J]. Progress in Fishery Sciences, 2022, 43(2): 89-97. [19] 梁霞, 王慧琪, 马宇璇, 等. 鲤鱼()全基因组微卫星分布特征研究[J]. 南京师大学报(自然科学版), 2021, 44(3): 103-111. LIANG Xia, WANG Huiqi, MA Yuxuan, et al. Distribution characteristics of microsatellites in the whole genome of, Linnaeus[J]. Journal of Nanjing Normal University (Natural Science Edition), 2021, 44(3): 103-111. [20] 倪守胜, 杨钰, 柳淑芳, 等. 基于高通量测序的虾夷扇贝基因组微卫星特征分析[J]. 渔业科学进展, 2018, 39(1): 107-113. NI Shousheng, YANG Yu, LIU Shufang et al. Microsatellite analysis ofusing next- generation sequencing method[J]. Progress in Fishery Sciences, 2018, 39(1): 107-113. [21] DONG W, HE F, WEI S, et al. Identification and characterization of SSR markers in taro [(L.) Schott] by RAD sequencing[J]. Genetic Resources and Crop Evolution, 2021, 68(7): 2897-2905. [22] LI X, TANG Y, ZHANG R, et al. Characterization and development of SSR markers of schizothoracine fish (Cypriniformes: Cyprinidae) based on SLAF-seq technique[J]. Journal of Applied Ichthyology, 2020, 36(4): 519-527. [23] 吴仁协, 肖瑶, 牛素芳, 等. 基于SLAF-seq技术的黑棘鲷微卫星标记开发及其在鲷科鱼类中的通用性研究[J]. 海洋与湖沼, 2019, 50(2): 365-377. WU Renxie, XIAO Yao, NIU Sufang, et al. Development of microsatellite markers forbased on SLAF-seq technology and generality in the family Sparidae[J]. Oceanologia et Limnologia Sinica, 2019, 50(2): 365-377. [24] 张浩冉, 梁镇邦, 吴仁协, 等. 基于SLAF-seq技术的沙带鱼()微卫星标记开发以及在近缘种中的通用性[J]. 基因组学与应用生物学, 2018, 37(8): 3331-3338. ZHANG Haoran, LIANG Zhenbang, WU Renxie, et al. Microsatellite loci isolation in the Savalai hairtail () based on SLAF-seq technology and generality in the related species[J]. Genomics and Applied Biology, 2018, 37(8): 3331-3338. [25] BIAN L, LI F, GE J, et al. Chromosome‐level genome assembly of the greenfin horse‐faced filefish () using Oxford Nanopore PromethION sequencing and Hi‐C technology[J]. Molecular Ecology Resources, 2020, 20(4): 1069-1079. [26] 任建功, 王青林, 孙朝徽, 等. 许氏平鲉6个地理群体遗传多样性的微卫星分析[J]. 水产科学, 2021, 40(3): 301-309. REN Jiangong, WANG Qinglin, SUN Zhaohui, et al. Genetic diversity among six geographical populations of Schlegel’s Black Rockfishby microsatellite marker[J]. Fisheries Science, 2021, 40(3): 301-309. [27] 梁业松, 张维炜, 宋飞彪, 等. 虎龙杂交斑养殖群体遗传多样性与遗传结构的微卫星分析[J]. 水产学报, 2022, 46(1): 31-40. LIANG Yesong, ZHANG Weiwei, SONG Feibiao, et al. Genetic diversity and genetic structure analysis of aquaculture groups ofhybrid grouper [(♀)(♂)] using microsatellite markers[J]. Journal of Fisheries of China, 2022, 46(1): 31-40. [28] RICO C, CUESTA J A, DRAKE P, et al. Null alleles are ubiquitous at microsatellite loci in the wedge clam ()[J]. Peer J, 2017, 5: e3188. [29] BOTSTEIN D, WHITE R L, SKOLNICK M, et al. Construction of a genetic linkage map in man using restriction fragment length polymorphisms[J]. American Journal of Human Genetics, 1980, 32(3): 314-331. [30] VOETEN R L C, VENTOURI I K, HASELBERG R, et al. Capillary electrophoresis: trends and recent advances[J]. Analytical Chemistry, 2018, 90(3): 1464-1481. [31] NEI M. Estimation of average heterozygosity and genetic distance from a small number of individuals[J]. Genetics, 1978, 89(3): 583-590. [32] 张广明, 孙秀俊, 吴彪, 等. 虾夷扇贝EST-SSR标记在栉孔扇贝中的通用性研究[J]. 渔业科学进展, 2018, 39(4): 139-146. ZHANG Guangming, SUN Xiujun, WU Biao, et al. Transferability of EST-SSR frominto[J]. Progress in Fishery Sciences, 2018, 39(4): 139-146. [33] 杨忠礼. 兰州鲇EST-SSR分子标记的开发及其在鲇形目和鲤形目鱼类中的通用性研究[D]. 兰州: 甘肃农业大学, 2016: 42-46. YANG Zhongli. Development ofEST-SSR markers and their transferability analysis in Siluriformes and Cypriniformes fishs[D]. Lanzhou: Gansu Agricultural University, 2016: 42-46. [34] ZHONG X, LI Q, YU H, et al. SNP mining inEST data: transferability to four otherspecies, phylogenetic inferences and outlier SNPs under selection[J]. PLoS ONE, 2014, 9(9): e108256. Development of microsatellite markers forand their transferability in WANG Jiu-long, XU Wen-gang, YANG Pei, YANG Jie, DU Rong-bin, LIU Li-ming (College of Ocean, Yantai University, Yantai 264005, China) In this study, microsatellite loci in the complete genome sequence of.(published in NCBI) were screened and verified in a wild population. The aim is to develop molecular markers for population genetics research and fully exploit the genomic resources of.Thirty highly polymorphic, novel microsatellite markers were identified in 85 selected loci. The number of alleles ranged from 4 to 16, with an average of 8.5. The observed heterozygosity ranged from 0.207 to 0.916, with an average of 0.685. The expected heterozygosity ranged from 0.315 to 0.971, with an average of 0.756. The polymorphic information content ranged from 0.301 to 0.898, with an average of 0.716. Of the 30 microsatellite loci identified, 26 (86.67%) were highly polymorphic, and 7 significantly deviated from the Hardy–Weinberg equilibrium after Bonferroni correction. The transferability of these polymorphic microsatellite markers was assessed in the closely related species, in which 13 loci were successfully amplified, and 9 were found to be polymorphic. The microsatellite markers developed in this study can be used in genetic diversity analysis, QTL mapping, and phylogenic studies ofand related species. ;; microsatellite markers; transferability Jan. 20, 2022 [Rescarch Start-up Fund for Young Doctor of Yantai University, No. HX19B18; Science and Technology Innovation Development Plan of Yantai, No. 2022XDRH022] S917.4 A 1000-3096(2022)06-0099-10 10.11759/hykx20220120003 2022-01-20; 2022-04-01 烟台大学青年博士科研启动基金项目(HX19B18); 烟台市科技创新发展计划(2022XDRH022) 王九龙(1989—), 男, 山东聊城人, 博士, 讲师, 主要从事水产动物遗传育种研究, E-mail: Wangjiulong_work@163.com; 刘立明(1971—),通信作者, E-mail: liu_liming71@163.com (本文编辑: 谭雪静)
2.3 绿鳍马面鲀微卫星标记的通用性检测
2.4 微卫星标记在丝背细鳞养殖群体中的多态性分析
3 讨论
3.1 绿鳍马面鲀微卫星标记开发及群体遗传多样性分析
3.2 绿鳍马面鲀微卫星标记的通用性分析
4 结论

