黄绿卷毛菇菌丝体长势与显微结构的相关性
2022-08-01谢占玲戴大日毛玉晶王晓芳郑秀娟
王 宝,谢占玲 ,戴大日,毛玉晶,王晓芳,郑秀娟
(青海大学生态环境工程学院,青海 西宁 810016)
黄绿卷毛菇(Floccularialuteovirens)隶属于担子菌门(Basidiomycota)、伞菌纲(Agaricomycetes)、伞菌目(Agaricales)、伞菌科(Agaricaceae)、卷毛菇属(Floccularia),是一种在青藏高原独特的地理环境和气候条件下孕育而生的优良药用和食用真菌[1],又被称为黄蘑菇、黄环菇[2]。
食用菌菌丝的显微结构通常包括菌丝宽度和是否存在锁状联合及有无横隔等,菌丝在不同培养条件下,其长势、色泽等菌落形态特征存在一定差别,同时显微结构也会发生细微变化[3]。陈少珍等[4]以野生黄伞纯培养菌丝为试验材料研究发现,结实菌株的菌丝是具有锁状联合的双核菌丝,而非结实菌株的菌丝较细,生长较慢,成熟时不产生色素,菌丝颜色为白色或浅黄色;张琦等[5]研究发现,干巴菌菌丝分枝较多,有膈膜,无锁状联合,未观察到无性孢子;熊杰等[6]对茯苓菌株进行显微结构观察发现,茯苓菌丝为少分枝、有隔膜、无锁状联合的多核菌丝。赵桂云等[7]通过对14种食用菌菌丝形态的观察发现,滑菇等12种食用菌的菌丝有锁状联合,蛹虫草等2种食用菌有分生孢子。
目前,对于真菌菌丝显微结构进行观察的相关文献较多,但对显微结构与真菌菌丝体长势的研究则较少。为研究黄绿卷毛菇是否可以通过形成双核菌丝进行有性生殖以及黄绿卷毛菇菌丝体长势与锁状联合数量之间的关系,本文以8个黄绿卷毛菇菌株为研究对象,通过对其菌丝体进行显微结构观察,研究了黄绿卷毛菇菌丝体长势与锁状联合数量之间的相关性,以期为黄绿卷毛菇优良菌株的筛选及黄绿卷毛菇人工栽培的实现提供理论基础和科学依据。
1 材料和方法
1.1 试验材料
(1)供试菌株。供试菌株为黄绿卷毛菇菌株HNHXF7、TJ、F18-2、F18-3、DTS10、DTS13、SJC6、WRQ18。
(2)培养基。固体培养基:200 g马铃薯,20 g葡萄糖,20 g琼脂粉,1.5 g Mg2SO4·7H2O,3 g KH2PO4,10 mg维生素B1,蒸馏水定容至1 000 mL,pH 6.0。液体培养基:200 g马铃薯,20 g葡萄糖,1.5 g Mg2SO4·7H2O, 3 g KH2PO4,10 mg维生素B1,蒸馏水定容至1 000 mL,pH 6.0。
(3)试剂与药品。无水乙醇、异丙醇、次氯酸钠、氯仿、异戊醇、巯基乙醇、CTAB、氯化汞、琼脂糖、刚果红、马铃薯葡萄糖琼脂(PDA)、葡萄糖、硫酸镁、磷酸二氢钾、维生素B1、2×Taq PCR MasterMix 均购自天根生化科技(北京)有限公司,D2000 DNA Ladder及引物合成由生工生物工程(上海)股份有限公司提供。
(4)试验仪器。HIRAYAMA立式自动压力蒸汽灭菌锅、SW-CJ-ZFD型双人单面净化工作台、BS-2F数显振荡培养箱、BCD-539WT海尔冰柜、PCD-246T澳柯玛冰柜、PCR自动序列化分析仪、微量移液器、电子分析天平、DYY-III型电泳仪、紫外成像仪、NikonYS100光学显微镜、玻璃器皿等。
1.2 试验方法
(1)菌丝体显微结构观察。取蒸馏水1滴,滴加在干净的载玻片中央,用接种环以无菌操作挑取培养17、27、37 d的菌丝体少许,在液滴中轻轻涂抹均匀,并加盖干净盖玻片,在玻片一端滴加2滴刚果红,将吸水纸放在另一端使菌丝体充分染色后置于光学显微镜下观察,每个菌株在1个视野中测量9~12次菌丝体宽度,统计锁状联合数量,均设3次重复。
(2)菌丝体生物量测定。平均日生长速率测定:分别将8个黄绿卷毛菇菌株的菌丝体(0.5 cm×0.5 cm)接种至固体培养基,设3次重复,置于25 ℃ 培养箱中恒温培养30 d,利用游标卡尺测量菌落直径,以(菌落直径÷30×100%)作为平均日生长速率测定依据。平均干重测定:将8个黄绿卷毛菇菌株的菌丝体(0.5 cm×0.5 cm)分别接入装液量为100 mL(250 mL三角瓶)的液体培养基中,室温下静置培养,然后称量菌丝体的干重。
(3)多基因系统发育分析。黄绿卷毛菇菌丝体及子实体DNA的提取:用灭菌的镊子挑取适量菌丝体到研钵中,子实体烘干后取干重0.05 g于研钵中,加入液氮研磨,再加入65 ℃预热的2×CTAB(1 mL CTAB∶4 μL β-巯基乙醇)1.5 mL,将研磨液放入离心管中,65 ℃水浴1 h,每隔10 min摇匀1次,水浴结束后,4 ℃、12 000 r/min离心20 min;吸取上清液750 μL,加入等体积的氯仿—异戊醇(24∶1)(预冷),4 ℃、12 000 r/min离心10 min;吸取上清液600 μL,继续加入等体积预冷的氯仿—异戊醇,4 ℃、12 000 r/min离心10 min;吸取上清液400 μL,加入上清液体积1/10的预冷KAC,再加入总体积2/3的预冷异丙醇,4 ℃静置过夜,然后4 ℃、12 000 r/min离心5 min,弃上清液;加入300 μL的70%乙醇混匀,4 ℃、12 000 r/min离心5 min,重复2次;于4 ℃晾干后加入1×TE缓冲液50 μL溶解DNA,-20 ℃保存。
进行ITS、LSU序列扩增,PCR扩增引物如表1所示。
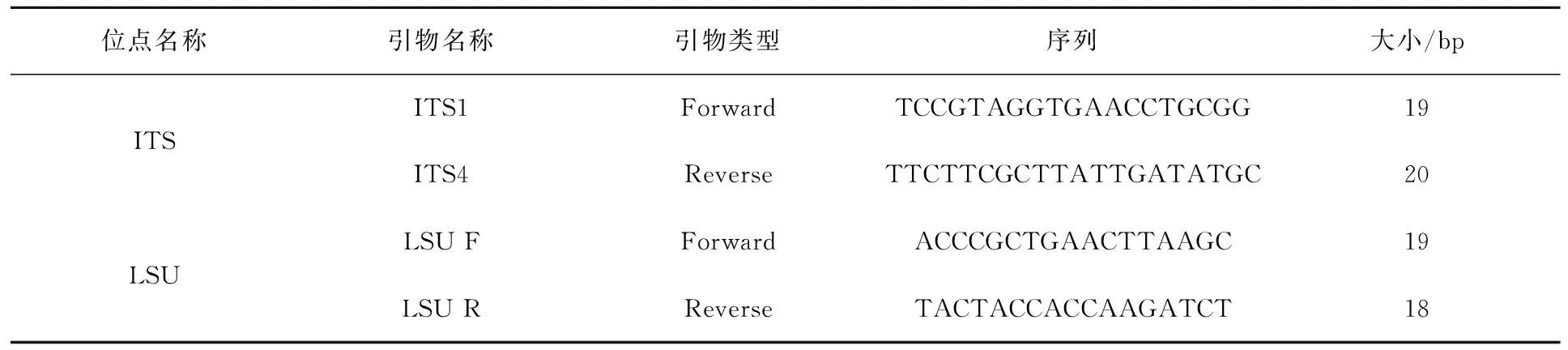
表1 PCR扩增引物Tab.1 PCR amplification primers
扩增反应结束后,取5 μL PCR产物在1 %的琼脂糖凝胶上电泳,同时加入5 μL的D2000 DNA Ladder,120 V电泳30 min,用凝胶成像系统进行成像,合格产物送生工生物工程(上海)股份有限公司进行测序,对测序返回结果使用BioEdit软件进行判断修正,在NCBI数据库中进行比对,identity>97%可视为处于同一属。对所有测序结果用MEGA 7软件构建聚类分析树状图,分析其亲缘关系。
2 结果与分析
2.1 黄绿卷毛菇菌丝体显微结构观察
图1为培养17 d 时8株黄绿卷毛菇菌株在光学显微镜下的显微结构。由图1可知,黄绿卷毛菇菌丝体粗细均匀,分支较少,为有隔菌丝,菌丝体宽度均匀,存在锁状联合,可作为黄绿卷毛菇菌丝体宽度测量的时间节点。

图1 不同黄绿卷毛菇菌株的显微结构Fig.1 Microstructure of Floccularia luteovirens stains
图2为黄绿卷毛菇菌丝体宽度与培养时间的关联性。
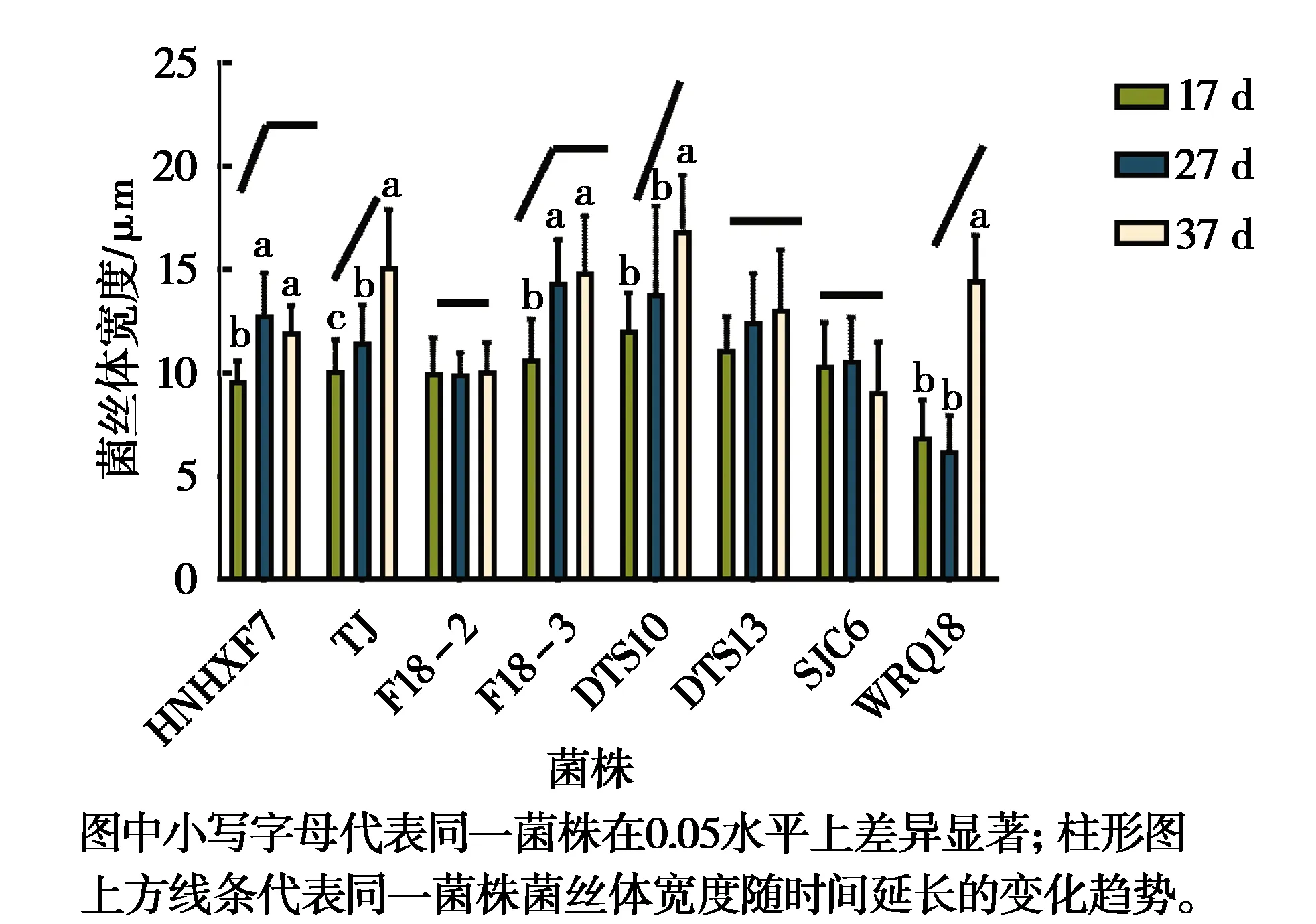
图2 黄绿卷毛菇菌丝体宽度与培养时间的关联性Fig.2 Correlation between mycelial width and culture time of Floccularia luteovirens
培养时间为17、27、37 d时,黄绿卷毛菇菌丝体宽度变化范围为(6.31±1.58)~(17.03±3.61) μm,大部分(62.5%)菌丝体宽度与培养时间呈正相关,菌株F18-2、DTS13及SJC6与培养时间无相关性。
菌丝体生长到17 d,菌株DTS10及DTS13的菌丝体宽度最大,分别为(12.08±1.77)μm、(11.19±1.52)μm。菌丝体生长到27 d,菌株F18-3及DTS10的菌丝体宽度最大,分别为(14.44±1.99)μm、(13.88±4.14)μm;菌株WRQ18菌丝体宽度最小,为(6.31±1.58)μm。菌丝体生长到37 d,菌株DTS10的菌丝体宽度最大,为(17.03±3.61)μm;菌株F18-2及SJC6菌丝体宽度最小,分别为(10.05±1.33)μm、(9.78±2.24)μm。
表2为黄绿卷毛菇菌株在光学显微镜下菌丝体的宽度范围。
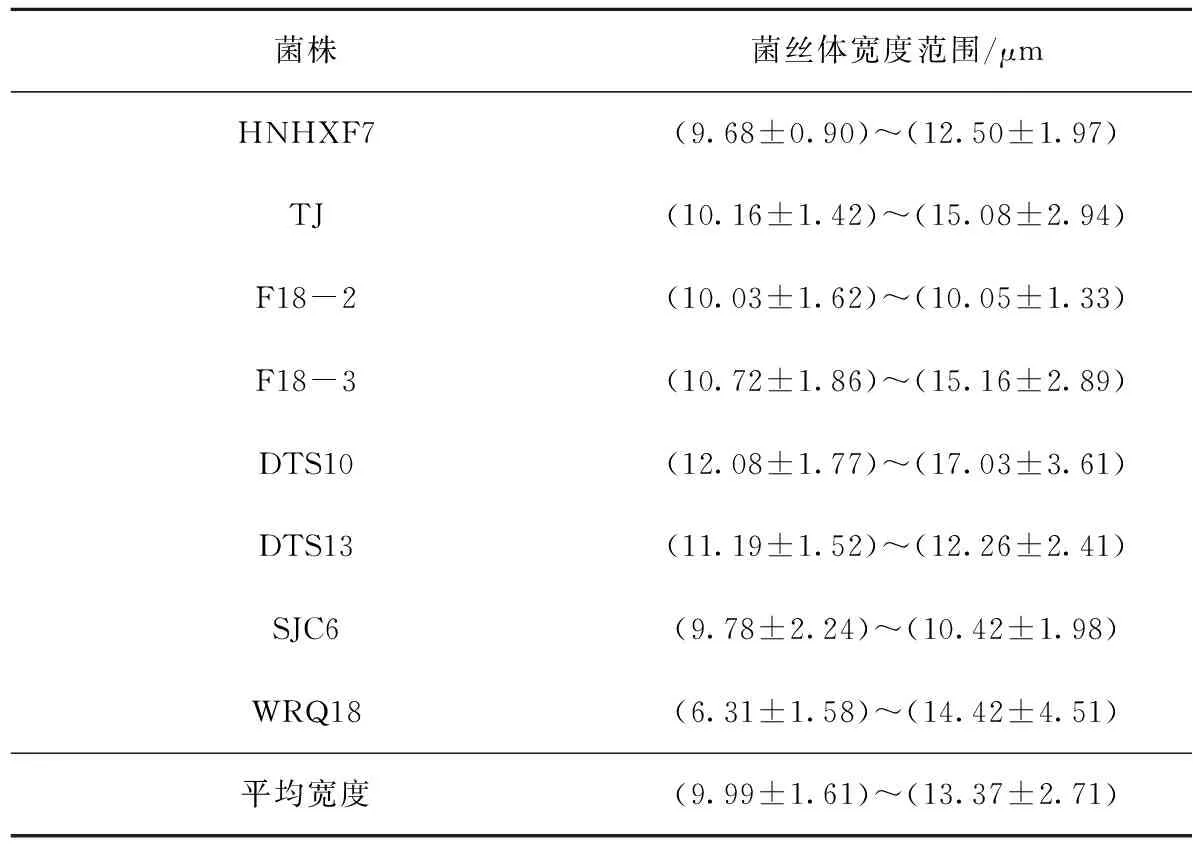
表2 黄绿卷毛菇菌丝体的宽度范围Tab.2 Width ranges of mycelia of Floccularia luteovirens
由表2可知,菌株HNHXF7菌丝体宽度范围为(9.68±0.90)~(12.50±1.97) μm,菌株TJ菌丝体宽度范围为(10.16±1.42)~(15.08±2.94) μm,菌株F18-2菌丝体宽度范围为(10.03±1.62)~(10.05±1.33) μm,菌株F18-3菌丝体宽度范围为(10.72±1.86)~(15.16±2.89) μm,菌株DTS10菌丝体宽度范围为(12.08±1.77)~(17.03±3.61) μm,菌株DTS13菌丝体宽度范围为(11.19±1.52)~(12.26±2.41) μm,菌株SJC6菌丝体宽度范围为(9.78±2.24)~(10.42±1.98) μm,菌株WRQ18菌丝宽度范围为(6.31±1.58)~(14.42±4.51) μm,黄绿卷毛菇菌丝体平均宽度范围为(9.99±1.61)~(13.37±2.71) μm。
2.2 黄绿卷毛菇菌丝体长势与锁状联合数量的相关性
表3为培养17~37 d的黄绿卷毛菇菌株的平均干重、平均日生长速率与锁状联合数量。
由表3统计分析发现,8个黄绿卷毛菇菌株长势可分为优(HNHXF7、TJ、WRQ18)、良(F18-2、F18-3)、中(DTS10、DTS13、SJC6)3个层次,3个层次间差异显著(P<0.05)。3个层次的黄绿卷毛菇菌丝体平均日生长速率分别为优(0.50±0.12) mm/d、良(0.27±0.004) mm/d、中(0.19±0.03) mm/d,平均干重分别为优(841.8±48.01) mg、良(706±50.24) mg、中(498.7±78.42) mg。
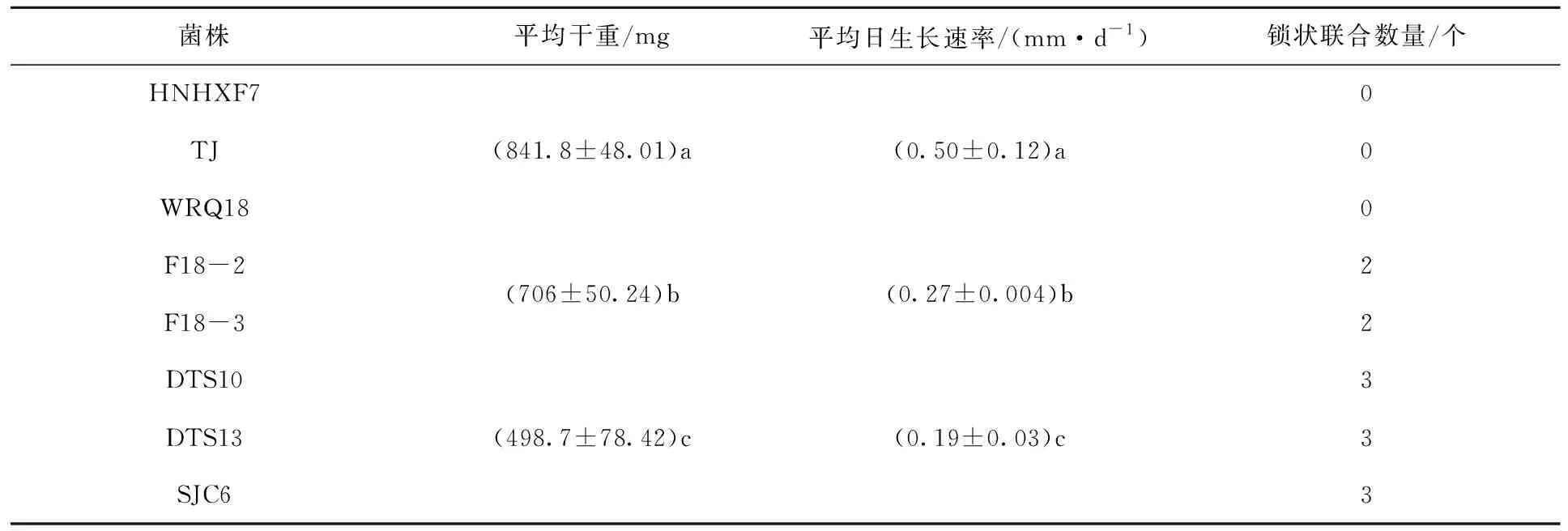
表3 黄绿卷毛菇菌丝体生物量及锁状联合数量Tab.3 Mycelial biomass and the number of clamp connection of Floccularia luteovirens
菌株HNHXF7、TJ和WRQ18没有观察到锁状联合,菌株F18-2、F18-3锁状联合数量均为2个,菌株DTS10、DTS13及SJC6锁状联合数量均为3个。
进一步分析研究黄绿卷毛菇菌株长势(平均日生长速率、平均干重)与锁状联合数量的相关性,如图3所示。

图3 黄绿卷毛菇菌丝体长势与锁状联合数量的相关性Fig.3 Correlation between mycelial growth and the number of clamp connections of Floccularia luteovirens
由图3可知,黄绿卷毛菇菌丝体长势与锁状联合数量呈负相关。锁状联合数量越少,菌丝体生长速度越快。菌株HNHXF7、TJ与WRQ18在光学显微镜下未观察到锁状联合,其平均干重最大,为(841.8±48.01) mg,平均日生长速率为(0.50±0.12) mm/d;菌株F18-2与F18-3锁状联合数量均为2个,平均干重为(706±50.24) mg,平均日生长速率为(0.27±0.004) mm/d;菌株DTS10、DTS13及SJC6锁状联合数量均为3个,平均干重为(498.7±78.42) mg,平均日生长速率为(0.19±0.03) mm/d。
2.3 黄绿卷毛菇多基因系统发育分析
将8个黄绿卷毛菇菌株的ITS及LSU序列分别提交NCBI数据库获得登录号(表4),基于ITS和LSU系统发育树见图4。由图4可知,菌株的长势与进化不存在相关性,除外围菌株,8个菌株很好地与参照菌株序列聚集在一支。参照菌株序列与目的序列相似度为99%,标尺指示为0.05步变化。

表4 黄绿卷毛菇序列提交登录号Tab.4 Serial submission login numbers of Floccularia luteovirens
图4 基于ITS和LSU的系统发育树Fig.4 Phylogenetic tree based on ITS and LSU genes
3 讨论与结论
菌株的微观形态是研究其菌丝体特性的基本方式之一,也是进行菌种保藏、菌种优化的必要条件[8]。本研究发现黄绿卷毛菇菌丝体粗细均匀,显微镜下可观察到明显的锁状联合,菌丝体培养到17 d时,锁状联合数量平均为1.625个,而锁状联合是双核菌丝的鉴定标准,是双核菌丝细胞分裂的一种特殊形式,也是担子菌的明显特征之一[9];菌丝体培养时间为17~37 d时,菌丝体宽度变化范围为(6.31±1.58)~(17.03±3.61)μm,并伴有隔膜,这是担子菌的典型显微特征[10]。
本研究首次发现黄绿卷毛菇菌丝体长势与锁状联合数量呈负相关,锁状联合数量越少,菌丝体生长速度越快。未观察到锁状联合的菌株HNHXF7、TJ及WRQ18平均日生长速率最快,平均干重最大。因此,锁状联合数量是判断黄绿卷毛菇菌株长势的一个重要指标,也是筛选长势优良菌株的重要参数。该结果与刘佳宁等[11]对黑木耳的研究结果有一定的相似性。
本研究仅从菌丝体外观显微结构观察锁状联合的数量,没有深入研究细胞内部结果,今后可进一步研究黄绿卷毛菇染色体核型等显微特征。
