基于MRI深度学习的阿尔茨海默病和轻度认知功能障碍智能诊断:方法与应用☆
2022-08-01朱斌斌周彦伶金陆飞高琳琳汪建华盛芝仁桂煜姚育东刘琳
朱斌斌 周彦伶 金陆飞 高琳琳 汪建华 盛芝仁 桂煜 姚育东 刘琳
阿尔茨海默病(Alzheimer disease,AD)表现为病程6个月以上的不可逆的进行性记忆功能障碍[1]。轻度认知功能障碍(mild cognitive impairment,MCI)是AD的早期阶段,其临床表现不典型,但MCI和轻度的AD患者一样可通过服用药物诸如阿杜卡努单抗来延缓认知的下降[2]。因此AD早期诊断以及MCI的转归预测至关重要。近年来生物化学、遗传学、影像学等学科的不断进步,结合多维度参数联合分析显著提高了AD和MCI的早期诊断准确率[3-4]。例如著名的阿尔兹海默神经影像学计划(Alzheimer disease neuroimaging initiative,ADNI)持续开发标准化的生物标记物,采集包括脑脊液、正电子发射断层扫描(positron emission tomography,PET)及血液等多个指标,为研究人员提供深入广泛的数据。脑脊液采集是有创的手段,昂贵有辐射的PET对β淀粉样蛋白异常沉积的检测也尚未在临床普及[5-6],而磁共振检查作为无创诊断AD有力的武器,已经广泛地用来分析AD患者脑结构和功能的变化。随着人工智能技术的逐步普及,AD分类及AD发展预测的准确率和敏感度不断提高。本文将回顾近5年智能诊断AD的文献,总结其方法和应用的进展。
1 磁共振智能诊断的常见模型及预处理方法
目前科研人员常用深度学习的方法来提高磁共振影像对AD分类的训练效果。通常采用有监督和无监督模式。有监督的训练有输入有输出,比如线性回归、决策树、神经网络、支持向量机(support vector machine,SVM)、Resnet-18、GoogleNet等;无监督的训练只有输入没有输出,比如堆栈自编码网络(stacked auto-encoder network,SAE)模型及聚类算法如k-means、主成分分析(principle component analysis,PCA)、高斯混合模型(gaussian mixture model,GMM)等[7]。卷积神经网络(convolutional neural network,CNN)解读脑磁共振影像来分类和预测AD转变存在一定的局限,因为医学图像的数据集通常较小,且数据库缺乏大样本量有规则的训练,因此研究者往往不能直接训练一个随机初始化的深度学习模型。大部分情况下,研究者首先通过监督学习或非监督学习来预训练神经网络;再将预训练完成的网络作为特征提取器提取特征,或者微调预训练完成的网络以进行相应地医学图像分析。常用的神经网络模型包括前馈神经网络、堆栈式自动编码器(stacked convolutional autoencoders,CAE)、深度信念网络以及图卷积网络(graph convolutional neural network,GCNN)、CNN和循环神经网络(recurrent neural network,RNN)。
对于结构MRI图像的细节处理,需要我们对T1加权MRI数据进行预处理。常用的软件有SPM12、FreeSurfer工具箱等。主要步骤包括去噪、数据扩增(例如移位、旋转、剪切、缩放)以及特征表征的提取,而后者一般包括基于全脑感兴趣区域(region of interest,ROI)的体积测量和基于局部高维形态学分析的测量,但这些测量结果维度很高,数据容易过度拟合。LIU等[8]提出了一种新颖的深度特征学习(landmark based deep feature learning,LDFL)框架,用于从MRI中自动提取补丁的表示,该框架自动诊断阿尔茨海默病的准确率可达90.56%。QIU等[9]研究采用随机补丁样本进行分析,构建了从局部大脑结构到多层感知疾病概率的高分辨率地图,取得96.8%的AD分类准确率。
2 MRI深度学习在MCI患者的智能诊断应用
2.1 MCI和正常对照的分类 静息状态功能磁共振成像(resting-state functional magnetic resonance imaging,rs-fMRI)构建全脑功能连接(function connection,FC)网络(或大脑连接组),并提取基于功能连接特征来区分MCI和正常对照(healthy control,HC)。采用功能磁共振各个功能连接信息集成到基于组稀疏表示(group sparse representation,GSR)的网络构建框架中,实现更高的组间可分离性,这种MCI与HC的分类准确率达到88.5%[10]。CAO等[11]通过从MRI图像中选择一些2D切片,提取代表2D局部信息的特征,这些特征与代表从3D图像中获取的3D全脑信息的功能相结合,以训练一种多视图多模型的学习框架,最后得到87.5%的准确率。
2.2 进展型与稳定型MCI的智能分类 由于进展性MCI(progressive MCI,pMCI)可以发展为AD,而稳定性MCI(stable MCI,sMCI)不会进展,因此临床上鉴别MCI亚型非常重要。SPASOV等[12]采集多个维度的患者信息,包括结构MRI和心理认知量表以及载脂蛋白E(apolipoprotein E,ApoE4)基因特征及人口统计学基线信息,得出区分pMCI和sMCI的受试者工作特征曲线(receiver operating characteristic curve,ROC)的曲线下面积(area under curve,AUC)为0.925,准确率为86%。该项研究采用多任务同步的方法,有助于识别MCI向AD的转换概率以及AD与健康对照的区分。ZENG等[13]用Freesurfer软件对29例pMCI,52例sMCI和102名正常对照进行纵向研究发现,在基线水平pMCI患者的双侧下丘脑,齿状回的分子层和颗粒细胞层、海马角(边内回)和右侧海马尾的体积均小于sMCI患者,而且pMCI患者显示出比sMCI患者更快的海马亚区体积丢失(在双侧下丘脑和齿状回分子层)。随着FreeSurfer这个开源软件包的使用普及,对于AD患者横截面和纵向研究分析将会不断深入。
2.3 可转化为AD的MCI(cMCI)与不转化AD的MCI(ncMCI) 既往研究基于单个3D T1加权图像,采用CNNs来区分c-MCI和s-MCI患者,其准确率高达75.1%[14]。从不同分类角度而言,可转化成AD的MCI(cMCI)和进展型的MCI(pMCI)都是早期干预的重点对象。SUK等[15]在对可转换MCI(MCI-C)和非转换MCI(MCI-NC)进行分类的任务中采用监督与非监督2种方法训练样本,得出83.3%分类准确率。许多研究发现在cMCI与ncMCI分类任务中,最具鉴别性的脑区不完全与AD和HC的分类脑区重合,如吻侧区和前颞上沟中颞回以及海马尾等[16-17],由此可见单纯深度学习方法分析磁共振图像来鉴别有转化可能的MCI存在一定的局限性。RASERO等[18]使用多元距离矩阵回归(multivariate distance matrix regression,MDMR)分析来表征MCI和AD受试者的结构连接模式,发现AD-ncMCI和AD-cMCI之间六个结点均具有重要意义,并且这些结点形成了一个相连的大脑区域(对应于海马、杏仁核、海马旁回、平顶极、额眶皮层、颞极和下皮层),继而降低了MCI中的连接强度。未来需要更多的研究把深度学习方法和脑连接高级分析结合起来共同提高cMCI的识别率。
2.4 早期 MCI(EMCI)与晚期MCI(LMCI)分类 EMCI被认为是AD发病的起点。准确可靠地诊断MCI可以帮助医师确定哪些患者痴呆症状有进展,并为患者提供治疗的条件和机会。GORJI等[19]采用 CNN对 600名 HC、EMCI和LMCI患者的MRI图像进行分类,智能区分EMCI与LMCI的最高分类灵敏度为91.48%,特异性94.82%,准确率93%。RAMZAN等[20]利用Resnet18架构使用单通道输入从头开始训练网络,使用扩展的网络体系结构进行带或不带微调的迁移学习,并通过残差神经网络进行AD分类,得出EMCI与LMCI分别97.38%与97.43%的分类准确率。KAM等[21]通过对rs-fMRI的静态和动态的脑功能网络进行CNN分析,得出其诊断EMCI的准确率比传统方法高10%。随着卷积神经网络的不断进步,未来功能磁共振的研究有望进一步通过提升这种高维度的、基于像素功能连接时空模式识别来提高EMCI的准确率。
3 MRI深度学习在AD患者的智能诊断应用
MRI深度学习的智能诊断包括三个方面:分别是AD与正常对照的分类诊断,AD与pMCI患者的分类诊断,以及MRI深度学习在MCI患者向AD转变的预测。就AD与正常对照鉴别而言,从对大脑感兴趣区域(region of interest,ROI)的直方图描述脑特征[28],到把结构MRI和弥散张量成像DTI数据结合起来,通过CNN的方法得出其主要指标灰质容积和平均扩散率(mean diffusion,MD)的组合,将AD与健康对照区分准确率从88.9%提高到93.5%[16];就AD与轻度认知障碍鉴别而言,学者通过综合残差学习、预先训练和迁移学习的方法,得到了相比传统2D-CNN与3D-CNN模型分类更为精确的结果[27];就MRI深度学习在MCI向AD转变的预测而言,有研究基于T1相MRI序列深度学习磁共振进行智能分析时,将患者年龄与认知量表评分纳入分析可以提高对MCI向AD转化的预测。WEE等[26]从皮质厚度的CNN分析角度准确预测了75%~92%患者从晚期MCI转化到AD,未来需要更多的研究来比较基于体素的分析和基于皮质厚度的分析在MCI向AD转化的预测效果。具体参见表2。
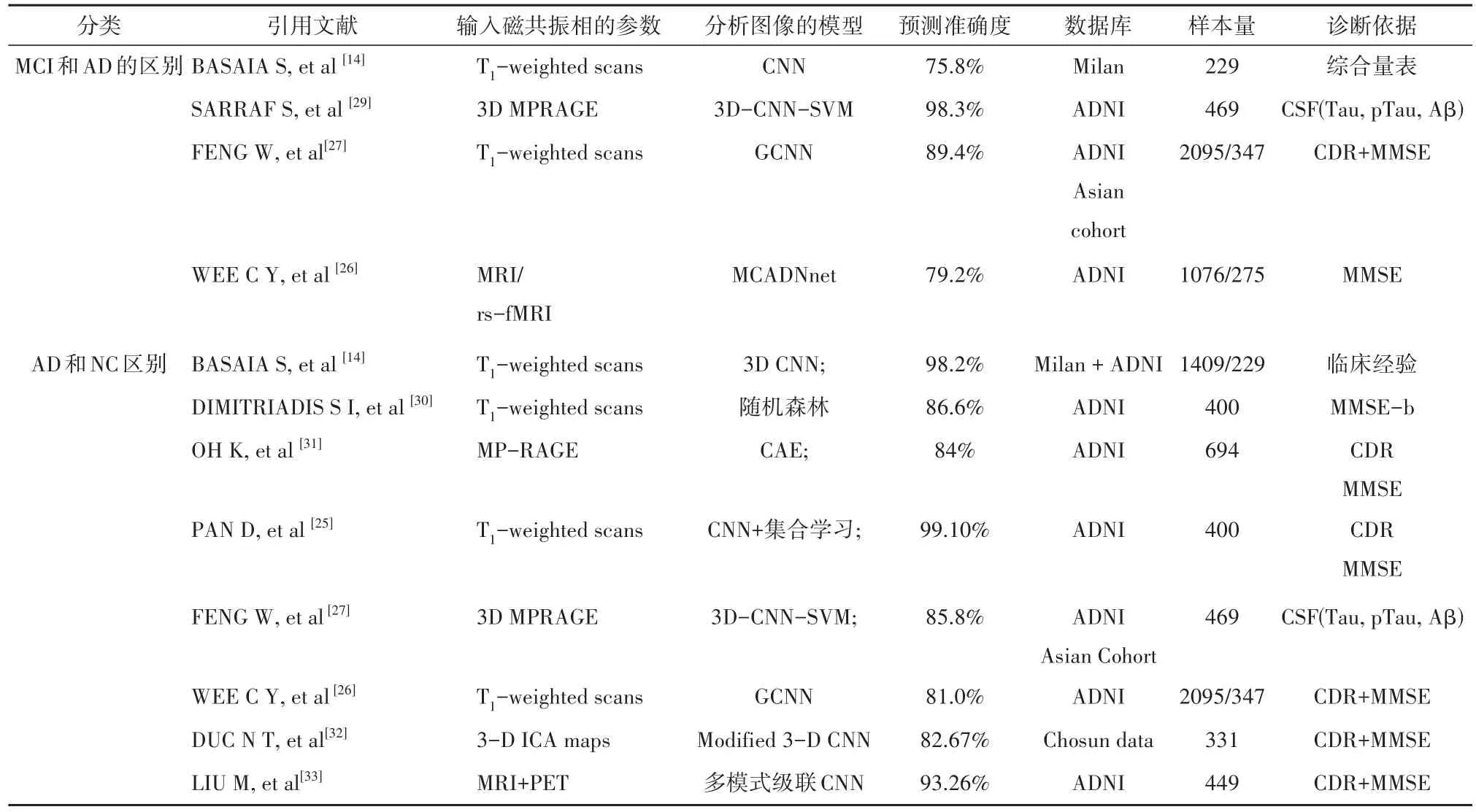
表2 基于磁共振影像深度学习在阿尔茨海默病的应用相关文献总结
4 总结和展望
在AD的智能诊断实际开展过程中,人们需要解决MRI图像种类多、差异难融合,正常衰老和AD患者大脑结构之间存在相似性,以及患病个体之间存在差异性等客观困难,同时还需要克服模型容易过拟合的现状,以便于提高分类和预测AD的准确率,目前常用的策略:第一,优化CNN结构,如Siamese卷积神经网络(SCNN)[34],它能够在小样本影像图像分析得出AD不同阶段分类的结果[34]。GOCERI等[35]把基于Sobolev梯度的优化算法与3D CNN拓扑结合应用于阿尔茨海默病的诊断,得出了鉴别AD与正常对照98.06%的准确率,可以说是优化智能诊断的典范。第二,采用迁徙学习的策略,也就是采用多样的算法与模型来区分AD的亚型。如RAMZAN等[20]对rs-fMRI采用3种基于Resnet-18的神经网络来区分AD的不同阶段,发现其中OTS这种迁移学习的预测准确率平均高达97.92%。
当深层的网络难以训练时,增加的层数无法更好地机器学习,残差网络的出现解决了深度网络开始收敛时准确率下降的问题[20]。CHEN等[36]利用VoxResNet这种残差网络成功解决了训练深度网络时缓解退化问题,同时实现了精确的大脑分割。Abrol利用改良的深层残留神经网络(ResNet)在研究从MCI到AD进展的特定应用,进行域迁移学习在AD和控件上进行额外的训练。与传统支持向量机和堆叠式自动编码器框架相比,Resnet体系结构显著提高了预测性能[37]。这些探索为将来AD的精准智能诊断打下了基础。
综上所述,深度学习训练和多层神经网络测试能够学习复杂的磁共振图像结构和实现高水平的特征提取,越来越广泛地应用在AD智能诊断上。尽管结合PET和脑脊液生物标记物样本的诊断信服力高,但是日常临床中不易同时获得这些数据,随着各种人工智能辅助分析软件的不断升级[38],技术人员采用数据扩增,迁移学习以及残差网络等策略,有望实现对于小样本的MRI图像进行智能诊断,最终结合临床数据,获得较高的AD分类和预测准确率。
我们希望更多的MRI研究来提升AD智能诊断准确率,如能与传统有创的预测诊断方法形成显著的优势,将为AD早期高效的诊断以及积极干预提供实践依据。
致谢:本文得到了宁波大学智能研究院姚育东院士的指导,并在汪建华教授、王钦文研究员和周玉平教授的指导下撰写提纲。
