凝血酶冻干粉不良反应分析与临床错误用药的思考
2022-07-31谭新梅钟露苗王圣华谷白玉乐艺王干黎鸠鸠
谭新梅,钟露苗,王圣华,谷白玉,乐艺,王干,黎鸠鸠
1 湖南一格制药有限公司,湘潭 411100;2 湖南省药品审评认证与不良反应监测中心,长沙411000
凝血酶冻干粉是牛血或猪血中提取的凝血酶原经激活而得的口服或局部止血用无菌冻干制品。凝血酶应用广泛,可促使纤维蛋白原转化为纤维蛋白,使血液凝固而止血,适用于治疗手术中不易结扎的小血管出血、消化道出血及外伤出血等[1-4]。该药必须直接与创面接触才能起到止血作用,且必须新鲜配制使用,给药途径限于局部外用或口服,严禁注射。凝血酶误入血管可导致血栓形成、局部坏死甚至危及生命。中国药学会医院药学专业委员会发布了《中国高警示药品推荐目录》(2019 版)[5-6],其中就包含凝血酶冻干粉。
本研究对收集到的国家药品不良反应监测系统中与凝血酶冻干粉相关的不良反应/不良事件(adverse drug reaction/event,ADR/ADE) 报告进行了统计分析,并对与凝血酶冻干粉名称相似的药品及其用药途径、临床误用药物等进行了多维度的分析与探讨,旨在促进凝血酶冻干粉的临床合理用药、避免错误使用。
1 资料与方法
1.1 资料来源
在国家药品不良反应监测系统中,收集2011~2020 年期间凝血酶冻干粉相关ADR/ADE报告共43 例。在国家药品监督管理局(以下简称“国家药监局”)官网中查询与凝血酶冻干粉名称相似的药品共7 种。
1.2 研究方法
国家药监局于2012 年9 月发布《药品定期安全性更新报告撰写规范》,该规范对用药人数估算资料进行了说明:“通常基于限定日剂量来估算用药人数,可以通过患者用药人日、处方量或单位剂量数等进行估算;无法使用前述方法时,也可以通过药品销量进行估算。对所用的估算方法应给予说明。”
凝血酶冻干粉说明书中用法用量项未规定限定日剂量,因此本研究以每位患者至少使用1 瓶凝血酶冻干粉计、按药品销量估算用药人数。本企业在2011~2020 年期间共销售凝血酶冻干粉19 548 010瓶,通过药品销量估算约有19 548 010 人使用。国家药品不良反应监测系统共收到43 例凝血酶冻干粉相关ADR/ADE报告,ADR/ADE发生率为0.0002%,但不能排除因漏报导致计算结果偏低的情况。
2 结果
2.1 ADR/ADE 报告年度分布情况
本企业2011~2020 年期间凝血酶冻干粉的用药人数估算及ADR/ADE 发生率详见表1。其中,2019 年ADR/ADE 报告数量最多(8 例,18.6%),2016 年ADR/ADE 发生率最高,为0.000 429%。
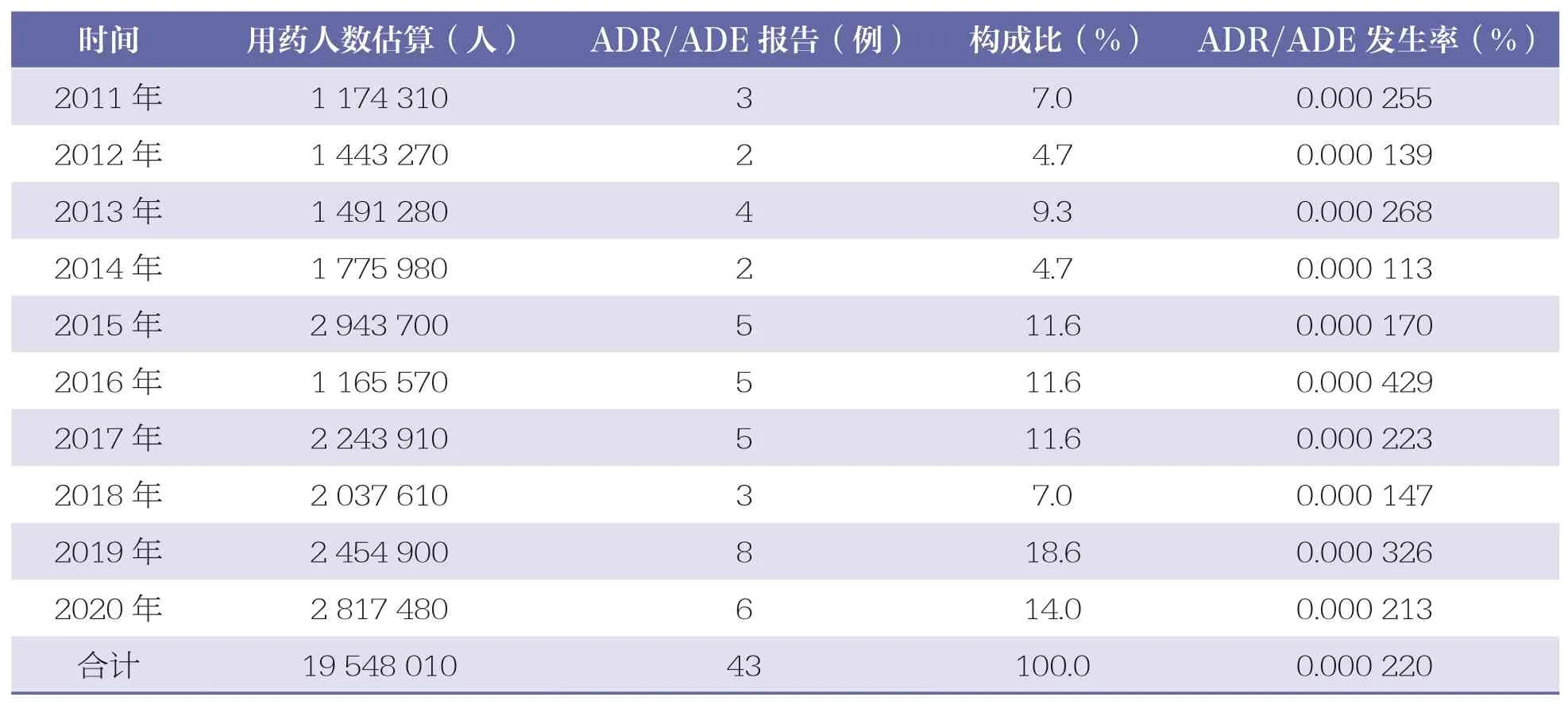
表1 凝血酶冻干粉ADR/ADE 报告年度分布情况
2.2 性别和年龄分布情况
43 例ADR/ADE 报告中,男性21 例(48.8%),女性22 例(51.2%),男女比例为1∶1.05;60 岁以上患者使用最多(20 例,46.5%),表明老年患者使用凝血酶冻干粉后发生ADR/ADE 的几率相对较高。详见表2。

表2 凝血酶冻干粉致ADR/ADE 患者性别和年龄分布 n(%)
2.3 凝血酶冻干粉致ADR/ADE 累及系统/器官及主要临床表现
43 例ADR/ADE 报告中,共涉及临床表现60例次。累及系统/ 器官排名第1 为胃肠系统损害(31 例次,51.7%),主要表现为腹痛、腹泻、胃不适、恶心、呕吐、上腹部烧灼感;排名第2 为全身性损害(12 例次,20.0%),主要表现为过敏反应、发热、局部发冷、局部颤抖、寒战、畏寒;排名第3 为皮肤及附件损害(7 例次,11.7%),主要表现为皮疹和瘙痒。此外,还涉及心血管系统一般损害(5 例次,8.3%)、呼吸系统损害(4 例次,6.7%)、中枢及外周神经系统损害(1 例次,1.7%),详见表3。

表3 凝血酶冻干粉致ADR/ADE 累及系统/器官及主要临床表现
2.4 ADR/ADE 发生时间
43 例ADR/ADE 报告中,20 例写明了ADR/ADE的具体发生时间,主要集中在用药后30min内,占75.0%。详见表4。
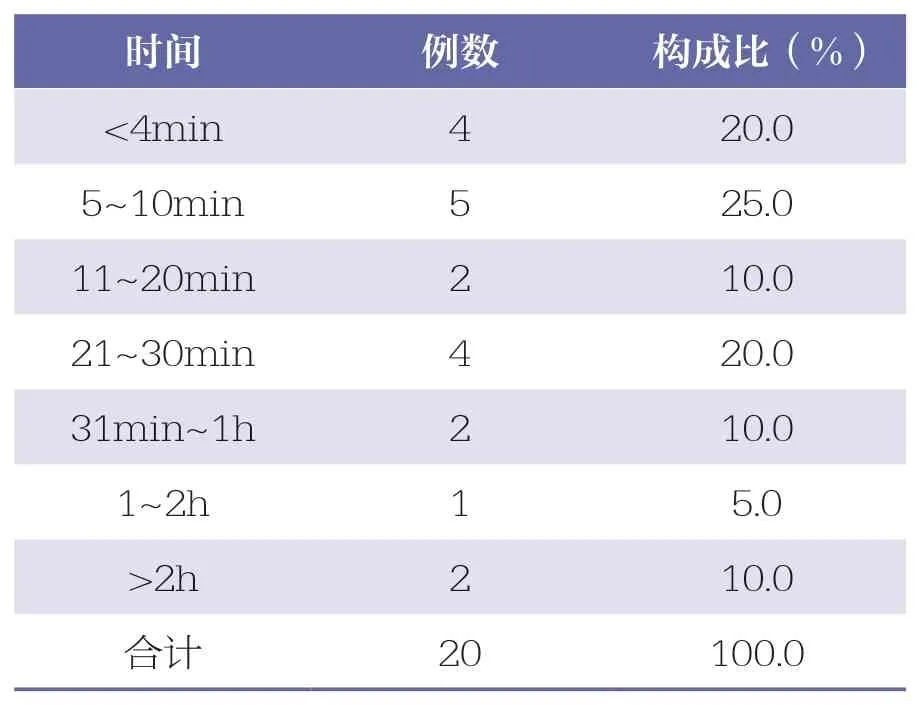
表4 ADR/ADE 发生时间分布
2.5 ADR/ADE 转归
43 例ADR/ADE 均好转(29 例,67.4%)或痊愈(14 例,32.6%)。
2.6 原患疾病
43 例ADR/ADE 报告中,患者原患疾病主要为消化道出血、术后出血、骨折出血、脑出血和硬膜外出血等,详见表5。

表5 患者原患疾病情况
2.7 用法用量
43 例ADR/ADE 报告中,符合药品说明书的用法中口服用药最多(29 例,67.4%),其次为局部灌注(2 例,4.7%)、外用(2 例,4.7%)、鼻饲(1例,2.3%)等。凝血酶冻干粉说明书和标签上均有明显的严禁注射警示语,但本研究中有5 例静脉滴注(11.6%)和1 例静脉注射(2.3%)。详见表6。
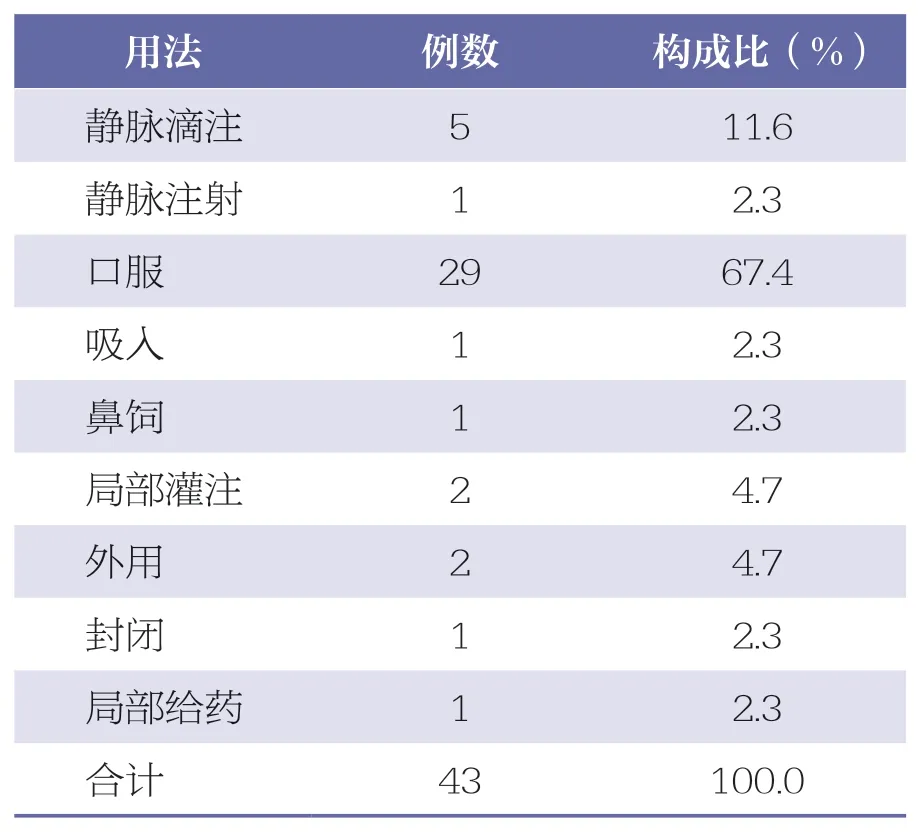
表6 凝血酶冻干粉的用法
凝血酶冻干粉说明书中规定临床使用方法为:①局部止血:用灭菌氯化钠注射液溶解成每1ml 中含50~200 单位的溶液喷雾或用本品干粉喷洒于创面。②消化道止血:用生理盐水或温开水(不超过37℃)溶解成每1ml 中含10~100 单位的溶液,口服或局部灌注,也可根据出血部位及程度增减浓度、次数。说明书仅对凝血酶冻干粉的用药浓度进行了规定,而未规定给药总量。43 例ADR/ADE 报告中,有28 例给药总量不详(65.1%),有2 例的药物浓度偏低(4.7%),仅为4 单位/ml 和5 单位/ml,详见表7。
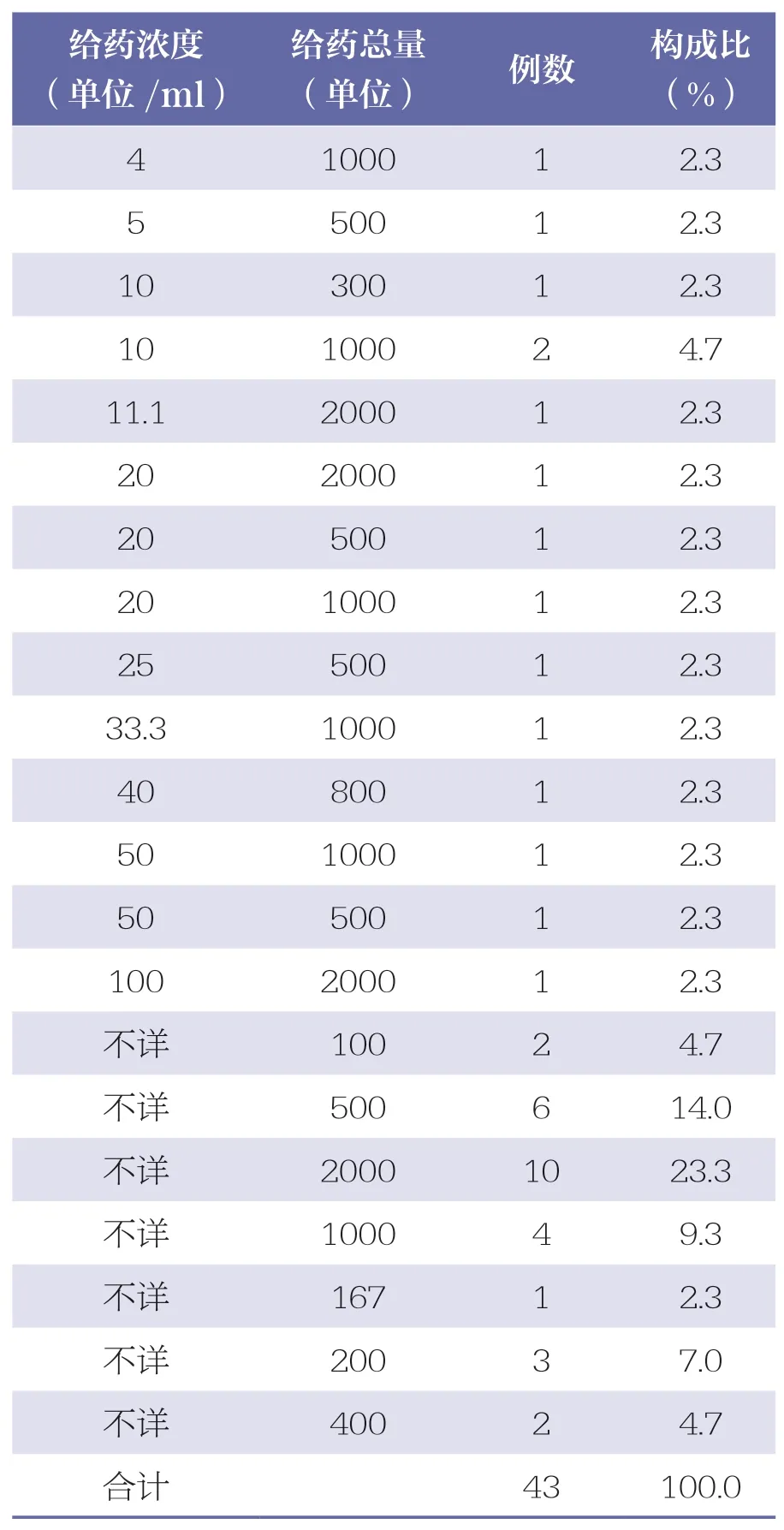
表7 凝血酶冻干粉的用量
2.8 凝血酶冻干粉的溶媒
43 例ADR/ADE 报告中,未涉及其他对症治疗的药物,主要是溶媒不同。其中氯化钠注射液使用最多(13 例,30.2%),其他4 例(9.3%),不详的有26 例(60.5%)。详见表8。
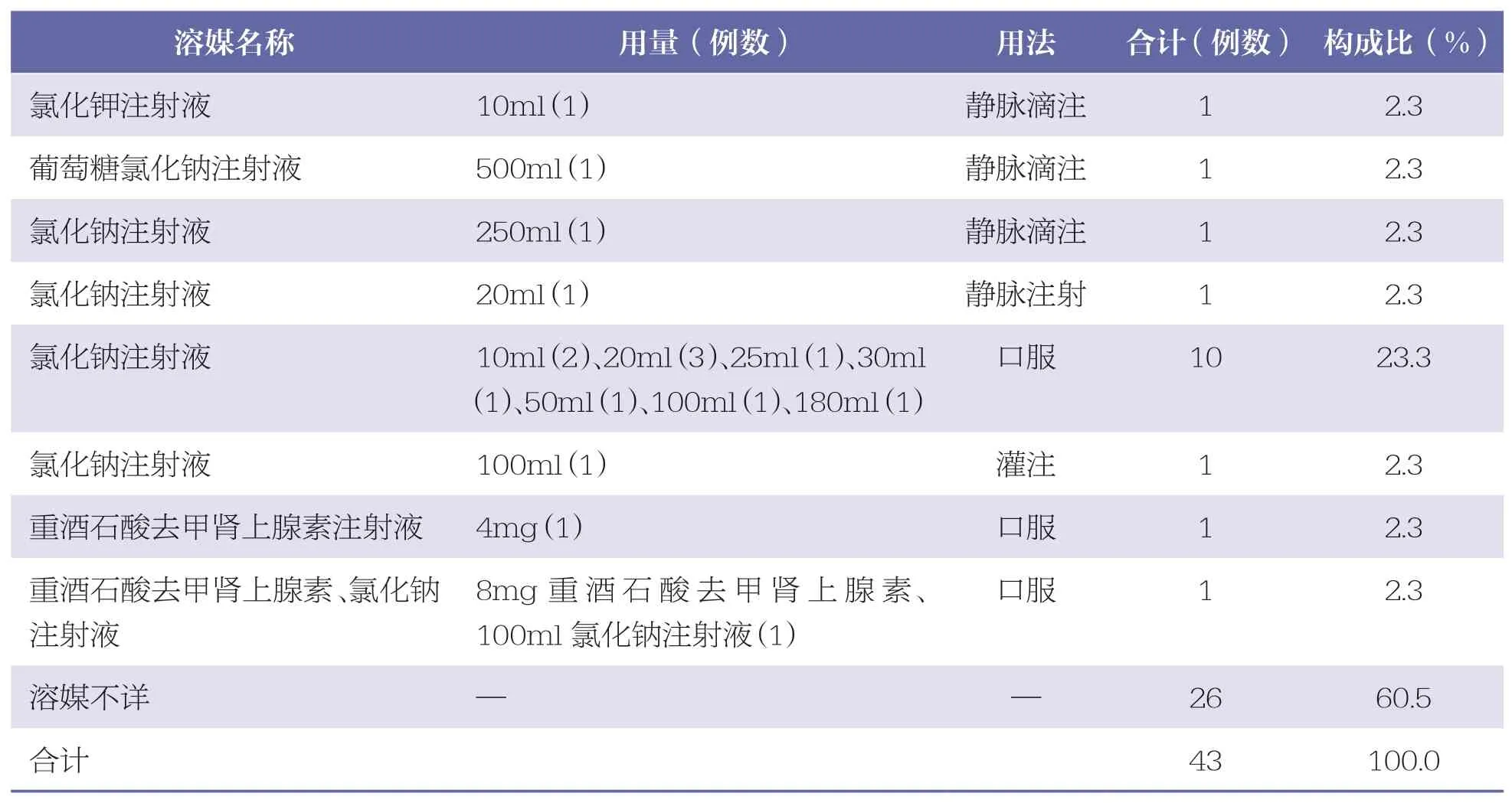
表8 凝血酶冻干粉的溶媒
2.9 与凝血酶冻干粉名称相似的药品
凝血酶应用广泛,在外用止血治疗中发挥了重要作用,但其与上市药品血凝酶名称相似。临床用药中,也有部分将凝血酶冻干粉注射给药从而导致ADR/ADE 的情况发生[7-8]。查询国家药监局官网中与凝血酶冻干粉名称相似的药品共7 种,对应的用药途径见表9。
由表9 可知,与凝血酶冻干粉名称相似的药品,其用药途径也略有不同,这增加了错误用药的风险。有专家曾就此提出凝血酶冻干粉更名的建议,但在国家卫生健康委办公厅等12 个部门联合发布的《关于印发国家短缺药品清单的通知》中,凝血酶冻干粉已被纳入国家临床必需易短缺药品重点监测品种,临床对于凝血酶冻干粉更名的认可度尚需多方面斟酌。
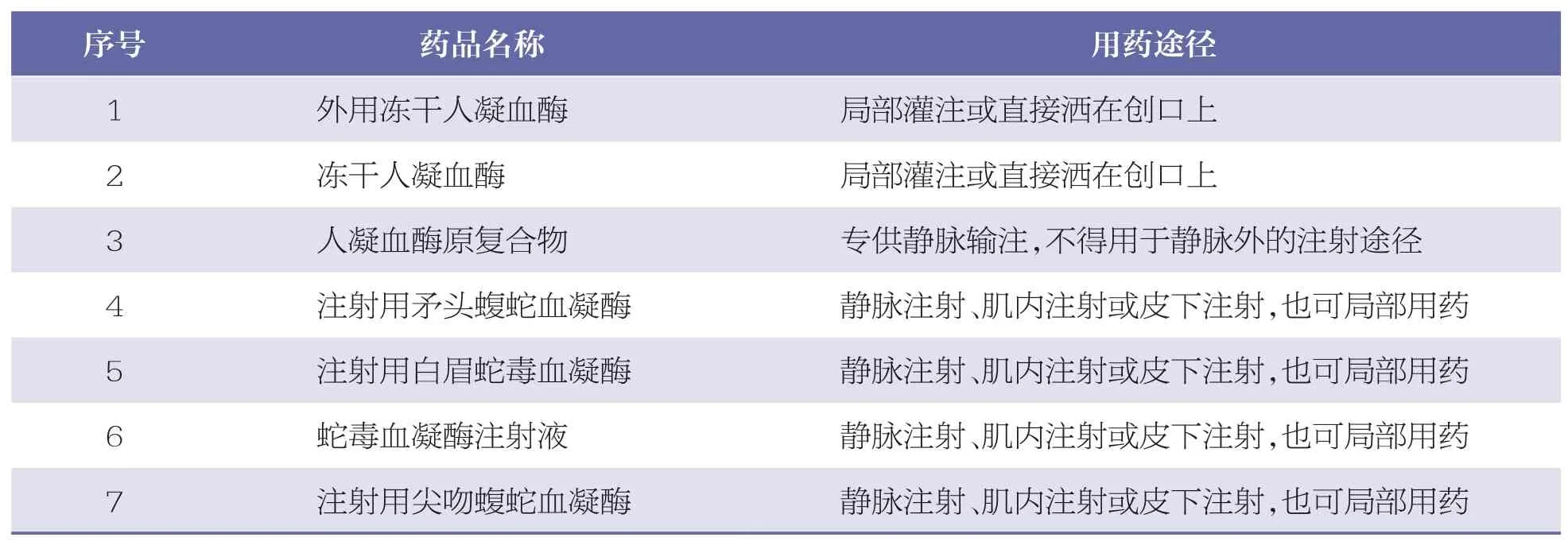
表9 凝血酶冻干粉名称相似的药品及用药途径
3 讨论
本研究结果表明,凝血酶冻干粉致ADR/ADE多发于60 岁以上患者(20 例,46.5%),这可能与老年人体质下降、药物敏感性增加等有关,临床应加强老年患者的用药监护。凝血酶冻干粉致ADR/ADE 累及的系统/器官以胃肠系统损害(31 例次,51.7%)、全身性损害(12 例次,20.0%)、皮肤及附件损害(7 例次,11.7%)为主,大多发生于用药后30min 内;但迟发性ADR/ADE 也仍需关注,以免出现救治不及时的情况。
凝血酶误入血管可导致血栓形成、局部坏死甚至危及生命,因此严禁注射使用凝血酶冻干粉。有研究发现因使用失误,临床出现了注射凝血酶冻干粉的情况[7-8]。本研究中有6 例(13.9%)静脉给药,尽管本研究中的43 例病例均好转或痊愈,其风险仍不可忽视。
4 建议
文献及大数据分析提示错误使用凝血酶冻干粉可能与药品因素、人员因素、环境因素、处方因素等有关[7-11]。国内外的实践和研究证明,信息化是减少错误用药的有效手段,尤其在医生开具处方的环节,且临床易实施[12-13]。Avery 等[12]发现以药师为主导的信息技术综合干预可有效降低医生处方环节的错误用药率。信息化中最核心的部分是在电子医嘱中嵌入安全警示信息,错误用药大多为处方差错,包括剂量、给药途径、给药频次、溶媒等,可通过设定药品的固定化用法或优先用法等方法加强药品的信息维护,以避免用药错误[13]。
美国国家用药错误报告及预防协调委员会(National Coordination Council for Medication Error Reporting and Prevention,NCC-MERP)将用药错误定义为“医疗专业人员、患者或消费者自身在药物使用过程中,发生的任何可能导致药物错误使用或对患者造成伤害的可预防事件”[14]。临床实践中,凝血酶冻干粉的有效性和安全性毋庸置疑,但仍有可能因错误用药而发生ADR/ADE,这主要与信息沟通不畅、药物包装非标准化、用药管理不规范、工作环境不良等因素有关。对于生产企业而言,明确标注药品的正确使用方式是比较简单且容易操作的改进方法。基于此,本企业对凝血酶冻干粉的标签和包装设计进行了改进,明确标注正确使用方式(本品仅供口服和外用)、加高警示药品标识,正向引导临床合理用药,并逐步在凝血酶冻干粉不同规格的产品中应用。产品标签、包装设计改进方式见表10;铝塑盖样式见图1;标签样式见图2;新的瓶标签样式见图3。

图3 新的瓶标签样式
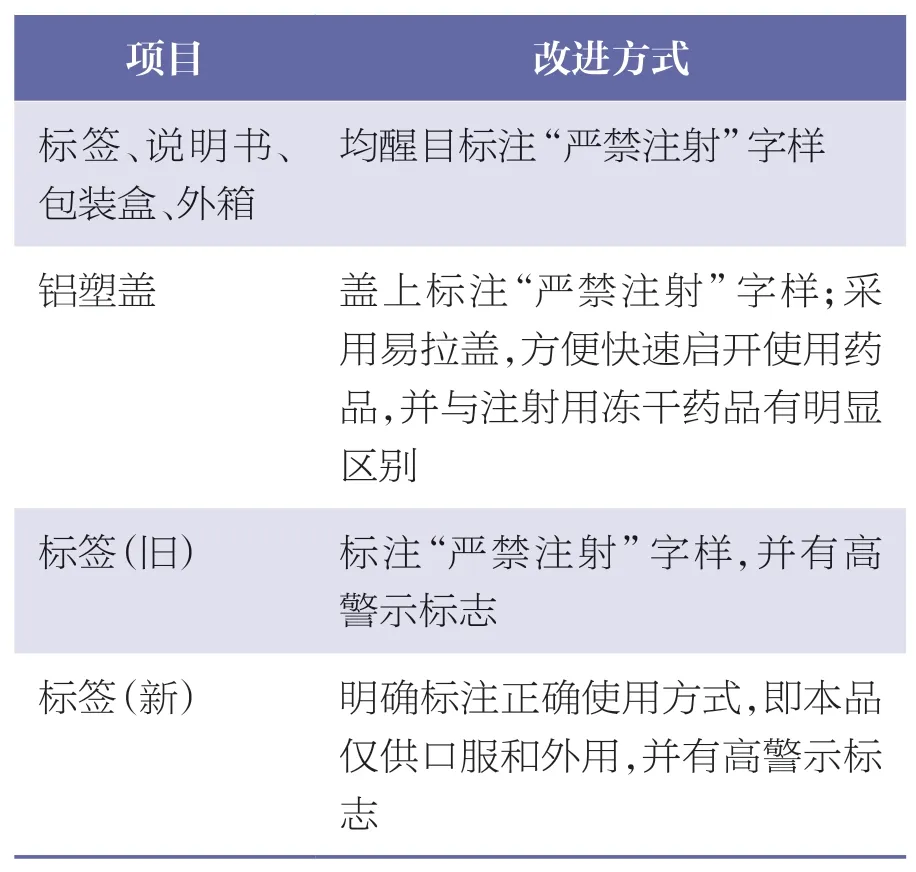
表10 产品标签、包装设计改进方式

图1 铝塑盖样式

图2 标签样式
目前凝血酶冻干粉的生产涉及19 个企业、74个药品批准文号,建议已上市或即将生产上市的相关企业加强共识,改进标识标签,加大预防错误用药的培训与宣传力度。同时企业也可考虑改进瓶盖设计,建议铝盖、胶塞设计为一次性开启至完全敞开状态,无法实现插针注射溶媒,且必须完全开盖后才能进行药物溶解,从多个环节预防用药错误,避免不良事件的发生。
