邻二氮菲测铁的实验教学改进与实践
2022-07-30张悦王晓艳高素华
张悦,王晓艳,高素华
天津理工大学化学化工学院,天津 300384
邻二氮菲测铁实验是各大高校化学及相关专业学生必做的实验。实验原理是在pH为2-9的溶液中,Fe2+与邻二氮菲生成稳定的红色配合物[1]。实验内容通常为条件实验或标准曲线法测定未知水样中的铁含量。通过此次实验,加强学生对实验基本原理的理解,同时,熟悉并掌握分光光度计的使用方法,掌握标准曲线法测定水溶液中微量铁。近年来,许多高校对邻二氮菲测定铁实验进行了内容扩充及方法改进,如采用手持技术、增设采用不同光谱法含量测定对比或样品前处理的实验环节、Origin/Excel软件辅助分析实验数据等[2-8]。
我院前期通过统一更新722型分光光度计为普析通用T6紫外-可见分光光度计,降低本实验操作的繁琐度,同时,采用Excel进行标准曲线的回归,提高实验效率的同时,突出本实验的教学目标。但在本实验的教学过程中,仍发现有诸多问题。我校分析化学实验在大一年级开设,在预习和课堂教学互动过程中发现,学生对实验原理理解并不到位,如课堂提问“本次实验原理是……”,大部分学生根据讲义都能答出“Fe2+与邻二氮菲生成稳定的红色配合物”;但当问及“本次实验测定的是总铁?Fe3+还是Fe2+?”“邻二氮菲测铁为什么要找最大吸收波长”时,只有个别学生能够回答出大概的原因。另外,在课后学生教学反馈中,部分同学对Fe3+与邻二氮菲络合是否对Fe2+与邻二氮菲络合有影响存在疑问;部分同学对标准曲线法测定未知水样的实验流程及数据处理的理解也不到位;少部分学生实验做完,却仍然不能明白实验设置的目的是什么。
因此,本实验对邻二氮菲测铁实验进行了改进,在原有内容的基础上,让学生对实验原理部分“Fe2+与邻二氮菲生成稳定的红色配合物,Fe3+也可与邻二氮菲生成淡蓝色配合物”进行实验验证;在测定吸收光谱的同时,计算不同波长处的摩尔吸光系数;同时,测定并计算未知水样中的总铁、Fe2+和Fe3+。同时,基于笔记本电脑的普及,通过Excel、Origin软件进行数据处理和作图。实验内容的改进,旨在充分调动学生主观能动性,同时让学生亲自通过实验结果解决困惑,加深学生对基本原理及操作的理解,在掌握分光光度法的基础上,引导学生学习解决实际问题的方法。
1 实验内容
1.1 实验目的
掌握分光光度计的使用方法;掌握邻二氮菲测铁的基本原理;掌握标准曲线法测定未知水样中铁的浓度。
1.2 实验原理
在pH = 2-9的溶液中,邻二氮菲与Fe2+生成稳定的红色配合物[Fe(phen)3]2+,其lgK稳= 21.3 (20 °C)。红色配合物的最大吸收峰在510 nm处,摩尔吸光系数ε= 1.1 × 104L·mol-1·cm-1。
Fe3+也可与邻二氮菲生成淡蓝色配合物,其稳定常数lgK稳= 14.1 (20 °C)。因此,在测定总铁时,显色之前应预先用盐酸羟胺将Fe3+还原Fe2+。
1.3 仪器与试剂
仪器:T6紫外-可见分光光度计(北京普析通用)、1 cm玻璃比色皿。
试剂:盐酸羟胺(100 g·L-1,现配现用)、盐酸溶液(6 mol·L-1)、邻二氮菲溶液(1.5 g·L-1新配制)、NaAc溶液(1 mol·L-1)、Fe3+标准溶液(含铁0.1 mg·mL-1)。
1.4 实验步骤
(1) 吸收曲线的绘制。
邻二氮菲-Fe3+络合物吸收曲线:精确移取1.00 mL Fe3+标准溶液(0.1 mg·mL-1)注入50.00 mL容量瓶中,依次加入2.00 mL邻二氮菲、5.00 mL NaAc,用去离子水稀释至刻度,摇匀。以试剂空白溶液为参比,在440-560 nm之间每10 nm测定一次吸光度(其中在500-530 nm范围内,每间隔5 nm测量一次。每调一次波长,仪器都要调零),以波长为横坐标,以吸光度为纵坐标,用Excel软件绘制吸收曲线。
邻二氮菲-Fe2+络合物吸收曲线:精确移取1.00 mL Fe3+标准溶液(0.1 mg·mL-1)注入50.00 mL容量瓶中,加入1.00 mL盐酸羟胺,摇匀,再依次加入2.00 mL邻二氮菲、5.00 mL NaAc,用去离子水稀释至刻度,摇匀。以试剂空白溶液为参比,在440-560 nm之间每10 nm测定一次吸光度(其中在500-530 nm范围内,每间隔5 nm测量一次。每调一次波长,仪器都要调零),以波长为横坐标,以吸光度为纵坐标,用Excel软件绘制吸收曲线,确定最大吸收波长λmax。
(2) 标准曲线的绘制。
精确移取5.00 mL Fe3+标准溶液(0.1 mg·mL-1),加入2.00 mL 6 mol·L-1盐酸溶液,定容于50 mL容量瓶,为0.01 mg·mL-1Fe3+标准溶液。在6个50 mL容量瓶中分别加入0.00、2.00、4.00、6.00、8.00、10.00 mL 0.01 mg·mL-1Fe3+标准溶液,加入1.00 mL盐酸羟胺,摇匀,再依次加入2.00 mL邻二氮菲、5.00 mL NaAc,用去离子水稀释至刻度,定容后放置10 min。在最大吸收波长处,以试剂空白溶液为参比,分别测定吸光度。以浓度为横坐标,以吸光度为纵坐标,用Excel软件对数据进行线性回归处理,记录线性方程及R2。
(3) 未知样品的测定。
精确移取一定体积未知样品溶液于50.00 mL容量瓶中,加入1.00 mL盐酸羟胺,摇匀,再依次加入2.00 mL邻二氮菲、5.00 mL NaAc,用水稀释至刻度,定容后放置10 min。在最大吸收波长处,以试剂空白溶液为参比,测定吸光度(吸光度需在标准曲线范围内,如远高于标准曲线中最大浓度标样的吸光度,调整样品的移取体积或对样品进行逐级稀释)。根据线性方程计算稀释后样品中总铁含量,并计算原样浓度。
精确移取一定体积未知样品溶液于50.00 mL容量瓶中,依次加入2.00 mL邻二氮菲、5.00 mL NaAc,用水稀释至刻度,定容后放置10 min。在最大吸收波长处,以试剂空白溶液为参比,测定吸光度(吸光度需在标准曲线范围内,如远高于标准曲线中最大浓度标样的吸光度,调整样品的移取体积或对样品进行逐级稀释)。根据线性方程计算稀释后样品中Fe2+含量,并计算原样浓度。
2 实验结果评价
2.1 实验数据分析评价
分析化学实验室有8台紫外-可见分光光度计,每班学生人数在30左右。因此,本实验将一个班分成8个小组,每组3-4人。教师讲解实验原理和分光光度计的使用方法后,学生根据实验步骤完成相关内容,并进行数据处理。
根据实验步骤(1)所得数据绘制吸收曲线,如图1所示。从图中可以看出,邻二氮菲-Fe2+形成的配合物的吸光度随波长的增大,先增大后减小,存在最大吸收波长。计算邻二氮菲-Fe2+、邻二氮菲-Fe3+络合物不同波长处的摩尔吸光系数,结果见表1、表2。通过摩尔吸光系数的计算,让学生进一步理解朗伯比尔定律公式在实际中的应用。A=εbc,当c浓度一定时,使用相同的比色皿,b也为常数,因此,吸光度A与摩尔吸光系数成正比。在最大吸收波长处,摩尔吸光系数最大,灵敏度最高。这也是本实验确定最大吸收波长的原因。
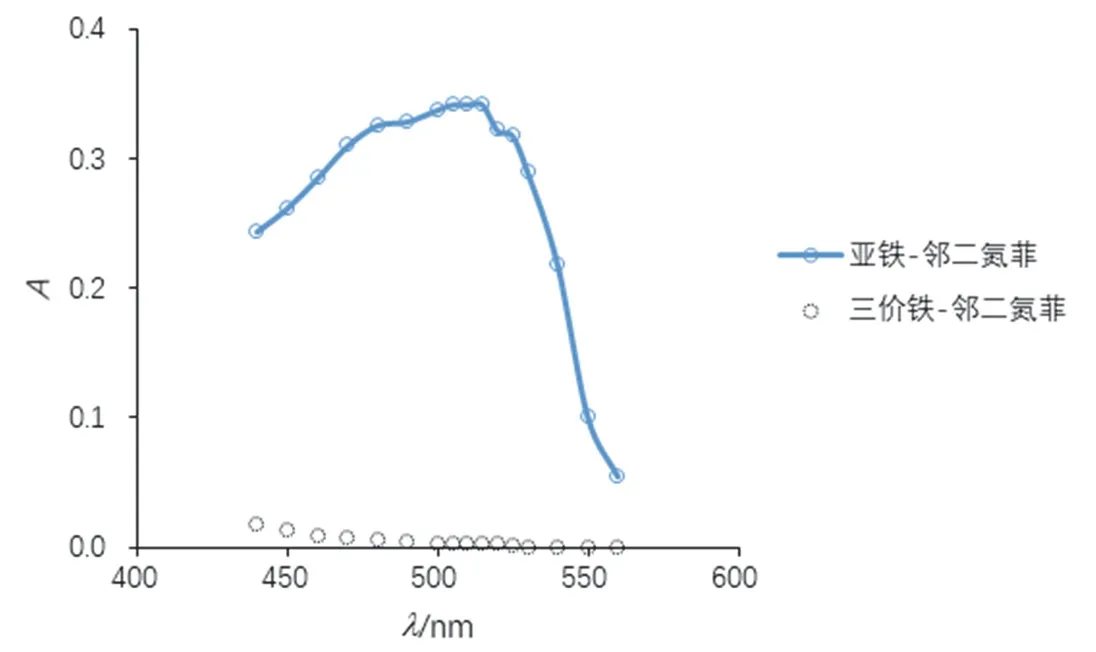
图1 吸收曲线

表1 邻二氮菲-Fe2+吸收曲线数据

表2 邻二氮菲-Fe3+吸收曲线数据
另一方面,值得注意的是,邻二氮菲-Fe3+形成的配合物的吸光度较小,在510 nm处仅为0.003,其摩尔吸光系数仅为84 L·mol-1·cm-1,远小于9576 L·mol-1·cm-1(邻二氮菲-Fe2+)。因此,Fe3+对邻二氮菲-Fe2+配合物吸光度的影响可以忽略。这也是本方法可以用于测定总铁、Fe2+的原因。在本次实验中,为加深学生印象,吸收曲线溶液配制浓度较高。在后续教学中,也尝试过以0.0004 mg·mL-1标样(即表3中标1)进行吸收曲线的测定,测定邻二氮菲-Fe2+配合物摩尔吸光系数为10220 L·mol-1·cm-1,更接近教材中的数值(1.1 × 104L·mol-1·cm-1)。
根据实验步骤(2) (3)所得数据绘制标准曲线,如表3所示。标准曲线数据经Excel线性回归处理后,得到线性方程A= 201.75c- 0.0099,线性回归系数R2= 0.999,见图2。根据线性方程可计算出稀释后水样的浓度,见表3。未知水样稀释25倍后,总铁浓度c(Fe)为0.0017 mg·mL-1,亚铁离子浓度c(Fe2+)为0.0012 mg·mL-1,三价铁离子浓度c(Fe3+)为c(Fe) -c(Fe2+),为0.0005 mg·mL-1。最后根据稀释倍数,可进一步计算原样中的c(Fe)、c(Fe2+)及c(Fe3+)。

图2 标准曲线
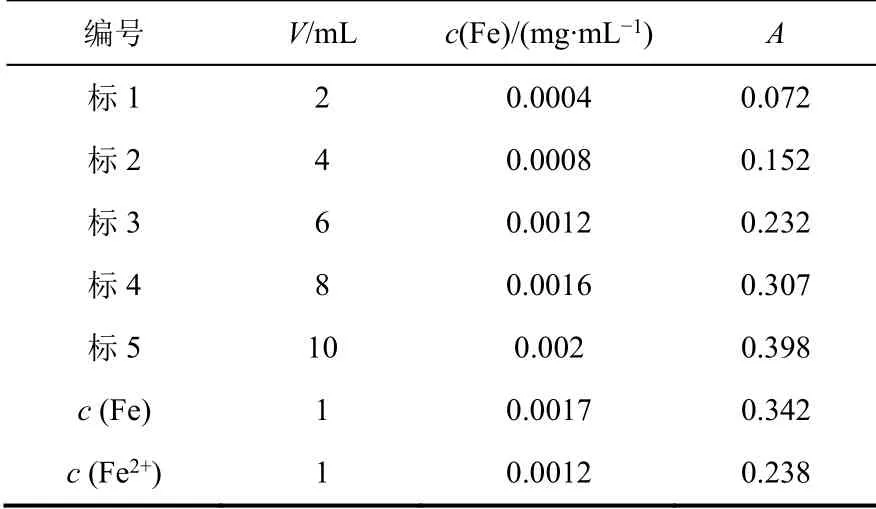
表3 标准曲线及样品数据
2.2 实验教学效果评价
通过紫外-可见分光光度计测定吸收曲线,原有实验通常为确定其最大吸收波长λmax。在本次教学改革中,学生计算不同波长处邻二氮菲-Fe2+络合物的摩尔吸光系数,使学生进一步掌握摩尔吸光系数随吸收波长的变化趋势,明确在邻二氮菲测铁实验中,最大吸收波长处摩尔吸光系数最大的原理。在本次教学改革中,学生对比Fe3+-邻二氮菲、邻二氮菲-Fe2+配合物的吸光度,加深其对实验原理的理解;并通过测定总铁、Fe2+,使学生进一步掌握邻二氮菲测铁原理,并熟悉本原理在实践过程中的具体应用,达到对知识的融会贯通。
在本次教学改革中,也尝试不同的教学方法。学生通过预习掌握Excel数据处理和作图方法,教师讲授基本原理后,学生进行实验。实验结束后,教师引导学生分析所得数据,通过数据分析得出的规律,加深学生吸收光谱测定的实验目的;对比坐标纸作图和Excel作图两种方法、722分光光度计和普析通用T6紫外-可见分光光度计,让学生了解科技进步对仪器分析的影响。
3 结语
本次教学改革实验项目,在原有实验的基础上,教师根据学生的反馈和疑问,对实验内容进行改进,实践效果良好。在学生进行实验的过程中,引导学生分工合作,在提升学生实验技能的同时,提高学生团队合作能力。未来教学改革中,教师实验教学过程中仍应以学生为主体,关注学生教学反馈,针对学生提出的问题或存在的疑惑,引导学生积极参与实验教学过程,同时鼓励学生思考、探索和提出自己的见解,真正实现自主学习。
不足之处在于,本次实验样品为模拟水样,无样品前处理过程。未来教学改进还需更多引入实际样品中铁的测定,让学生学习样品前处理的相关技术和方法;也可开展开放实验,鼓励学生“学以致用”,从日常食物、饮料中铁的测定着手,查阅文献、设计实验步骤,从而提高学生解决实际问题的综合能力。
