重症肌无力生物信息学靶点筛选及验证
2022-07-30钟斯然张帆夏星李宝铜彭诗钢温玉琴丘芬
钟斯然 张帆 夏星 李宝铜 彭诗钢 温玉琴 丘芬
(广西中医药大学 1药学院,广西 南宁 530299;2中药药理重点实验室)
重症肌无力(MG)主要指的是由乙酰胆碱受体抗体介导的自身免疫疾病。其发病原理乙酰胆碱能运动神经元与肌肉的突触产生病变〔1,2〕。临床表现是波动性四肢骨骼肌疲劳〔3〕,并可累及咽喉肌或眼外肌,表现为眼睑下垂、视力模糊、表情淡漠、抬头饮水困难、耸肩无力、上楼梯、下蹲及抬臂困难等,据估计,MG患者75%以上有胸腺增生,严重影响患者的正常生活和身体健康。由于MG的发病原因不明,目前尚无特效疗法。
生物信息学是以计算机为工具,对生命科学研究中的生物信息进行存储、检索和分析的科学。这门新学科开辟了疾病研究的新途径。本文通过探讨MG相关的mRNAs表达的改变,为MG的诊断和治疗提供理论依据。
1 材料与方法
1.1数据收集预处理和差异表达分析 胸腺基因芯片原始数据收集于GEO(Gene Expression Omnibus)数据库(https://www.ncbi.nlm.nih.gov/gds),芯片数据的编号为GSE11967,芯片平台为GPL5175 〔HuEx-1_0-st〕 Affymetrix Human Exon 1.0 ST Array 〔transcript (gene) version〕。芯片的样本来源于MG患者胸腺和正常胸腺,分为对照组和MG组各2例。下载的原始数据通过R语言Affy程序包〔4〕进行数据预处理,包括扣除背景,标准化数据,标注探针,构建表达矩阵;通过主成分分析(PCA)和t-分布域嵌入算法(t-sne)的质控分析,探讨各组间和组内的异质性和同质性,并进行质控和分析。最后,使用limma〔5〕程序包分析正常样本和MG样本mRNA表达差异。同时绘制火山图和热图,过滤探针注释信息不全,极低表达和重复的基因,其中差异mRNA的筛选条件为FDR<0.01,LogFC >|2|。
1.2基因功能与信号通路的富集分析 基因本体数据库(Gene ontology,GO,http://geneontology.org/)〔6〕是一个在生物信息学领域中广泛使用的基因注释数据库,提供一系列的语义用来描述基因、基因产物的特性。京都基因与基因组百科全书(KEGG,https://www.kegg.jp/)〔7〕是大型分子数据集产成的基因组测序等高通量实验技术应用的数据库资源。
使用R语言clusterProfiler程序包〔8~10〕和相关的捆绑数据软件包,选取差异表达基因进行GO和KEGG富集分析。通过绘制基因富集功能网络图探究:哪些富集的功能或通路与哪些基因相关;哪些基因同时参与哪个生物学功能或途径;富集的功能或途径之间有什么关系。
1.3蛋白质相互作用(PPI)网络分析 STRING数据库〔11〕(https://string-db.org/),选取差异表达基因,获取蛋白质-蛋白质相互作用(PPI)信息,对胸腺差异表达基因构建蛋白质相互作用网络。通过Cytoscape软件及插件MCEODE、cytohubba,对网络拓扑分析,筛选网络中核心基因。
1.4核心基因的验证
1.4.1动物 C57BL/6小鼠,SPF级,雌性,体重18~22 g,购自湖南斯莱克景达实验动物有限公司,生产许可证号为SCXK(湘)2016-0002,实验动物质量合格证号:43004700046105。
1.4.2试剂 人工合成鼠源性乙酰胆碱α亚基97-116 肽(Rα97-116)购自吉尔生化(上海)有限公司,批号P180509-DG148487;不完全弗氏佐剂(IFA)、完全弗氏佐剂(CFA)购自Sigma,批号分别为SLBV6904、SLBW1457;磷酸盐缓冲液(PBS)购自Biological Industries,批号0012918;小鼠抗乙酰胆碱脂酶受体抗体(AchR-Ab)试剂盒购自江苏晶美生物科技有限公司,批号2018-9。
1.4.3仪器 UW620H型 电子天平(感量:0.01 g),日本Shimadzu公司;TGL-20M型低温高速离心机,湖南湘仪实验室仪器开发有限公司;HVA-110型高压灭菌器,日本Hirayama公司;SW-CJ-1FD型超净工作台,苏州安泰空气技术有限公司;Infinite200pro型酶标仪,Tecan奥地利有限公司。
1.4.4造模 取87只C57BL/6小鼠,12只作为空白组,其余小鼠复制MG模型作为模型组〔12〕。首次免疫于小鼠双肩及双后足底部共4个部位皮下注射50 μl/部位,正常组注射生理盐水,其余小鼠注射Rα97-116/CFA混合液(Rα97-116:PBS液:CFA=1 mg∶2 ml∶2 ml);首次免疫后第30天和第50天,采用同一配比的Rα97-116/IFA混合液于上述4个部位注射50 μl/酶联免疫吸附试验(ELISA)测定部位强化免疫。末次免疫后20 d,每只小鼠眼眶后静脉丛取血0.3 ml,3 000 r/min分离血清,测定血清AChR-Ab水平,(样品血清OD值/空白组血清OD值>2.1视为AChR-Ab阳性)。
1.4.5模型筛选
1.4.5.1行为学观察 采用lennon分级〔13〕,分为4级:0级,无肌无力表现;1级,撕咬无力,小鼠运动减少;2级,明显无力,低头垂尾,协调性下降;3级,肌无力表现严重濒临死亡;4级,死亡。症状两者之间为0.5、1.5、2.5、3.5分,评分≥1分为造模成功。
1.4.5.2新斯的明实验 每只小鼠注射适量新斯的明和阿托品〔14〕,如果症状改善维持一段时间,评分降低证明该小鼠新斯的明实验阳性。
1.4.5.3RNS电刺激实验 BL420系统观察腓肠肌肌电波幅有无衰减〔15〕,第4个波幅比第1个衰减率>10%为阳性,>20%为强阳性。同时满足AChR-Ab阳性,即P/N值>2.1,P/N=(供试样品OD值-空白孔OD值)/(阴性对照孔OD值-空白孔OD值)、肌力症状学评分≥1分、新斯的明实验阳性、RNS电刺激第4个波幅比第1个衰减率>10%,则表明造模成功。
1.4.6实时荧光定量-聚合酶链反应(RT-qPCR)检测核心基因表达 末次药后,禁食不禁水12~16 h,眼眶后静脉丛取血,3 000 r/min分离血清,取胸腺-80℃冻存,RT-qPCR检测CCL19、BGN基因表达。
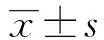
2 结 果
2.1样本数据的降维分析 使用PCA和t-sne对GSE11967表达矩阵在样本的维度进行降维及可视化分析,图1中一个点代表一个样本,该样本组内差异很小,组间差异较大,两种样本的基因表达异质性较大。表明芯片数据质量较好,可以用于下游分析。
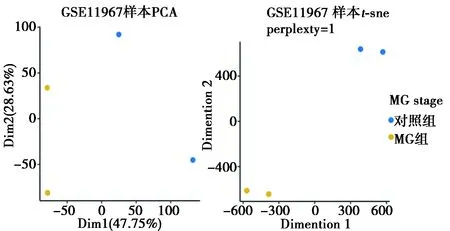
图1 GSE11967样本的PCA降维分析、t-sne降维分析
2.2MG差异表达mRNA筛选和富集分析 对芯片数据用limma进行差异分析后,筛选出85个差异表达基因,利用R绘制火山图和热图后发现33个上调,52个下调。见图2和图3。
2.3GO和KEGG富集分析 图4可以看出BGN、CTGF等基因富集于细胞外基质组织、分支上皮的形态发生通路。图5可以看出CX3CR1、CXCLL11、CCL19基因与细胞因子-细胞因子受体相互用相关。CX3CR1、CXCL11、CCL19基因与病毒蛋白质和细胞活素-细胞活素受体相互作用相关。

图2 差异mRNA表达火山图
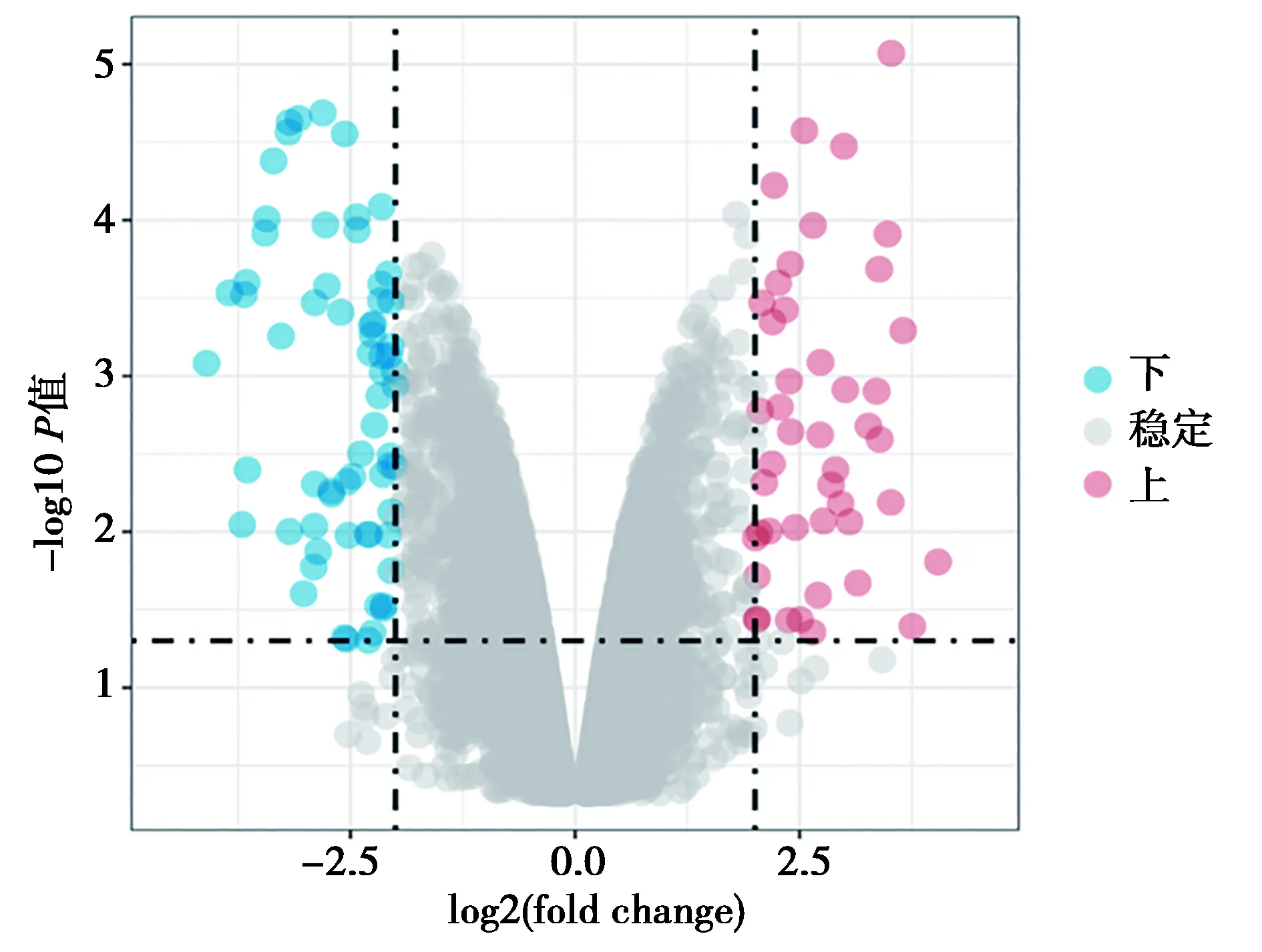
图3 差异mRNA表达热图

图4 GO富集分析及GO功能与富集基因的联系(网络连线的颜色代表GO分析)
2.4PPI网络分析 通过Cytoscape及其插件对PPI网络进行拓扑分析,首先对胸腺组织差异表达基因构建PPI网络,使用MCODE筛选核心的子网络,其中发现CXCL11、CCL19、CHRM4、CX3CR1、HCAR1构成子网络。见图6。使用CytoHubba进行网络拓扑分析,MCC前十个基因包括BGN、CCL19、CTGF、COL1A2、 FBLN1、CDH11、CXCL11、HCAR1、CHRM4、CX3CR1。
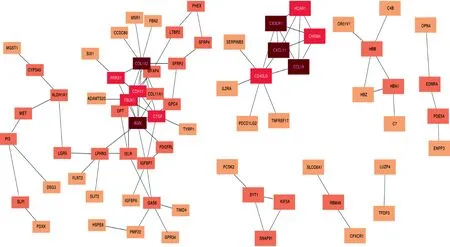
图6 差异表达基因构建PPI网络MCODE score(颜色由深到浅表明评分高到低)
2.5动物实验验证结果
2.5.1模型筛选 空白组lennon评分〔(2.1±0.55)分〕显著高于模型组〔(0.0±0.00)分,P<0.01〕;空白组Achr-Ab水平〔(123.49±23.74)pg/ml〕显著低于模型组〔(373.40±69.19)pg/ml,P<0.01〕;模型组新斯的明给药后小鼠症状评分〔(1.5±0.58)分〕显著低于给药前〔(2.1±0.58)分,P<0.01〕。肌电图显示模型组第4个波幅比第1个波幅下降率>10%,表示造模成功。见图7。
2.5.2BGN、CCL19在小鼠胸腺中表达 与空白组比较,模型组BGN表达水平显著上调,而CCL19表达水平显著下调(P<0.05)。见表1。

图7 两组肌电图
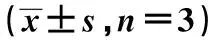
表1 RT-qPCR检测BGN、CCL19表达
3 讨 论
BGN是富含小分子亮氨酸的蛋白聚糖(SLRPs) 家族成员之一,由2条糖胺聚糖侧链和一个核心蛋白组成。其核心蛋白分子量约42 kD,含12个亮氨酸重复单位。BGN广泛分布在骨、软骨、肌腱、纤维组织等多种细胞外基质组织中,是细胞外基质的重要成分,现已被证明是参与炎症反应的关键分子。在急性和慢性炎症中,BGN均能促进白细胞介素(IL)-1β的分泌〔16〕。研究表明,随着炎症的增强,BGN高表达并伴随着严重的组织损伤。而且,无论是在病原体诱导〔17〕还是无菌条件下BGN的缺乏均能减少炎症反应〔18〕。
趋化因子是一组小分子量的蛋白质家族成员,可以调控白细胞在炎症部位募集,并且具有稳定淋巴细胞环境的功能,趋化因子CCL19可能在正常淋巴细胞循环和归巢中发挥作用。它在胸腺T细胞的运输,T细胞和B细胞向次级淋巴器官的迁移中也起着重要作用。
