迟发性运动障碍的临床诊治进展
2022-07-30王喜喜万新华
王喜喜,万新华
中国医学科学院北京协和医院神经科,北京 100730
迟发性运动障碍(tardive dyskinesia,TD)是与长期服用多巴胺受体阻滞剂(dopamine receptor blocking agent,DRBA)相关的一种异常不自主运动,可累及面颈部,引起伸舌、咀嚼、噘嘴、歪颌或转颈,也可累及四肢和躯干,表现为舞蹈样动作。67%~89%的TD患者不自主运动状态永久存在[1],具有较高的致残率。在应用抗精神病药物(antipsychotic drug,APD)的患者中,估测TD的平均患病率为25.3%[2]。目前TD的发病机制尚不明确,主要有多巴胺受体超敏学说、氧化应激学说和突触可塑性失调学说。与TD相关的危险因素包括APD的种类、用药剂量和时间以及患者的年龄、性别、遗传因素等。临床上治疗TD较为困难,预防至关重要。本文就TD的临床诊治进展进行综述,以进一步加深医务人员对该疾病的认识。
1 流行病学及危险因素
关于TD的报道可追溯至20世纪50年代,即APD应用于临床后不久,Schonecker首次描述了这种现象[3]。1964年,Faurbye首次使用“tardive dyskinesia”这一术语,用于强调症状出现与APD应用的时间延迟性。在长期服用APD的精神病患者中,TD的患病率为20%~50%[4]。一项针对908例长期服用APD的精神病患者进行的前瞻性研究发现,TD的累积发病率在第1年为5%,第5年为27%,第10年为43%,20年后为52%,表明TD发病率随APD使用时间的延长而增加[5]。Carbon等[2]对41项关于典型和非典型APD的研究进行荟萃分析发现,所有精神病患者的TD平均患病率为25.3%,与高患病率相关的因素包括APD种类(典型APD的患病率为30%,非典型APD的患病率为20.7%)、精神病持续时间、急性锥体外系不良反应史。TD最主要的危险因素是年龄,在服用APD的老年患者中,1年后TD的发病率约为26%,3年后约为60%,显著高于年轻患者[6]。除此之外,既往研究证实的TD危险因素还包括头外伤史、认知功能减退史、精神疾病史、精神障碍家族史、非洲裔、女性、吸烟、饮酒和药物滥用、糖尿病、高血压、肥胖症、人类免疫缺陷病毒阳性等[7-9]。2021年,国内一项纳入901例精神分裂症患者的研究显示,中国人群TD发病的危险因素包括男性、高龄、低文化程度、吸烟史、高住院频率和长病程[10]。
2 诱发药物及发病机制
2.1 诱发药物
除APD外,止吐药、抗帕金森病药物、抗惊厥药均可引起TD。APD主要用于精神分裂症或有精神症状的患者,主要包括典型和非典型两大类。研究表明,服用典型APD的精神病患者TD的患病率为32.4%,服用非典型APD的精神病患者TD的患病率为13.1%[11]。这种差异可能与非典型APD与多巴胺D2受体的亲和力较低、结合时间短,以及5-HT2A/2C受体的相关拮抗作用相关[12-13]。甲氧氯普胺是一种多巴胺拮抗剂,临床应用于严重恶心、呕吐的患者。研究发现CYP2D6基因突变的患者其甲氧氯普胺的代谢能力降低,更易出现TD症状[14]。卡马西平、拉莫三嗪、丙戊酸钠、苯妥英钠等抗惊厥药均与TD相关,具体机制可能与增加乙酰胆碱酯酶活性和影响多巴胺通路有关[15]。左旋多巴诱导的运动障碍可发生在帕金森病患者中,尤其是早发性帕金森病。除此之外,抗组胺药、抗胆碱能药物、抗抑郁药、抗焦虑药、锂剂、兴奋剂等药物均与TD相关[16-17]。
2.2 发病机制
TD的具体发病机制尚不明确,目前主要存在三种假说:多巴胺受体超敏学说、氧化应激学说和突触可塑性失调学说。长期阻断多巴胺受体可能导致D2受体逐渐上调,并伴有突触后多巴胺受体超敏。该理论可解释TD的某些特征,如随着DRBA剂量的增加,症状暂时减轻,突然停药症状加重[18],但不能解释TD的慢性病程(多巴胺受体超敏性的发展在几天至几周内发生,TD在数月至数年后发展)。DRBA使用过程中产生的氧化应激反应,可能导致神经元损伤和退行性变。在接受DRBA治疗的患者中,多巴胺神经元每10年损失15%,明显高于自然状态下的5%,提示DRBA可加速多巴胺神经元损失[19-20]。氧化应激可能需积累数月至数年才可以观察到临床变化,这与TD发展的进程一致。突触可塑性是指突触通过某些机制调节神经递质传递的能力,由胆碱能、γ-氨基丁酸(gamma-aminobutyric acid,GABA)能和多巴胺能系统共同调节,被认为是许多运动障碍的基础,如亨廷顿病、抽动障碍和左旋多巴诱导的运动障碍[18]。长期使用DRBA可导致突触可塑性失调,产生异常不自主运动。总体来说,多巴胺受体超敏反应仍然是目前最为广泛接受的发病机制假说。
3 遗传学研究
部分患者服用APD数十年后未产生TD,而有的患者仅数月即可产生TD症状,说明遗传因素在TD的发生中发挥一定作用。2018年,Zai等[21]的一项系统性回顾研究将TD相关基因大致分为以下六类:(1)药物代谢酶相关基因:CYP1A2、CYP2D6;(2)多巴胺通路相关基因:DRD2、DRD3、COMT、VMAT2;(3)GABA通路相关基因:SLC6A1、GABRB2、GABRG3;(4)5-羟色胺通路相关基因:HTR2A、HTR2C;(5)氧化应激相关基因:MnSOD、GSTM1、NQO、NOS3;(6)突触可塑性相关基因:GRIN2B、BDN。其中,研究热点为编码细胞色素氧化酶和多巴胺受体的相关基因。
CYP2D6基因(ID:1565;5.35 kb at22q13.2)编码细胞色素氧化酶 P450 2D6,参与APD及其他TD高风险药物的代谢,有100多个等位基因变异。Koola等[22]研究发现,TD发生风险与CYP2D6基因的代谢能力相关。据文献报道,与TD相关的CYP2D6基因突变位点包括rs16947、rs1135840、rs5030656、rs1065852、rs28371706、rs28371725、rs35742686、rs3892097和rs5030655[23](表1)。其他细胞色素氧化酶,如CYP1A2、CYP3A5,也参与某些APD的代谢,尚未作为TD的危险因素进行广泛研究。2021年,Vaiman等[24]对编码多巴胺受体基因的相关研究进行了归纳整理,目前与TD相关的基因包括DRD1 rs4532 (A/G)、DRD2 rs6277(C/T)、rs6275(C/T)、rs1800497(C/T)TaqIA多态性、rs1079597 (A/G) TaqIB多态性、rs1799732(141CIns/Del)、rs1045280 (C/T)、DRD3 rs905568(C/G)(表2)。VMAT2基因(ID:6571;38.4 kb at10q25.3)编码VMAT2。Tsai等[25]在精神分裂症患者中发现了rs2015586、rs2015586和rs36224A与TD关联,其中rs36224 A被认为对TD具有保护作用[26]。HTR2A基因(ID:3356;65.5 kb at13q14.2)编码5-羟色胺2A受体,通过影响钙电流的变化调节多巴胺释放。研究发现,rs6313(T102C)、rs6311(A1438G)和rs6314(H452Y)可能与TD相关[21]。HTR2C基因(326 kb atXq23)编码5-羟色胺2C受体,以色列首次报道了女性TD患者的Ser23Cys基因多态性[27]。SOD2基因(93.5 kb at6q25.3)编码锰超氧化物歧化酶,作为线粒体中的一种抗氧化酶,在神经发育中发挥重要作用。HSPG2基因(115 kb at1p36.12)编码硫酸乙酰肝素蛋白多糖2,参与组成血脑屏障。Syu等[28]发现了rs2445142与TD的关联,以色列和欧洲的两项研究验证了这一发现[29],该结果在2018年的一项荟萃分析中得到进一步证实[30]。
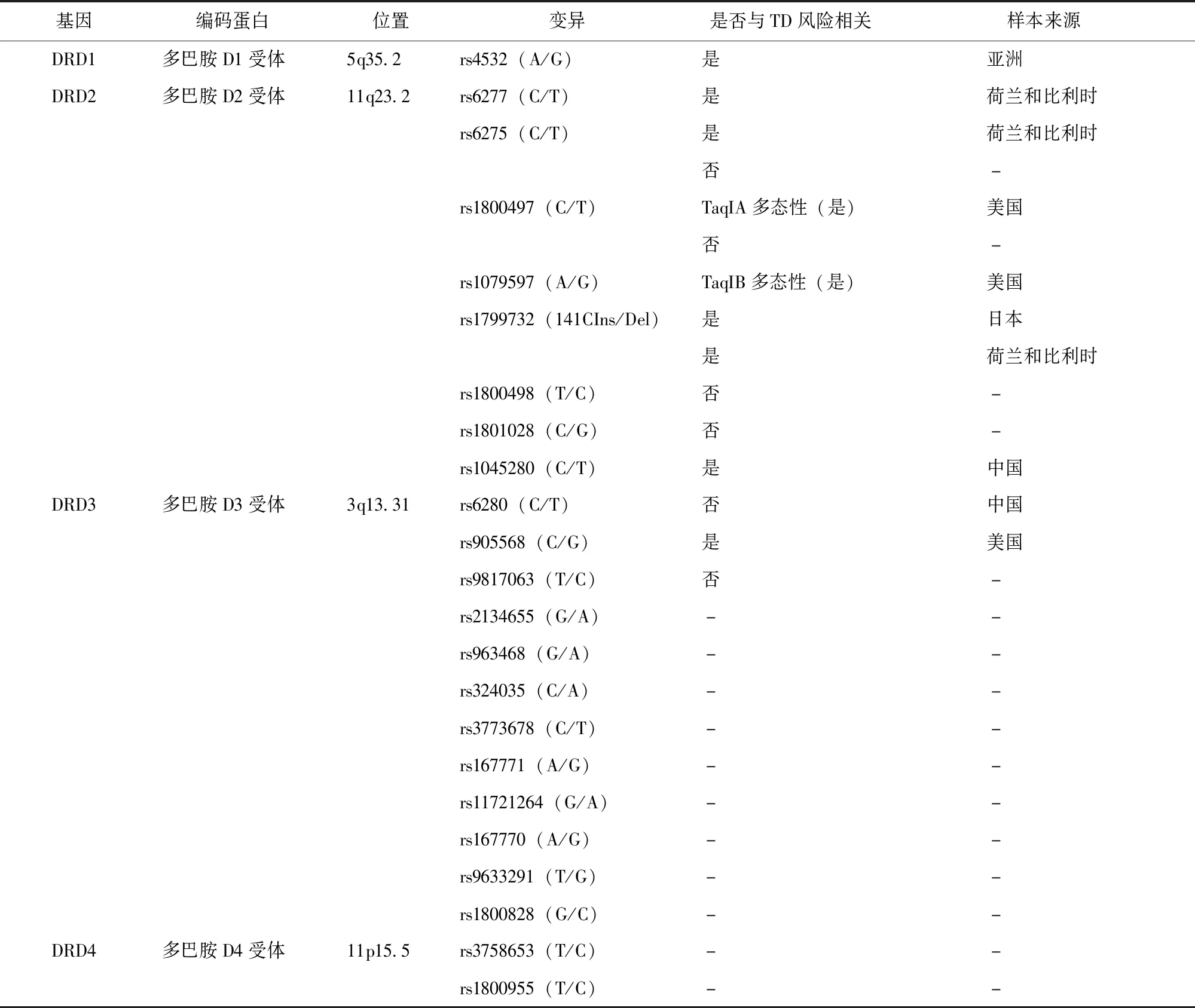
表2 编码多巴胺受体的候选基因作为TD风险预测因子的相关研究[24]
遗传学研究与临床研究相结合,有助于识别TD的遗传危险因素,提示可能的病理生理机制。目前涉及表观遗传学、基因表达和全基因组测序的相关研究比较匮乏,现有5项关于TD患者的全基因组关联分析(genome-wide association study,GWAS)研究[24],详见表3。较早的GWAS研究提示了SLC6A11、GABRB2、GABRG3、ZNF202、HSPG2与TD的相关性[31-33]。2021年,Levchenko等[34]研究发现,FOXP1基因与TD具有相关性,特别是口面部TD。既往研究表明,FOXP1涉及中脑多巴胺神经元的分化和纹状体中等棘状神经元的分化[35-36],不但与精神障碍相关[37-38],还与语言障碍、智力残疾和行走困难等表型相关[39]。Lim等[40]通过对东亚、欧洲和非洲裔美国人进行了迄今为止最大规模的TD相关GWAS研究,确定了肿瘤坏死因子受体超家族成员1B(TNFRSF1B)、红细胞膜蛋白区带41L2(EPB41L2)和钙结合螺旋结构域1(CALCOCO1)的TD风险。未来需更多大样本研究进一步验证这些发现,同时需投入更多研究阐明各种TD易感性标志物之间是否具有协同作用。

表3 关于TD患者的全基因组关联分析研究[24]
4 评估与诊断
由于对TD缺乏足够的认识,临床上常将TD误诊为精神疾病,为此开具的APD可能使患者病情进一步恶化,TD的明确诊断是防止此类问题发生的必要条件。美国国立精神卫生研究所(National Institute of Mental Health,NIMH)研发的异常不自主运动量表(abnormal involuntary movement scale,AIMS),可对TD患者进行简要评估和诊断[41]。
临床上常用的TD诊断标准为Schooler-Kane标准[42]:(1)至少有3个月的APD服用史;(2)经AIMS评估,表现为至少1个部位的中度不自主运动(AIM≥3分),或至少2个部位的轻度不自主运动(AIMS≥2分);(3)排除其他可能导致不自主运动的疾病。推荐的评估频率:服用典型APD的患者每6个月1次,服用非典型APD的患者每12个月1次。若患者存在有TD其他危险因素,则推荐监测更为频繁:服用典型APD的患者每3个月1次,服用非典型APD的患者每6个月1次[43]。
5 预防与治疗
TD治疗比较困难,预防至关重要[44]。首先,临床医生应了解TD高风险药物,充分评估长期用药的必要性,在开具此类药物之前,与患者及其家属讨论风险与获益,应用低TD风险药物的最低有效剂量。其次,在治疗前和治疗过程中,进行AIMS评估,以便早期发现异常不自主运动并及时处理[45]。对于无精神障碍且停用APD后不会使其症状恶化的患者,可在数周或数月内尝试缓慢、逐步减少药物剂量。然而,对于大多数精神分裂症患者,停止APD后疾病复发风险增加,其不是最佳选择。从典型APD转换为低D2受体亲和力的非典型APD(如氯氮平或喹硫平)可有效改善症状,但可能需数月或数年时间。
VMAT2抑制剂通过阻止多巴胺被包装进突触小泡,减少纹状体中突触前多巴胺输出,从而减少不自主运动。丁苯那嗪(tetrabenazine,TBZ)作为早期的VMAT2抑制剂,在20世纪50年代被批准用于治疗亨廷顿病。2017年,美国食品药品监督管理局(Food and Drug Administration,FDA)先后批准氘丁苯那嗪(deutetrabenazine,DBZ)、缬苯那嗪(valbenazine,VBZ)用于治疗TD。目前,DBZ、VBZ被视为TD的一线治疗药物(A级证据)[46-47]。2020年,美国精神病学协会(American Psychiatric Association,APA)建议与APD治疗相关的中重度或致残性TD患者使用VMAT2抑制剂治疗,结合患者意愿和社会功能损害情况,轻度TD患者也可考虑接受VMAT2抑制剂治疗[48]。DBZ、VBZ在给药频率和剂量及不良反应方面存在轻微差异[49-50](表4)。尽管DBZ和VBZ可延长心电图QT间期,但在推荐剂量的预期浓度下并不显著,先天性长QT间期综合征或与QT间期延长相关的心律失常患者应尽量避免使用。一项为期72周的临床研究表明,VBZ具有良好的耐受性,在接受治疗超过1年的成人患者中,TD持续改善[51]。值得一提的是,目前针对此两种药物的研究分别来源于各自的安慰剂对照研究,暂时无针对DBZ与VBZ的“头对头”临床试验,且缺乏此两种药物的长期双盲安慰剂对照数据,建议后续的临床试验开展此方向相关研究。此外,目前所有研究均针对TD患者开展,未来的研究应聚焦于长期服用APD的精神病患者早期引入VMAT2抑制剂,以延迟TD的发病或进展[52]。

表4 三种VMAT2抑制剂比较[49-50]
除VMAT2抑制剂外,还推荐其他TD治疗药物,主要包括氯硝西泮、金刚烷胺和银杏叶提取物。一项随机、双盲、安慰剂对照交叉试验中,使用氯硝西泮的患者TD症状评分降低39%;不良反应方面,19例患者中,6例出现镇静,3例出现共济失调;在5名长期随访的受试者中,5~8个月均显示出耐受性[53]。两项随机交叉试验研究显示,金刚烷胺可显著改善患者的TD症状,且均无不良事件报告[54-55]。国内一项随机双盲安慰剂对照研究共纳入157例TD患者,应用银杏叶提取物组51% 的患者TD症状改善>30%,且未出现不良反应,而安慰剂组仅为5%[56]。同样,维生素E和维生素B6作为抗氧化剂,在改善TD症状方面也显示出很好的疗效,但均需大剂量应用。总体来说,由于支持证据有限且存在相关药物不良反应,不常规推荐氯硝西泮、金刚烷胺、银杏叶提取物、维生素B6、维生素E用于治疗TD,对于VMAT2耐受或无效的患者,可考虑短期使用(B级、C级证据)[47]。
肉毒毒素局部注射对局灶型肌张力障碍具有较好的治疗效果,其选择性地作用于胆碱能神经末梢,抑制乙酰胆碱释放,从而引起注射部位肌肉松弛,改善局部症状。苍白球内深部脑刺激(deep brain stimulation in globus pallidus,GPi-DBS)治疗TD的证据以病例报道为主,目前两项随机试验证实了GPi-DBS的治疗效果,患者症状改善范围从41.5%~71%不等[57-58]。对于症状严重的难治性TD,可考虑应用GPi-DBS(C级证据)[47](表5)。

表5 TD治疗方案推荐[47,59-60]
6 小结与展望
TD是临床常见的致残性运动障碍,长期服用DRBA诱发TD的机制可能与突触后多巴胺受体超敏相关。遗传因素在TD的发生中发挥一定作用,研究证实多种基因与TD的发生风险相关,其中CYP2D6基因和DRD系列基因研究最热。未来需对其他TD相关基因投入更多研究,如HTR2A、HTR2C、VMAT2、MnSOD、HSPG2,同时需开展更多TD患者的全基因组测序和基因表达研究,阐明不同易感基因的协同作用。TD管理和治疗难度大,预防至关重要,两种新型VAMT2抑制剂——DBZ和VBZ是一线治疗药物,对于VMAT2抑制剂禁忌或治疗效果不佳者可考虑选择二线治疗药物,主要包括氯硝西泮、金刚烷胺和银杏叶提取物。除此之外,肉毒毒素局部注射和GPi-DBS也有助于改善TD患者症状。未来研究可向长期服用APD的精神病患者中早期引入VMAT2抑制剂,关注其疗效及进展。
作者贡献:王喜喜负责查阅文献、撰写论文;万新华负责修订、审校论文。
利益冲突:所有作者均声明不存在利益冲突
