脊柱骨折患者术后腹胀发生的危险因素分析及预警模型构建
2022-07-30黎淑琴简丽峰刘碧玉黄嘉钘李创李春雨崔基浩
黎淑琴, 简丽峰, 刘碧玉, 黄嘉钘, 李创, 李春雨, 崔基浩
受麻醉药物、手术创伤以及长时间卧床制动等因素影响,脊柱骨折患者术后易引起神经功能障碍,造成胃肠蠕动功能减弱,出现腹胀、便秘等相关并发症。据文献报道其发生率高达40%~88%,不但不利于术后康复,还严重影响着患者的生活质量水平,因此尽早识别诱发腹胀的因素对于临床防治工作具有重要价值[1-2]。目前关于脊柱骨折术后发生腹胀的研究大多集中在发病原因、影响因素和治疗方法等方面,缺乏可量化预测相关风险的模型。列线图是一种由回归模型演化而来的可视化平面模型,由一簇互不相交的线段将多因素回归分析结果展示在同一平面上,凭借着可视可读、简捷实用的优势,近年来被广泛应用于预测临床结局事件[3]。基于此,本研究拟在单因素和Logistic回归分析的基础上建立脊柱骨折术后发生腹胀的风险预测列线图模型,旨在为临床针对脊柱骨折术后发生腹胀的防治工作提供一定的参考和依据。
1 资料与方法
1.1 研究对象
回顾性选取2018年1月至2021年8月我院骨科收治的318例脊柱骨折患者作为研究对象,以发生腹胀为随访结局事件,末次随访时间为2021年9月,根据脊柱骨折术后患者是否发生腹胀分为发生组和未发生组。本研究已通过医院伦理委员会批准。纳入标准:已行后入路脊柱手术;年龄>18岁;全身麻醉或硬膜外麻醉;临床资料完整者;患者均知情同意。排除标准:妊娠或哺育期女性;智力低下或患有精神疾病者;合并神经功能损伤者;术前存在胃肠道器质性疾病,如胃肠梗阻、肠系膜血管疾病、肠管畸形和胃肠道肿瘤等;美国麻醉医师协会(ASA)分级>Ⅱ级;合并严重心脑肾肺肝等功能损害或其他恶性肿瘤疾病者;随访过程中失访者。样本量验证采用样本量计算公式n=[(Ζα/2)2×P×(1-P)]/(δ2×deff)[4],其中n为样本量,Ζα/2为1.96,P为阳性率估计值,P×(1-P)最大为0.25,δ为最大允许误差,deff为设计效应值。在90%置信度下,绝对误差为10%,取总比例为50%,则抽样估算样本量应为192例,考虑10%的脱落率,则应纳入样本量为212例,本研究最终纳入318例脊柱骨折术后患者,纳入样本量充足。
1.2 研究方法
1.2.1 资料收集 参考既往文献关于诱发腹胀的危险因素[5-7],并结合我院骨科专家意见收集资料,其中包含:①一般资料:性别、年龄、身体质量指数(BMI)、是否抽烟、是否喝酒和每天下床活动次数;②基础疾病:糖尿病、高血压、高血脂、心血管疾病(冠心病、心肌梗死、心绞痛、心力衰竭和短暂脑缺血病者等);③实验室检查:血常规、血清白蛋白、血清钠、血清钾;④手术情况:麻醉方式、ASA分级、术前禁食情况、术后进食时间、术后镇痛时间和术后卧床时间;⑤药物:抗菌药物、肠道菌群药、胃肠动力药。
1.2.2 标本采集和检测 在空腹状态下分别抽取所有研究对象肘部静脉血5 ml置入抗凝负压管,等待检验;应用离心机行3 000 r/min离心处理15 min后,取血浆,保存于低温箱中。应用德国西门子自动生化仪(SIEMENS Advia 2400)检测血常规等指标,血清白蛋白、血清钠、血清钾分别将35 g/L、135 mmol/L、3.5 mmol/L设为截点值。
1.3 相关定义
①腹胀诊断标准:肠鸣音消失,腹部呈渐进性隆起,听诊有气过水声,叩诊呈鼓音。主要表现为腹部隐痛、膨胀、不适等,常伴有嗳气、打嗝、排气过多等。②BMI:超重为BMI ≥24 kg/m2,肥胖为BMI≥28 kg/m2;③糖尿病:检测空腹血糖(FPG)≥7.0 mmol/L;或糖耐量试验(OGTT)中服糖后2 h血糖(2hPG)≥11.1 mmol/L;或随机血糖≥11.1 mmol/L;④高血压:收缩压≥140 mmHg,舒张压≥90 mmHg。⑤高血脂:总胆固醇(TC)≥5.2 mmol/L;三酰甘油(TG)≥ 1.7 mmol/L;高密度脂蛋白胆固醇(HDL-C)<1.0 mmol/L;低密度脂蛋白胆固醇(LDL-C)≥ 3.4 mmol/L。当在空腹状态下检查静脉血浆时符合以上任意一项指标或以上均可诊断为血脂异常;⑥吸烟:吸烟≥1支/d,且持续 >6个月为吸烟;⑦饮酒:饮酒≥1次/周,且持续 >1个月为饮酒。
1.4 统计学方法
采用SPSS 22.0软件进行数据分析。计数资料采用例(%)表示,组间比较采用χ2检验,采用Logistic回归分析筛选影响因素,以P<0.05为差异有统计学意义。采用R(R3.5.3)软件包和rms程序包制作Nomogram模型,采用rms程序包计算一致性指数(C-index),并绘制校正曲线和ROC曲线评估模型的预测效能;以P<0.05为差异有统计学意义。
2 结果
2.1 318例脊柱骨折患者术后腹胀发生情况
经相关检测确认患者术后发生腹胀有64例,未发生腹胀254例,腹胀发生率为20.13%。
2.2 两组患者参数资料比较
不同性别、年龄、BMI、合并糖尿病、合并高血压、合并心血管疾病、是否饮酒、是否抽烟、ASA分级、术前禁食情况、术后进食时间、术后镇痛时间以及是否低钠等资料均差异无统计学意义(P>0.05);而是否应用抗菌药物、是否应用肠道菌群药、是否应用胃肠动力药、麻醉方式、是否低蛋白、是否低钾、术后卧床时间以及每天下床活动次数等资料间差异有统计学意义(P<0.05),见表1。
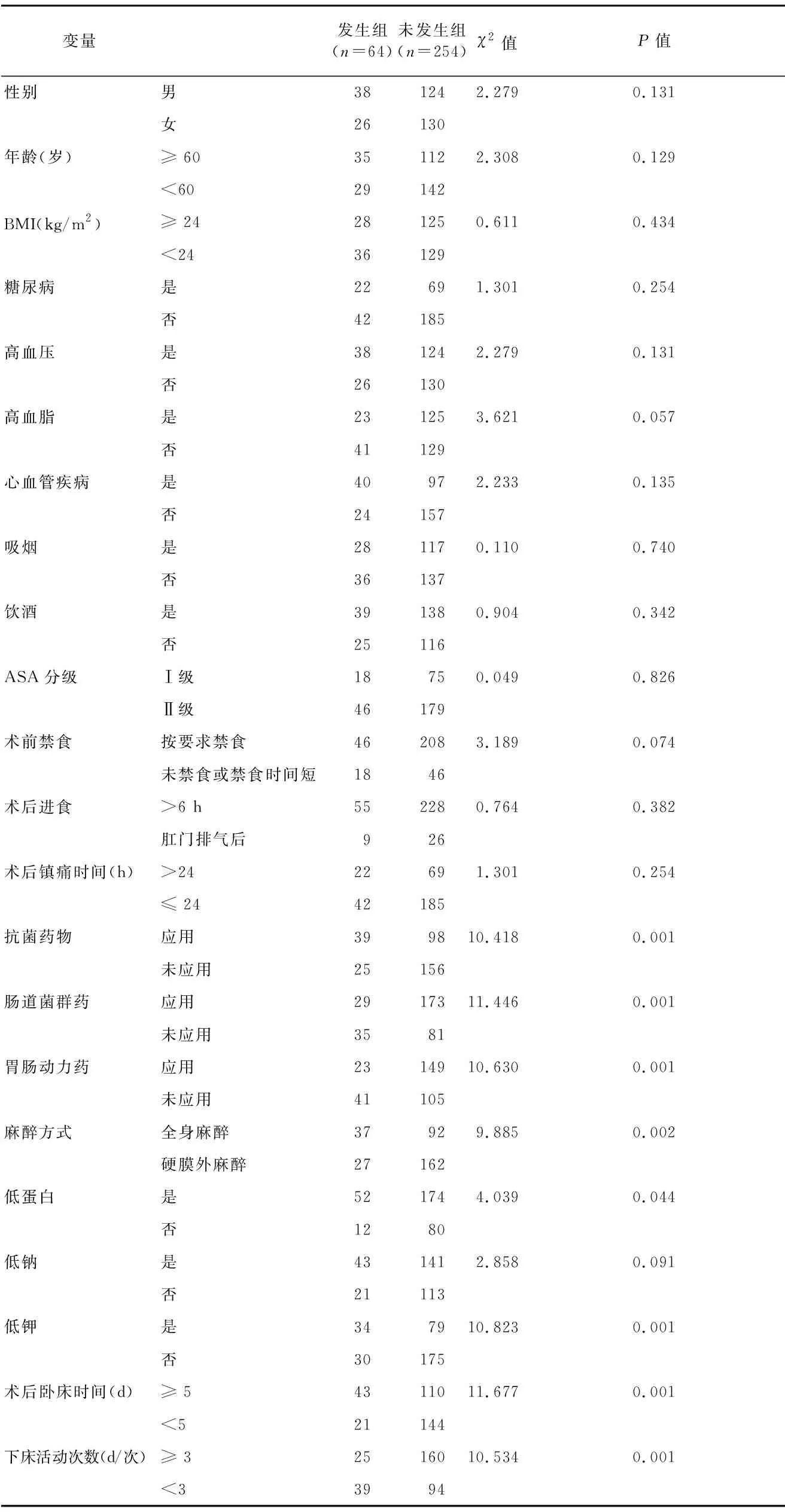
表1 两组患者参数资料单因素分析(例)
2.3 脊柱骨折术后发生腹胀影响因素的Logistic回归分析结果
以单因素分析筛选(P<0.05)的因素(是否应用抗菌药物、是否应用肠道菌群药、是否应用胃肠动力药、麻醉方式、是否低蛋白、是否低钾、术后卧床时间、每天下床活动次数)为自变量,以脊柱骨折术后是否发生腹胀为因变量(赋值:发生=1,未发生=0),进行Logistic回归分析,结果显示,应用抗菌药物、未应用肠道菌群药、未应用胃肠动力药、全身麻醉、低钾、术后卧床时间≥5 d、每天下床活动次数<3次是脊柱骨折术后发生腹胀的独立危险因素(P<0.05),见表2,表3。

表2 脊柱骨折术后发生腹胀影响因素的Logistic回归分析的变量赋值表

表3 脊柱骨折术后发生腹胀影响因素的Logistic回归分析
2.4 脊柱骨折术后发生腹胀的风险Nomogram预警模型的建立与验证
2.4.1 脊柱骨折术后发生腹胀的风险Nomogram预警模型的建立 基于7项独立危险因素建立脊柱骨折术后发生腹胀的风险Nomogram预警模型,见图1。各条评分线左侧端点均对应为0分,从抗菌药物指标起依次为83分、86分、95分、73分、75分、100分、86分,总分598分。使用方法:例如,1例脊柱骨折术后患者若应用抗菌药物,同时未应用胃肠动力药物,术后卧床时间≥5 d,那么发生腹胀风险是83+95+100=278分,与之对应的发生腹胀风险约在18%左右。
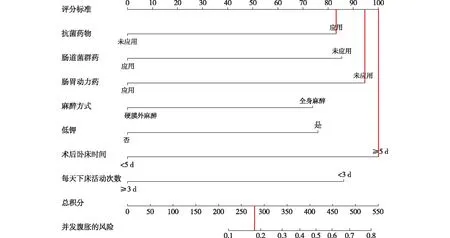
图1 预测脊柱骨折术后发生腹胀的风险Nomogram预警模型
2.4.2 脊柱骨折术后发生腹胀风险Nomogram预警模型的拟合优度检验 模型验证结果显示:C-index为0.808(95%CI:0.778~0.838),表明本列线图辨别度较好;预测值与实测值基本一致,校正曲线趋近于理想曲线,见图2,表明预测准确性良好;内部验证脊柱骨折术后患者发生腹胀风险Nomogram模型的ROC曲线下面积(AUC)为0.802(95%CI:0.775~0.829),见图3,表明区分度良好;以上均表明本模型具有良好的预测能力。
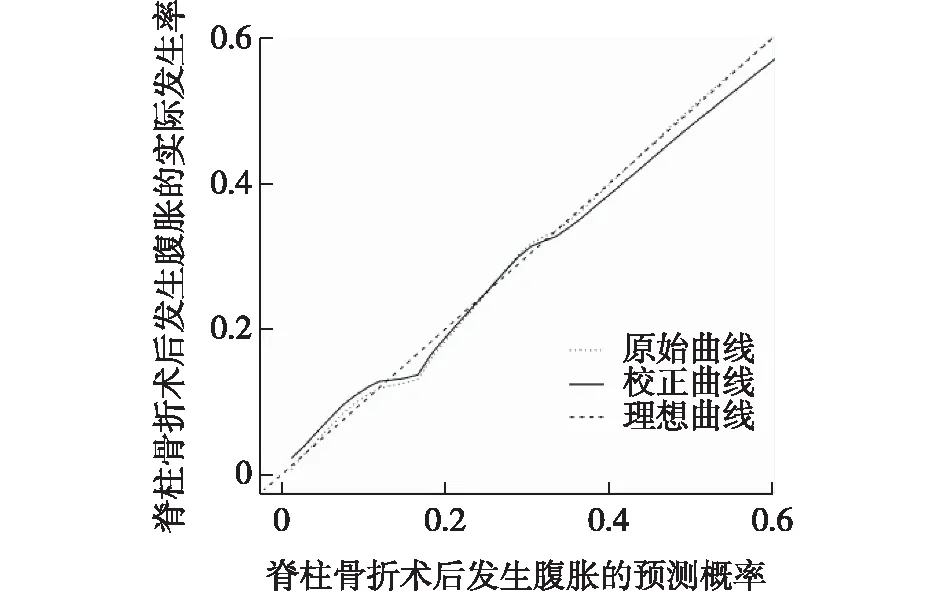
图2 列线图模型的校正曲线验证

图3 列线图模型的ROC曲线验证
3 讨论
当前,脊柱骨折患者围手术期胃肠道功能紊乱发生率非常高,特别是术后,尽管是行微创手术,腹胀发生率仍普遍较高[8]。虽然胃肠道功能紊乱不是脊柱骨折的重要并发症,然而一旦产生却非常影响患者肢体功能恢复,降低其生活质量水平。严重的腹胀可致使患者食欲不振,营养不良,从而影响术后切口恢复,甚至会引起电解质紊乱,进一步诱发肠鸣音减弱、肠麻痹、腹胀加重等症状。另外,腹胀不仅会造成生理不适,也可致使患者产生紧张、易怒、焦虑等负性情绪,刺激中枢神经系统,导致内分泌系统紊乱,进一步加重腹胀[1]。由此可见,胃肠道功能紊乱带给患者的不良影响甚至会大于原发疾病。引起腹胀的因素往往是多方面的,有研究表明约76.2%的患者腹胀是术后疼痛引起的。疼痛一直是骨科医师关注的焦点,它不仅影响患者生理和心理,还在一定程度上影响了术后肢体功能的康复,尽管临床镇痛措施应用繁多,可有效地改善术后疼痛,但仍存在50%~70%的患者术后疼痛得不到良好缓解。另外,脊柱骨折后出血量较多,易引起腹膜后血肿形成,刺激、压迫交感神经,造成交感神经功能紊乱,以致消化道管壁神经丛功能异常,肠蠕动减缓或消失,无法正常排出消化道内气体,从而诱发腹胀[9]。汪涓等[5]研究表明,292例行脊柱骨折术后患者其中有56例发生胃肠道不适,发生率为19.18%。本研究结果显示,318例脊柱骨折术后患者中有64例患者并发腹胀,发生率为20.13%,与上述文献结果大致相符,其差异可能与样本量选取和手术情况等不同有关,可见脊柱骨折术后发生腹胀并非罕见。故术前评估诱发腹胀高危因素,术后针对性实施预防措施十分关键,并进行系统化预防性健康教育,有助于增强患者的自我管理能力,防止术后并发症的产生。
Logistic回归是一种非线性概率型的预测模型,能够研究分类观察结果和一些协变量之间的关系,临床上一般会将其用来分析诱发疾病的高危因素[10]。在并发腹胀的危险因素研究中,张盼盼等[11]研究证实应用抗菌药物是诱发腹胀的重要影响因素。分析原因可能是应用抗菌药物会破坏胃肠道微环境,造成菌群失调,同时与抗菌药物相关性肠炎也会释放毒素引起肠黏膜变性甚至坏死,诱发腹胀。潘美飞等[6]研究表明应用肠道菌群药和胃肠动力药是避免腹胀发生的保护因素,肠道菌群是肠道的正常微生物,它们能够参加糖类及蛋白质的代谢,促进吸收矿物元素,也可以利用蛋白质残渣合成人体必需氨基酸及多种维生素。使用肠道菌群药,可充分促进肠蠕动,减少并发腹胀的风险。应用胃肠动力药是避免腹胀发生的保护因素,推测原因是胃肠动力药可促进肠蠕动,避免食物滞留,同时胃肠动力药可抑制胃肠平滑肌,防止胃肠松弛,能够有效促进胃和十二指肠清除率改善,提高胃肠推进力,从而减少并发腹胀的风险。张在斌等[12]研究证实麻醉方式与腹胀发生密切相关,其中全身麻醉是诱发腹胀的危险因素之一,分析原因可能是全身麻醉对交感及副交感神经具有阻滞作用,胃肠功能需要在术后4~7 h内才会逐渐恢复,因此增加了术后腹胀的发生风险。低血钾是诱发腹胀的重要危险因素,一部分患者术后需应用利尿剂、胰岛素等,导致血钾含量更低。而血钾减少会致使肠腔水分缺乏,粪便干结,还会使神经肌肉兴奋性减弱,造成平滑肌麻痹,从而引发胃肠道胀气,发生腹胀。沈芳[13]和张玉梅等[14]研究表明体位因素与腹胀发生密切相关,长期卧床制动和活动量减少会造成机体代谢减缓,导致胃肠蠕动减慢,诱发腹胀。本研究Logistic回归分析结果显示,应用抗菌药物、未应用肠道菌群药、未应用胃肠动力药、全身麻醉、低钾、术后卧床时间≥5 d、每天下床活动次数<3次是脊柱骨折术后发生腹胀的独立危险因素,这一结果佐证了上述各文献对诱发腹胀危险因素的研究结论。
Nomogram模型主要由赋分值、刻度线段、变量名称三部分组成,每项变量均有对应的赋分线段,变量的每个分类具有对应的得分值,整体简洁直观,便于理解应用[15]。Nomogram无需传统数学模型的复杂运算,仅通过作辅助线和简单的求和计算即可快速得到脊柱骨折术后发生腹胀的风险。本研究构建预测脊柱骨折术后发生腹胀的风险Nomogram模型显示,应用抗菌药物为83分,未应用肠道菌群药为86分,未应用胃肠动力药为95分,全身麻醉为73分,低钾为75分,术后卧床时间≥5 d为100分,每天下床活动次数<3次为86分,医务人员可以通过患者各项目得分情况预测脊柱骨折术后腹胀发生概率,尽早识别高风险患者并将其列为重点监护对象。同时,对可以控制的危险因素给予一定的干预措施,分级开展工作,合理分配医疗资源,从而提高预防性干预的工作效率,以最大限度减少腹胀的发生。为了避免模型的过度拟合和保证模型的准确性,本研究对构建的Nomogram进行了多方面验证,结果显示,C-index为0.808(95%CI:0.778~0.838),校正曲线与理想曲线走势基本一致,ROC曲线下面积(AUC)为0.802(95%CI:0.775~0.829),表明本次模型对脊柱骨折术后发生腹胀的风险具有良好的预测效能。
综上所述,应用抗菌药物、未应用肠道菌群药、未应用胃肠动力药、全身麻醉、低钾、术后卧床时间≥5 d、每天下床活动次数<3次是脊柱骨折术后发生腹胀的独立危险因素,基于上述危险因素建立的Nomogram模型可准确评估和量化脊柱骨折术后发生腹胀的风险。本研究的不足之处:样本量较小,代表性不足,且均取自于同一研究中心,数据可能存在一定的选择性偏倚,也未能纳入其他中心样本进行模型外部验证;另外,影响术后腹胀发生的变量纳入不全面,可能会遗漏有价值的指标,同时也未对患者进行远期随访。下一步将会通过扩大样本量、丰富风险变量、完善试验设计对模型进行优化和验证。
