非体外循环冠状动脉搭桥术后低蛋白血症与补充人血白蛋白对患者急性肾损伤的影响Δ
2022-07-29邱水晶胡占嵩朱梦晨陈丽娟天津市胸科医院药剂科天津300222
邱水晶,胡占嵩,屠 莹,刘 昱,张 瑶,朱梦晨,陈丽娟(天津市胸科医院药剂科,天津 300222)
非体外循环冠状动脉搭桥术(off-pump coronary artery bypass grafting,OPCABG)是在心脏不停跳的情况下,于非体外循环支持的心脏上进行的冠状动脉搭桥术,是近年来冠状动脉粥样硬化性心脏病患者外科治疗的常用手段。与传统冠状动脉搭桥术相比,虽然OPCABG避免了体外循环对患者造成的不良影响(比如血液破坏、管路中细胞吸附等)及相关并发症,具有缩短患者手术时间、住院时间和重症加强护理病房(intensive care unit,ICU)停留时间的优势,但同样可引起患者术中出血、血管内皮损伤、术后引流、应激反应和体内血浆白蛋白大量丢失、消耗、合成减少,从而导致术后低蛋白血症发生风险增加[1]。有研究显示,术前低蛋白血症是冠状动脉搭桥术后患者发生急性肾功能损伤(acute kidney injury,AKI)的独立危险因素,AKI的发生可增加患者并发症发生率和病死率、延长住院时间、增加医疗费用[2],而OPCABG 后低蛋白血症与AKI 发生的相关性仍不明确[3]。
在临床实践中,人血白蛋白作为一种血液制品已被广泛用于失血创伤及烧伤引起的休克、脑水肿及脑损伤引起的颅压升高、肝硬化引起的腹水的治疗,还可用于心脏外科手术后低蛋白血症的纠正,并可促进切口的愈合[4]。但有研究认为,人血白蛋白对心脏外科手术后患者恢复的影响并不优于其他扩容液体[5]。《美国大学医院联盟人血白蛋白、非蛋白胶体和晶体溶液使用指南》和相关研究指出,人血白蛋白不合理应用比例高达40%~90%[6-7]。《白蛋白和免疫球蛋白使用推荐》则认为,人血白蛋白用于心脏外科手术是继晶体溶液和非蛋白胶体的最后选择,仅推荐在心脏外科手术后循环血容量恢复正常且白蛋白浓度低于20 g/L 时使用[8]。国内学者指出,我国也存在人血白蛋白不合理应用的现象[9]。可见,判断心脏外科手术后人血白蛋白的使用是否合理尚缺乏相关规范。基于此,本研究探讨了OPCABG 后低蛋白血症和补充人血白蛋白对患者AKI的影响,以期为临床合理用药提供参考。
1 资料与方法
1.1 纳入与排除标准
本研究的纳入标准为:(1)接受OPCABG 治疗的诊断为冠状动脉粥样硬化性心脏病的患者,包括:①心绞痛经内科治疗不能缓解,影响工作和生活,经冠状动脉造影发现冠状动脉主干或主要分支明显狭窄,其狭窄的远端血流通畅;②左冠状动脉主干狭窄和前降支狭窄应及早手术,且易发生猝死;③冠状动脉如前降支近端狭窄,同时合并有回旋支和右冠状动脉2支以上明显狭窄,功能性检查显示有心肌缺血征象,或左心功能不全、合并有糖尿病等[10]。(2)年龄18~80岁。(3)择期手术。
本研究的排除标准为:(1)慢性肾脏病、AKI病史或肝病患者。慢性肾脏病包括:①肾脏损伤(肾脏结构或肾功能异常)≥3 个月,有或无肾小球滤过率下降,临床表现为病理学检查异常或肾损伤;②肾小球滤过率<60 mL/(min·1.73 m2)的时间≥3 个月,有或无肾损伤证据。肝病包括肝硬化、药物性肝病、自身免疫性肝病、酒精性肝病、非酒精性脂肪肝病、肝脏血管性疾病、肝脓肿、肝性脑病、肝肿瘤、肝功能衰竭、肝脏遗传性疾病等[4]。(2)同时接受其他手术者。(3)术后24 h 内死亡者。(4)2 次及以上开胸者。(5)接受胸腔镜或小切口手术者。(6)合并消耗性疾病,如获得性免疫缺陷综合征、原发或转移性肿瘤、严重感染者。(7)对人血白蛋白过敏或存在使用禁忌者。(8)术前7 d 内使用过非甾体类抗炎药、氨基糖苷类药物者。(9)基本信息、住院期间检测指标、手术分类等重要信息缺失者。
1.2 样本量估计
首先,确定纳入因素中的自变量数:由于美国麻醉师协会(American Society of Anesthesiologists,ASA)分级和冠状动脉搭桥数量这2 个因素都可细分为3 个水平,因此这2个因素在纳入多因素模型时需要设置亚变量,即回归分析时各自变为2个自变量,得到本研究的自变量数为25个;然后,按照建立多因素模型的基本要求,即样本量是自变量的10~20倍[11],得到本研究的样本量范围为250~500例。
1.3 AKI诊断标准
相关诊断应符合《KDIGO 成人AKI 诊断及分期标准》和《急性肾损伤的预防,检测和管理(NG148)》指南:当患者术后48 h 内血肌酐浓度增加≥26 μmol/L 或7 d内血肌酐浓度增加>基线值的50%~99%或术后持续6~12 h 的尿量<0.5 mL/(kg·h),满足以上任一条件即可诊断为AKI。其中,当患者术后7 d 内血肌酐浓度增加>基线值的100%~199%或术后超过12 h 的尿量<0.5 mL/(kg·h),为AKI 2 期;未达到2 期标准,为AKI 1期;当术后7 d内血肌酐浓度增加≥基线值的200%或术后超过24 h的尿量<0.5 mL/(kg·h)或超过12 h无尿,为AKI 3 期[12-13]。低蛋白血症诊断标准为术后3 d 内血浆白蛋白浓度<35 g/L[4]。
1.4 临床资料收集
本研究方案经医院伦理委员会审核通过(编号为2022LW-005)。回顾性收集2018 年12 月-2020 年1 月于我院择期行OPCABG 的冠状动脉粥样硬化性心脏病患者的临床资料,汇总其基本资料(年龄、性别、既往病史、手术史、术前7 d 内检查结果)、ASA 分级、冠状动脉搭桥数量、术中出血量、人工胶体使用情况、术后7 d 内血红蛋白最低值、术后低蛋白血症发生情况、术后入住ICU时间、胸腔置管引流量、围术期输血量、术后人血白蛋白用量等。
1.5 白蛋白补充方案
收集患者OPCABG 后7 d 内人血白蛋白的使用总剂量。人血白蛋白注射剂购自国药集团武汉血液制品有限公司,国药准字为S19993018,规格为10 g/瓶(20%,50 mL)。
1.6 统计学方法
采用SPSS 19.0软件对数据进行统计分析。符合正态分布的计量资料以表示,组间比较采用独立样本t检验;不符合正态分布的计量资料以M(P25,P75)表示,组间比较采用秩和检验。计数资料以例数或率表示,组间比较采用χ2检验。筛选单因素分析中P<0.1 的指标[2-3,13],采用多因素Logistic 回归分析AKI 发生的影响因素;同时,按术后是否发生低蛋白血症进行分层分析。检验水准α=0.05。
2 结果
2.1 基本资料
共收集到484 例择期行OPCABG 的冠状动脉粥样硬化性心脏病患者的临床资料,其中男性366 例(75.6%)、女性118例(24.4%),平均年龄(63.9±8.2)岁;术后发生低蛋白血症者137 例(28.3%);术后发生AKI者70例(14.5%),其中AKI 1期65例、2期4例、3期1例;未发生AKI者414例(85.5%)。
2.2 AKI组和非AKI组患者术前术后相关资料比较
根据是否发生AKI 将所有患者分为非AKI 组(414例)和AKI 组(70 例)。AKI 组患者的年龄、体质量指数(body mass index,BMI)、高血压比例、术前7 d内血肌酐浓度、术后低蛋白血症比例、术后入住ICU时间、胸腔置管引流量、术后人血白蛋白用量均显著高于或长于非AKI 组(P<0.05),术后7 d 内血红蛋白最低值显著低于非AKI组(P<0.05);而两组患者其余指标比较,差异均无统计学意义(P>0.05)。结果见表1。
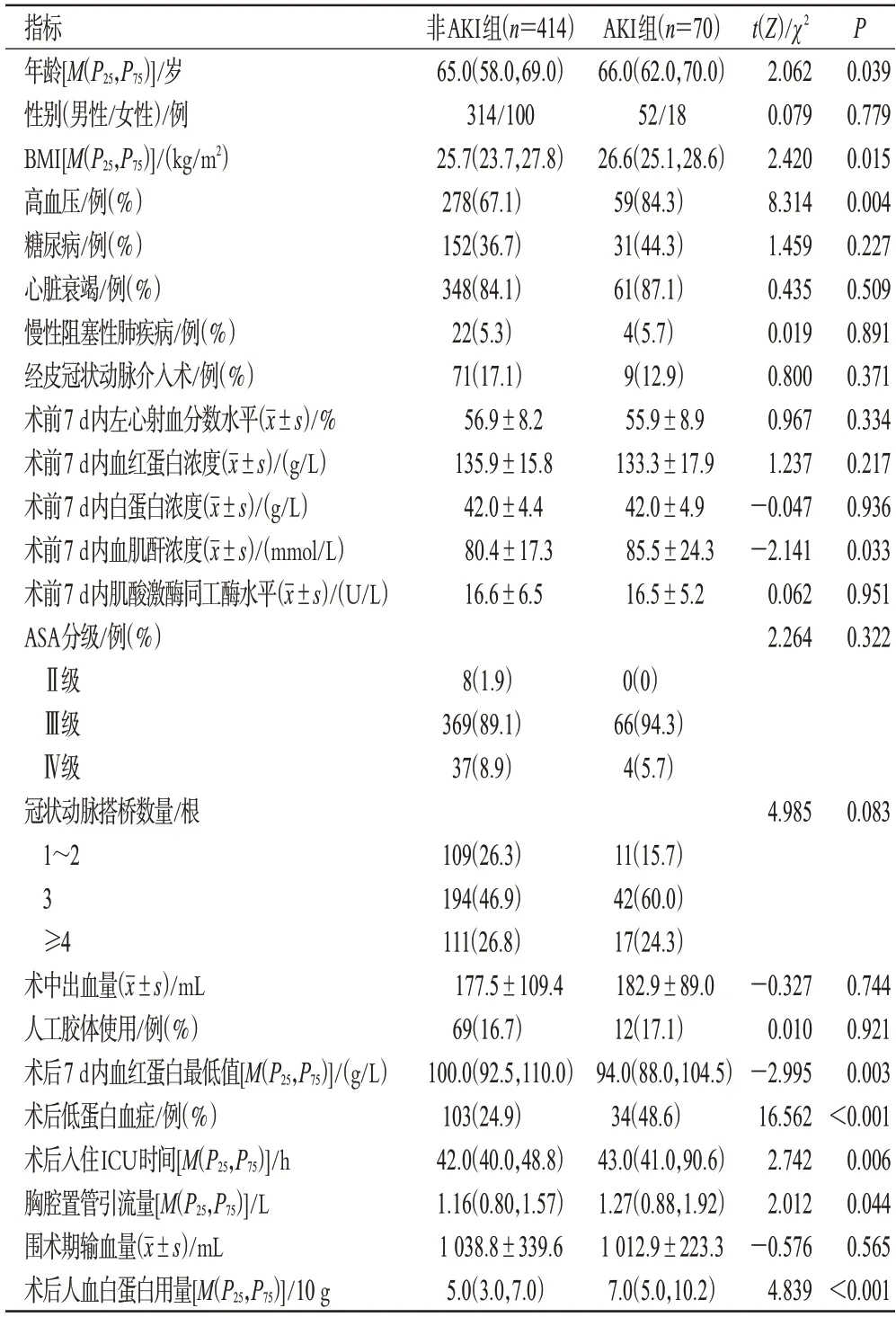
表1 AKI组和非AKI患者术前术后相关资料比较
2.3 AKI的影响因素分析
在调整混杂因素后,多因素Logistic 回归分析结果显示,术后低蛋白血症不是患者发生AKI 的危险因素(P>0.05)。BMI 较高、术后人血白蛋白用量是患者发生AKI 的危险因素(P<0.05):BMI 每增加1 个单位,患者发生AKI的风险将增加12.7%;术后人血白蛋白用量每增加10 g,患者发生AKI 的风险将增加17.3%。结果见表2(因《急性肾损伤的预防,检测和管理(NG148)》指南指出糖尿病、心脏衰竭是心脏外科手术后发生AKI的危险因素[13],相关文献也指出OPCABG前低蛋白血症是术后发生AKI的独立风险因素[3],所以为减少结果偏差,本研究将P>0.1的糖尿病、心脏衰竭、术前7 d内白蛋白浓度这3个变量也纳入了多因素分析,下同)。

表2 术后发生AKI的多因素Logistic回归分析结果
2.4 分层分析
根据术后是否发生低蛋白血症将所有患者分为正常蛋白组(347例)和低蛋白血症组(137例)。其中,正常蛋白组有36例(10.4%)患者发生AKI,低蛋白血症组有34 例(24.8%)患者发生AKI。多因素Logistic 回归分析结果显示,正常蛋白组患者术后人血白蛋白用量每增加10 g,其发生AKI的风险将增加26.9%;低蛋白血症组患者术后人血白蛋白用量每增加10 g,其发生AKI的风险将增加14.0%。结果见表3、表4(由于正常蛋白组和低蛋白血症组各自变量的P值均不相同,所以对于影响术后发生AKI的自变量也不相同,故纳入多因素分析的指标不同)。
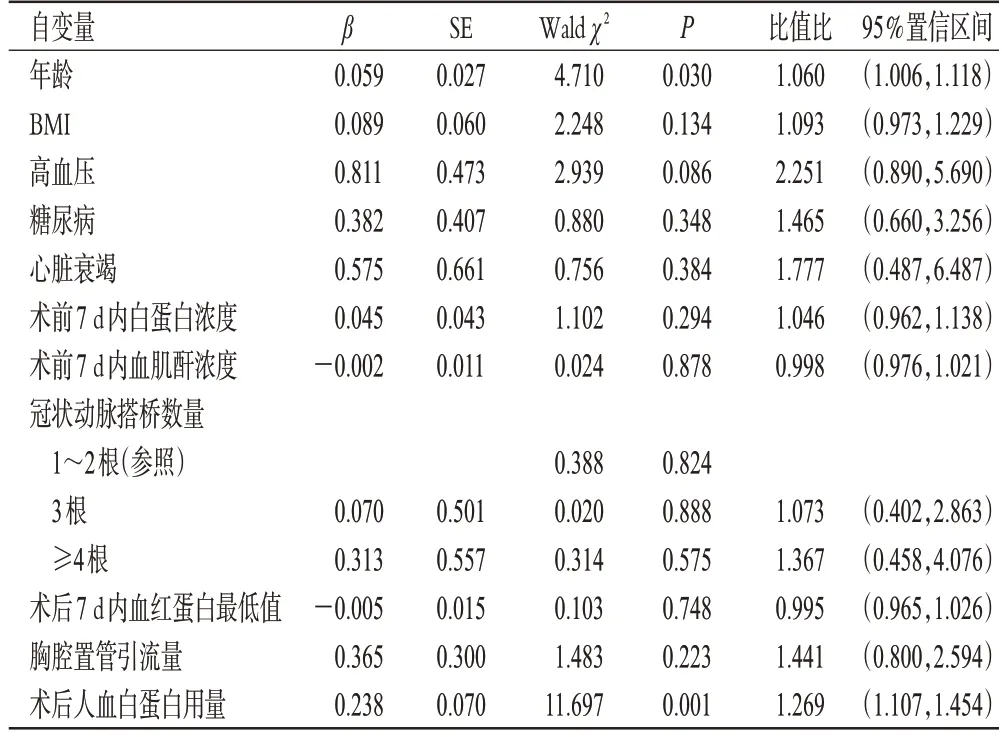
表3 正常蛋白组患者术后发生AKI 的多因素Logistic回归分析结果
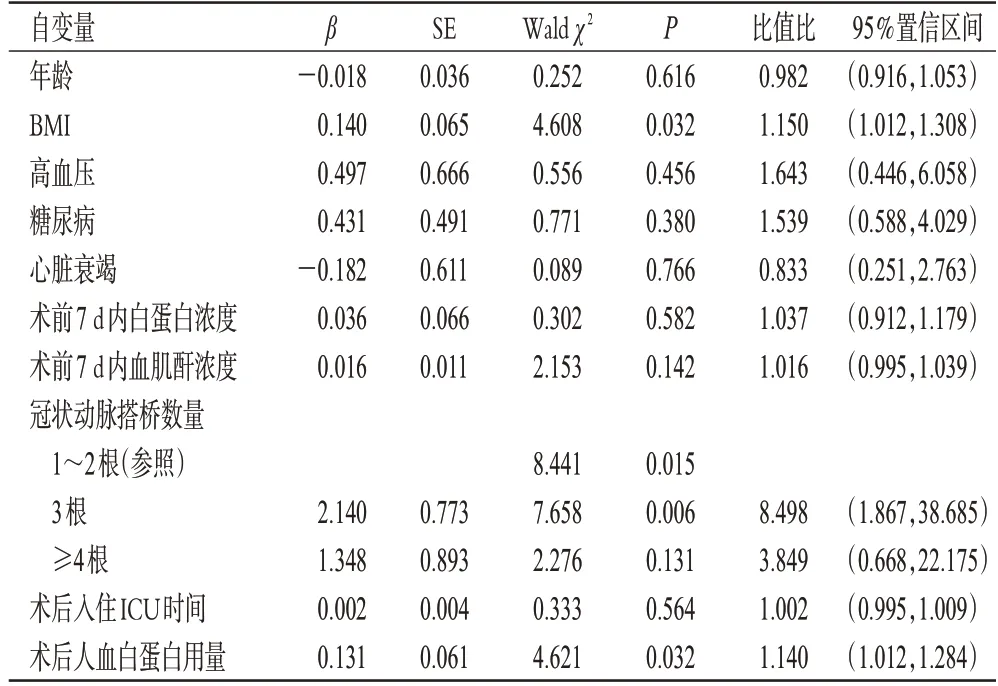
表4 低蛋白血症组患者术后发生AKI的多因素Logistic回归分析结果
3 讨论
白蛋白是一种相对分子量较小的血浆蛋白,于肝细胞内合成,合成速率为9~12 g/d;控制合成速率的主要因素为血浆胶体渗透压和血管外肝脏渗透压,此外还涉及血浆中多种物质(比如激素、微量元素等)的非特异性转运载体[4]。白蛋白分布于人体组织间隙(60%~70%)和血管(30%~40%)内,占正常血管内蛋白总量的55%~65%,可提供75%~80%的血浆胶体渗透压[4,14-15]。由于白蛋白的半衰期较长(21 d),因此其浓度变化主要反映了慢性疾病、严重营养不良的病理状态[4];而由白蛋白合成减少或分解增加所引发的低蛋白血症则需要更长的时间,因此继发于出血或渗出性血管内的白蛋白明显减少,如手术或烧伤等是导致患者白蛋白迅速降低甚至引发低蛋白血症的主要原因[14]。有研究指出,心脏外科手术7 h内白蛋白的毛细血管逃逸率可平均增加100%,是合成和分解代谢速率的10倍以上;术后血管通透性的快速增加使得更多的白蛋白进入组织间隙,这也是术后白蛋白浓度降低的重要原因[16]。同时,由术中出血、术后补液量增加致血液稀释而引起的术后低蛋白血症是一种暂时性状态,因此OPCABG后出现低蛋白血症较为常见,发生率为17%~35%[3]。在本研究中,OPCABG后的低蛋白血症发生率为28.3%,这与上述文献结果基本一致[3]。在排除年龄、BMI等混杂因素的干扰后,多因素Logistic回归分析结果显示,低蛋白血症不是OPCABG后发生AKI的独立危险因素。有研究认为,白蛋白通常在术后7 d左右可以恢复正常[17];也有学者认为,术后低蛋白血症是一种疾病过程的结果,而不是原因,因此并不推荐以低蛋白血症或白蛋白浓度来评估患者术后发生AKI的风险[8]。
OPCABG 中低体温、低血流量、神经刺激和术后氧化应激、炎症反应等因素可致使患者血管收缩、肾灌注减少,而持续的低灌注可导致肾小管结构及其上皮细胞受损,从而进一步造成肾功能障碍,最终引发AKI[2]。本研究中,有70例患者(14.5%)术后发生了AKI,与国外研究报道的AKI发生率为13.7%~25.7%基本一致[3]。笔者分析,本研究AKI发生率较低的原因可能与我院为三级甲等心胸专科医院,医疗条件、技术水平相对完善有关。有研究认为,通过术后补充人血白蛋白来提高血浆胶体渗透压以维持肾灌注、减少外周水肿的作用是暂时的[17]。术后血管内皮受损,使得毛细血管通透性显著增加,白蛋白从血管内逃逸明显加快,此时补充人血白蛋白,约有2/3 的输入量将在4 h 内进入组织间隙[14],使得组织间隙胶体渗透压升高,跨越小血管壁的压力差减少,从而改变血管和组织间的液体交换,导致血管内液体向组织间隙转移,造成包括肾脏在内的重要脏器组织水肿、相对血容量不足、有效灌注减低,而增加肾脏损伤[18]。有研究显示,与OPCABG 前给予人血白蛋白相比,术后24 h内给予人血白蛋白的患者的AKI发生率更高[3]。本研究结果显示,术后人血白蛋白用量是患者发生AKI 的独立危险因素。按术后是否发生低蛋白血症的进一步分层分析的结果显示,不论正常蛋白组患者还是低蛋白血症组患者,术后补充人血白蛋白均为发生AKI的危险因素。
本研究结果还显示,在正常蛋白组中,年龄是OPCABG后患者发生AKI的危险因素。笔者分析,原因为随着患者年龄的增加,其肾脏血流量下降,肾小球滤过率降低,使得肾脏更易受到损伤[2]。因此推测,OPCABG 后正常蛋白组的老年患者发生AKI 的风险更高。此外,由于肥胖患者的相对组织间隙占比较高,更易导致术后血管内液体向组织间隙转移,使得组织水肿、相对血容量不足、有效灌注减低发生的可能性更高[18]。本研究结果显示,BMI较高是低蛋白血症组患者术后发生AKI的危险因素。
综上所述,术后低蛋白血症不是OPCABG 后患者发生AKI的危险因素,但术后补充人血白蛋白是患者发生AKI的危险因素。因此,临床应提高对术后低蛋白血症的认识,不应常规使用人血白蛋白来纠正OPCABG后低蛋白血症。由于本研究为单中心病例研究,故此结论尚有待多中心、大样本研究进一步证实;此外对于不同程度的低蛋白血症是否会增加AKI 的发生风险仍有待进一步研究。
