血清外泌体miR-17-5p和miR-20b-5p在非小细胞肺癌中的表达及其诊断价值
2022-07-29魏萍
魏 萍
中国人民解放军联勤保障部队第九六〇医院肾内科肾病实验中心,山东济南 250031
肺癌是全球发病率高居第二位、病死率位居第一的恶性肿瘤[1-2]。肺癌的病理学分类主要分为非小细胞肺癌(NSCLC)和小细胞肺癌(SCLC),其中NSCLC又分为鳞癌(SCC)、腺癌和大细胞癌等,约占肺癌发生率的80%以上[3-4]。外泌体是细胞外囊泡的一个子集,是一种脂质双分子层包裹的小囊泡,直径为30~150 nm,密度为1.13~1.21 g/mL,呈球形、扁球形或杯状结构,存在于血清、尿液、唾液、胸腔积液等多种体液中[5]。研究表明,在NSCLC的微环境中,外泌体miRNA在癌症和间质细胞之间的转移已被证明与癌症的发生和进展有关[6-7]。外泌体通过miRNA在肿瘤细胞间传递遗传信息,从而促进肺癌细胞增殖和转移[8]。本研究探讨血清外泌体miR-17-5p和miR-20b-5p在NSCLC中的表达及其诊断价值,旨在了解外泌体miRNA与NSCLC的关系,为NSCLC的早期诊断提供新的生物标志物。
1 资料与方法
1.1一般资料 选取2018年1-12月就诊于中国人民解放军联勤保障部队第九六〇医院,新确诊且未经治疗的NSCLC患者179例作为NSCLC组。纳入标准:(1)采血前NSCLC患者未采取手术切除和放化疗等方法的治疗;(2)通过手术切除且病理确诊为NSCLC;(3)NSCLC患者无其他系统肿瘤;(4)病历相关资料记录完善。另选取在本院体检中心进行体检的健康者144例作为健康对照组。纳入标准:(1)年龄45周岁以上;(2)影像学及肿瘤标志物检测均未见明显异常;(3)无任何肿瘤相关疾病或其他重大疾病。TNM分期参照文献[9]进行划分。随机将收集的NSCLC患者和健康对照者标本分为训练集和验证集,两组临床数据资料包括年龄、性别、淋巴结是否转移、肿瘤最大径和TNM分期比较,差异均无统计学意义(P>0.05)。见表1。
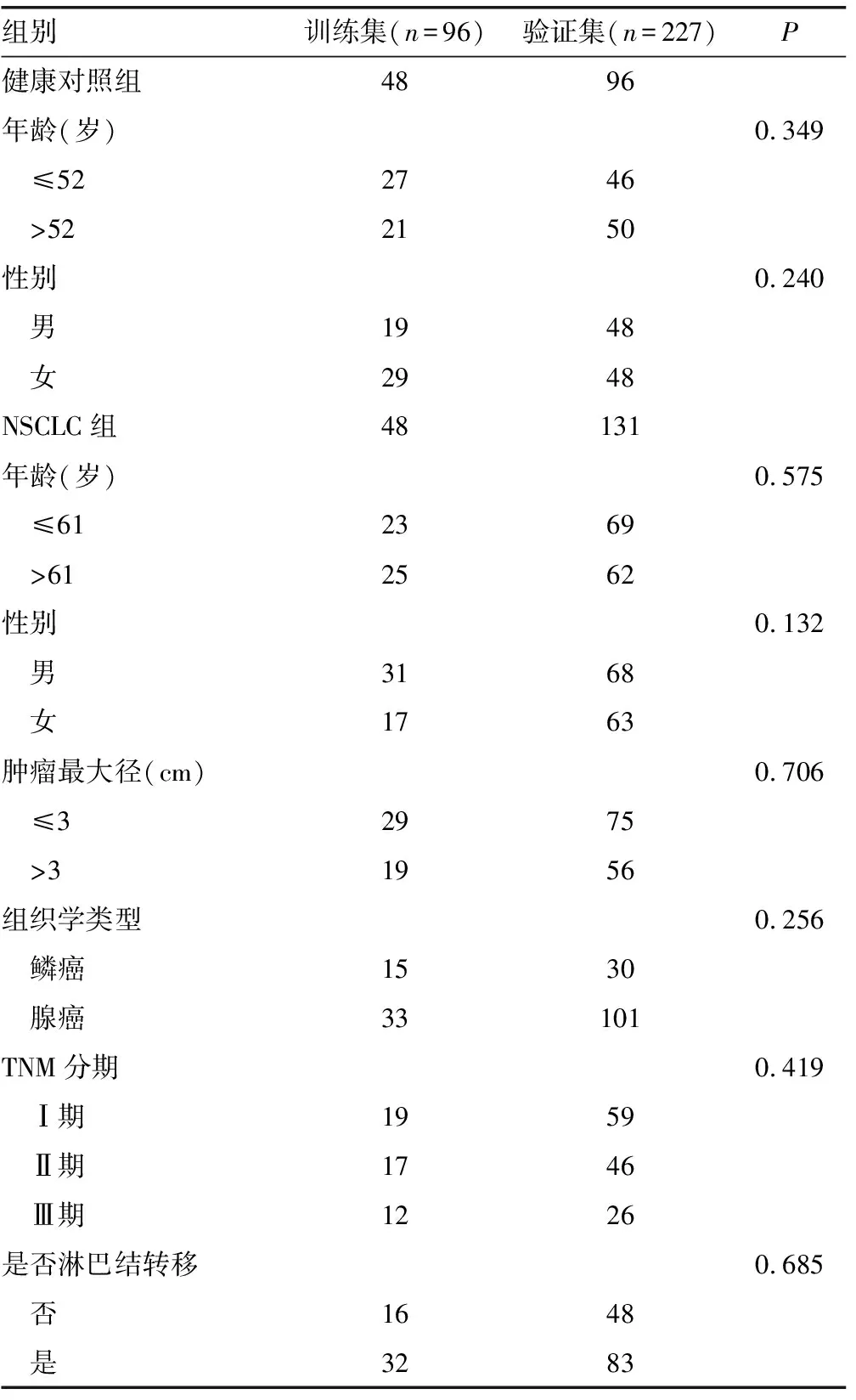
表1 两组训练集和验证集的临床特征比较(n)
1.2仪器与试剂 CFX-96实时荧光定量PCR仪(美国Bio-Rad公司);ExoQuickTM试剂(美国,SBI公司);Trizol试剂和总RNA提取试剂(德国,QIAGEN);逆转录试剂盒、miRNA引物和qRT-PCR试剂(美国GeneCopoeia公司);蛋白质定量试剂盒(美国 Thermo 公司);鼠抗人 TSG101 蛋白单克隆抗体(英国 Abcam);兔抗人 CD9 蛋白单克隆抗体:(美国,CST公司);辣根过氧化物酶标记的山羊抗鼠和山羊抗兔 IgG (美国,CST公司)。
1.3方法
1.3.1实验设计 通过检索PubMed数据库,根据文献[10]报道来自同源的3个miRNA基因簇,包括miR-17-92、miR-106a-363、miR-106b-25家族编码的共15个miRNA,因其在NSCLC患者的支气管肺泡灌洗液中高表达,所以将其作为候选分子。分子成员见表2。

表2 3个miRNA簇的分子成员
1.3.2血清外泌体的提取和鉴定 (1)血清外泌体的提取。加入63 μL ExoQuickTM沉淀剂,加冰4 ℃冰箱放置30 min。4 ℃、1 500 r/min离心30 min。倒掉上清,继续离心5 min,吸掉上清液。加入50 μL磷酸盐缓冲液,振荡吹打混匀将外泌体悬浮。用于下一步RNA的提取、外泌体鉴定或储存于-80 ℃冰箱待用。(2)透射电子显微镜鉴定血清外泌体。首先将待鉴定的血清外泌体样本分别进行50×和100×稀释,取15 μL样本滴于碳膜铜网上,小心夹住铜网,吸附1 min。将铜网置于滤纸上,以吸去多余的样本。滴入配制好的2%醋酸双氧铀染液15 μL进行负染1 min,将铜网放在灯下烘烤10 min进行观察。(3)纳米颗粒跟踪分析(NTA)技术。用磷酸盐缓冲液1∶10 000重悬外泌体,将样品注射到纳米颗粒跟踪分析仪器中,根据利用光散射和布朗运动的特性对样本进行粒径和浓度分析。重复检测样本两次。(4)蛋白质免疫印迹(Western Blot)鉴定外泌体表面标志性蛋白CD9和TSG101将提取好的外泌体及去除外泌体的血清蛋白样品加入含有蛋白酶抑制剂的RIPA蛋白裂解液进行裂解。按照蛋白质定量试剂盒进行蛋白定量。利用十二烷基磺酸钠-聚丙烯酰胺凝胶分离蛋白,转至聚偏二氟乙烯膜上后,用新鲜的5%脱脂奶粉封闭。孵育CD9 和TSG101的第一抗体和第二抗体。使用电化学发光法显色、曝光。
1.3.3提取血清外泌体RNA、逆转录和qRT-PCR 根据文献[11-12]报道,选用miR-16-5p作为血清外泌体中每种miRNA的qRT-PCR内参照。通过克隆测序验证miRNA特异性扩增产物。qRT-PCR引物序列表3。

表3 qRT-PCR 引物序列
1.3.4常见肿瘤标志物的检测 血清鳞状细胞癌抗原(SCCA)通过雅培i1000化学发光仪及其配套试剂检测;血清癌胚抗原(CEA)和细胞角蛋白19片段(CYFRA21-1)通过罗氏Cobas e601全自动电化学发光仪及其配套试剂检测。
1.4统计学处理 采用SPSS23.0统计软件进行数据处理。采用2-ΔΔCt计算每个样本中每个miRNA分子的相对表达量。非正态分布的计量资料以M(P25,P75)表示,并采用非参数Mann-WhitneyU检验进行统计分析。利用GraphPad Prism 5软件绘制散点图;利用MedCalc9.6.4.0软件绘制受试者工作特征曲线(ROC曲线)、计算曲线下面积(AUC),计算差异表达的miRNA对NSCLC的诊断效能。利用软件MATLAB运用Logistic回归分析建立NSCLC诊断模型。P<0.05表示差异有统计学意义。
2 结 果
2.1鉴定血清外泌体 外泌体经醋酸双氧铀水溶液染色后,置于低分辨率透射电镜下观察,视野内可见具有囊状双层脂质膜结构的圆形颗粒,直径约为100 nm,见图1A。Western Blot在提取的血清沉淀物中成功鉴定出外泌体表面标志蛋白CD9、TSG101(见图1B),而这两种外泌体表面标志蛋白在去除沉淀的上清液中呈低表达。通过NTA技术观察外泌体样品粒径大小及颗粒浓度,结果显示颗粒直径为30~200 nm占99.5%,分散均一,呈单峰正态分布曲线,峰值约为115.2 nm。以上结果表明,利用此方法可以从血清中分离出完整的外泌体,为下一步研究血清外泌体中的生物标志物提供了基础保证。

注:A为透射电镜下外泌体形态; B为Western Blot实验鉴定表面标志蛋白CD9和TSG101在血清外泌体和去除外泌体的血清上清液中的表达情况。
2.2两组训练集血清外泌体miR-17-5p和miR-20b-5p相对表达量比较 两组训练集血清外泌体miR-17-5p和miR-20b-5p相对表达量比较见表4。ROC曲线分析显示,miR-17-5p的AUC为0.834(95%CI:0.744 ~0.902),灵敏度为75.0%,特异度为83.3%。miR-20b-5p的AUC为0.808(95%CI:0.715~0.881),灵敏度为72.9%,特异度为85.4%。见图2。
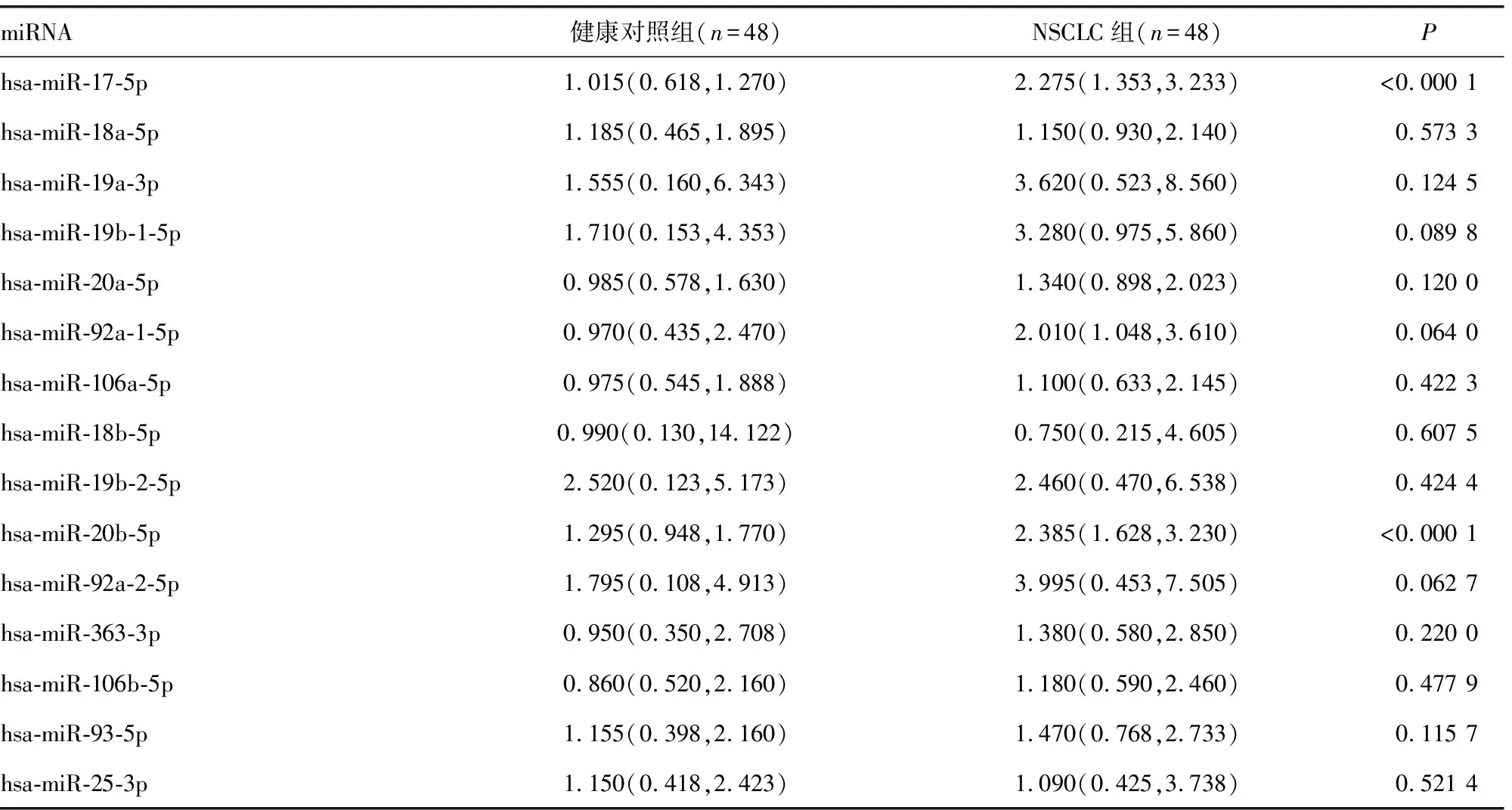
表4 两组训练集血清外泌体miR-17-5p和miR-20b-5p相对表达量比较[M(P25,P75)]
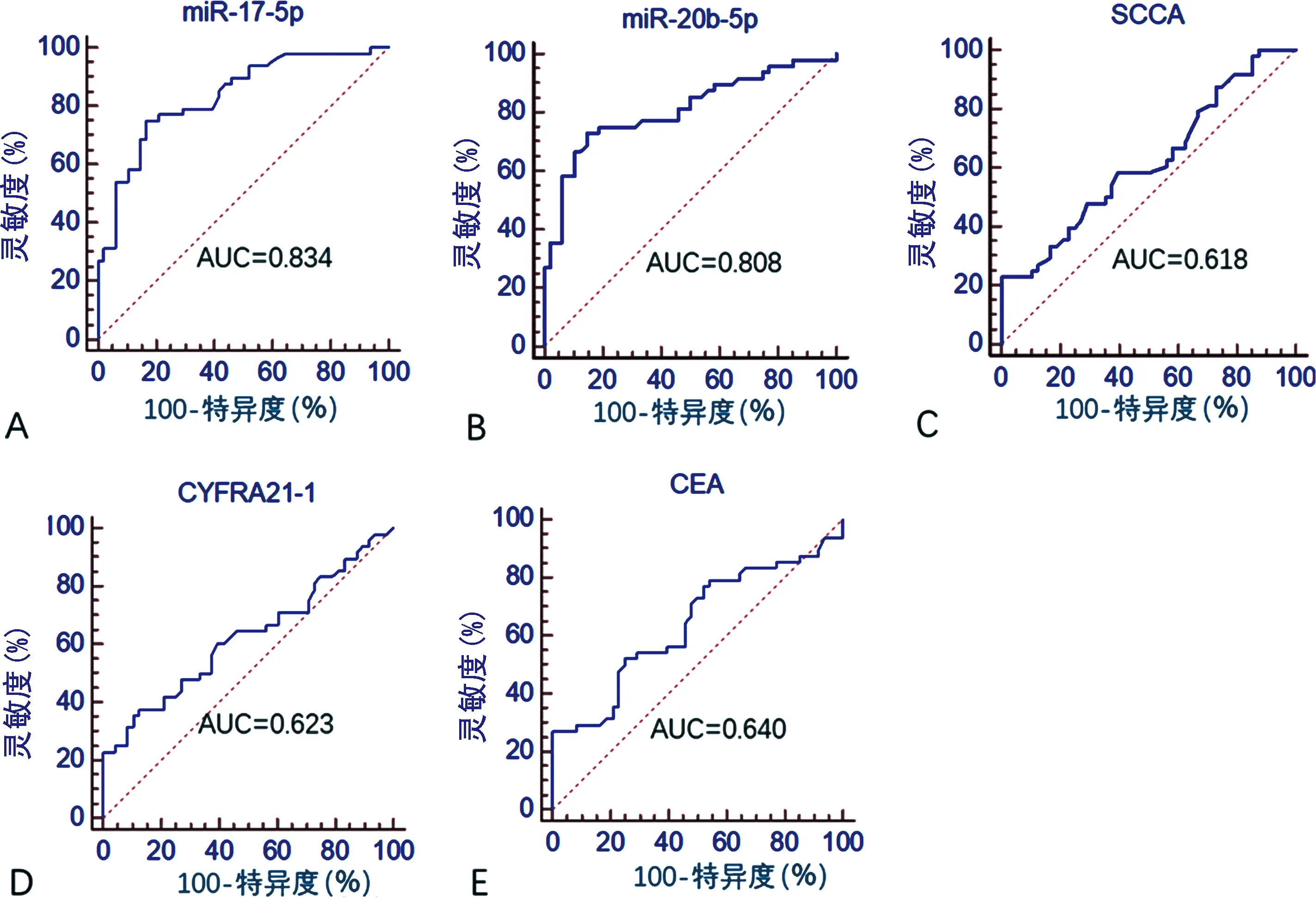
注:A~E依次为NSCLC组训练集血清外泌体miR-17-5p 、miR-20b-5p、SCCA、CYFRA21-1和CEA对NSCLC诊断的ROC曲线。
2.3两组验证集血清外泌体miR-17-5p和miR-20b-5p相对表达量比较 NSCLC组验证集血清外泌体miR-17-5p和miR-20b-5p与健康对照组比较,差异有统计学意义(均P<0.000 1,见表5)。ROC曲线分析显示,miR-17-5p 的AUC 为0.784(95%CI:0.725~0.836),灵敏度为71.0%;特异度为75.0%,miR-20b-5p的AUC为0.756(95%CI:0.695~0.810),灵敏度为68.7%;特异度为75.0%。见图3。
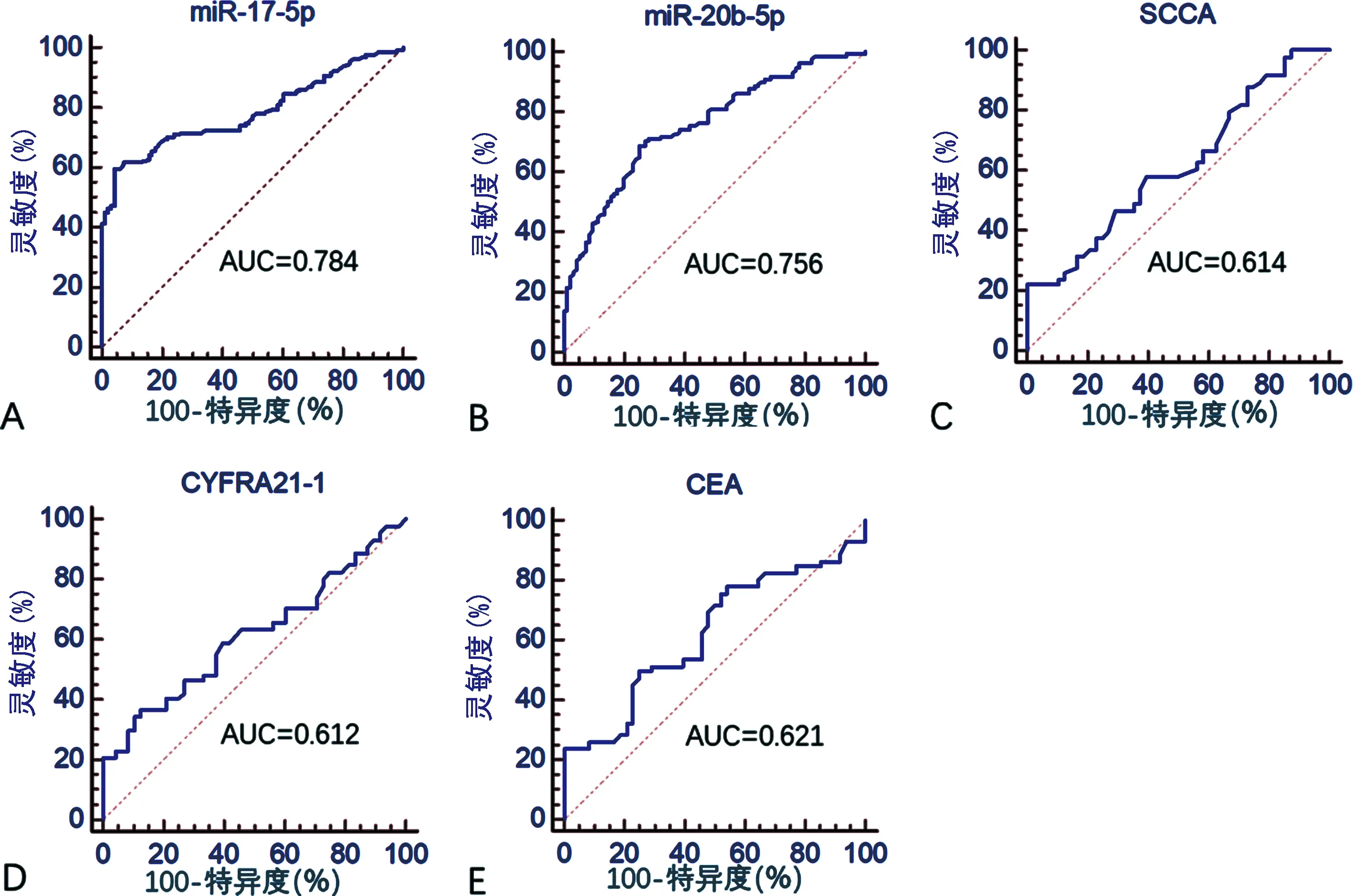
注:A~E依次为NSCLC组验证集血清外泌体miR-17-5p 、miR-20b-5p、SCCA、CYFRA21-1和CEA对NSCLC诊断的ROC曲线。

表5 两组验证集血清外泌体miR-17-5p和miR-20b-5p相对表达量比较[M(P25,P75)]
2.4建立NSCLC血清外泌体miRNA诊断模型及诊断效能 在训练集中,将NSCLC组筛选的血清外泌体中miR-17-5p和miR-20b-5p和血清SCCA、CYFRA21-1和CEA的相对表达量通过 Matlab 软件进行Logistic 多元回归分析,建立NSCLC血清外泌体miRNA诊断模型,公式如下:logit(P)=1.371 3-(0.373 9×miR-17-5p)-(0.175 8×miR-20b-5p)-(0.046 8×CEA)-(0.020 6×CYFRA21-1)-(0.082 1×SCCA)。采用ROC曲线分析建立的模型对NSCLC的诊断效能,其AUC为0.914(95%CI:0.839~0.961),灵敏度为0.916,特异度为0.833。此模型对NSCLC的诊断效能优于其中任何一个单个分子。将分析得出的NSCLC血清外泌体miRNA诊断模型代入验证集中进一步验证其诊断效能。验证集中诊断模型对NSCLC诊断的AUC为0.824(95%CI:0.768~0.871),灵敏度为72.5%,特异度为72.9%,显著高于验证集中单一分子的AUC。该诊断模型对TNM不同分期的NSCLC患者进行诊断,其对NSCLC 患者TNM分期Ⅰ期、Ⅱ期、Ⅲ期诊断的AUC分别为0.783(95%CI:0.710~0.845)、0.832(95%CI:0.760~0.889)和0.902(95%CI:0.835~0.948)。见图4。
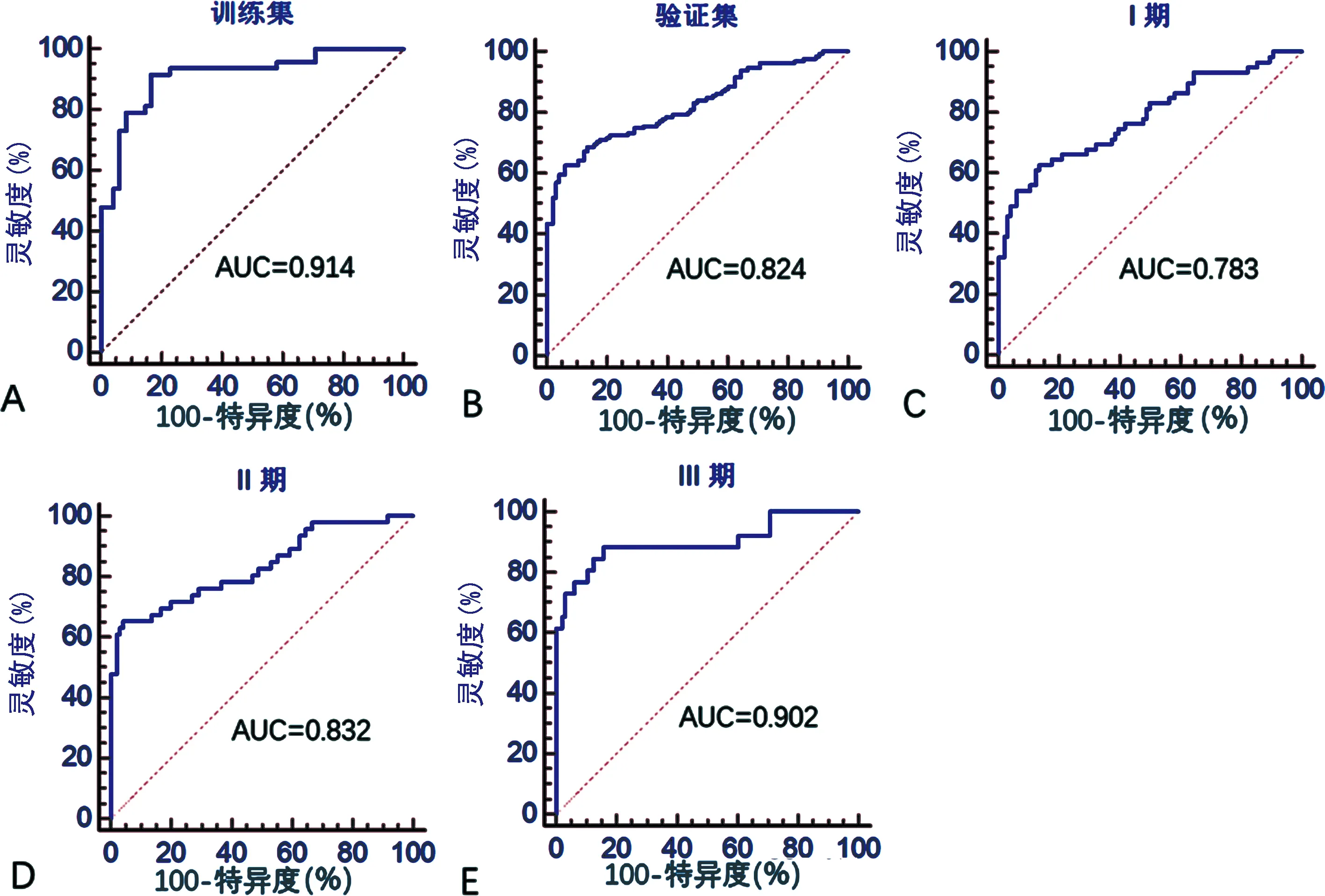
注:A为训练集的诊断模型ROC,B为验证集的诊断模型ROC。C、D、E图分别为诊断模型对非小细胞肺癌TNM分期Ⅰ期、Ⅱ期、Ⅲ期的诊断效能。
3 讨 论
研究者指出,NSCLC初步诊断后,大多数TNM分期Ⅰ~Ⅱ期患者可从手术切除中获益,而晚期患者多选择非手术治疗,预后较差[13]。目前CT平扫已广泛用于健康查体中,虽能筛选及早发现肺内小结节,但容易漏检早期不典型的肺癌,且受到费用高、辐射性等方面制约。因此,寻找更有效的诊断早期NSCLC的生物标志物至关重要。
相对于传统组织活检,血清外泌体检测可重复操作,患者无痛苦,可用作监测病情发展及预后的指标[14]。相对于冗长复杂的超速离心法提取外泌体,本研究采用的聚合物共沉淀分离外泌体,具有较高的提取率,且操作简便、快捷。沉淀后,这些外泌体可以通过在离心机进行简单的低速离心进行回收[15]。
本研究运用了透射电子显微镜、NTA技术和Western Blot 3种方法验证利用聚合物共沉淀可以成功提取完整的外泌体。透射电镜下可见具有囊状双层脂质膜结构的圆形颗粒,直径约为100 nm,具有茶托样结构的囊泡样物质。Western Blot在提取的血清沉淀物中成功鉴定出外泌体表面标志蛋白CD9、TSG101,而这两种外泌体表面标志蛋白在去除沉淀的上清中呈低表达。通过NTA技术观察外泌体,结果显示颗粒直径分布于30~200 nm范围占99.5%,分散均一,呈单峰正态分布曲线,峰值约为115.2 nm。以上结果表明,利用沉淀法可以从血清中分离出完整的外泌体,为下一步研究血清外泌体中的生物标志物提供了基础保证。
本研究评估了血清外泌体中miRNA作为诊断NSCLC的生物标志物的潜在应用价值。有研究表明,不同的miRNA表达谱在NSCLC中被鉴定和验证,miRNA作为肺癌诊断和预后的生物标志物的具有潜在的应用价值[16]。本研究的15个miRNA分子来自同源的3个miRNA簇。大多数的报道都只研究1种miRNA的作用,而对于同源miRNA簇作为分子标志物的研究并不多。已有报道,NSCLC患者的肿瘤组织和血清中miR-17-5p相对表达量较健康对照者高表达[17],与本研究结果相一致。本研究将筛选出的训练集中的miR-17-5p和miR-20b-5p两个分子,联合CEA、CYFRA21-1和SCCA建立针对NSCLC诊断的新模型,对训练集和验证集中NSCLC诊断效能均较高,并且随着TNM分期的递增,该诊断模型对TNM分期Ⅰ期、Ⅱ期、Ⅲ期的诊断效能逐渐增强,AUC逐渐增大。
本研究血清外泌体中miR-17-5p和miR-20b-5p对NSCLC的诊断效能均高于目前临床开展的蛋白肿瘤标志物(SCCA、CYFRA21-1和CEA),有发展为临床应用的诊断NSCLC生物标志物的潜力。对于血清外泌体miR-17-5p和miR-20b-5p与临床病理参数的相关性得出的结论,在后续的研究中将进一步扩大样本量,验证其相关性。
本研究miR-17-5p和miR-20b-5p在NSCLC血清外泌体中呈现高表达的趋势,可能与其研究选取的样本类型、受试对象的人群特征、所采取的实验设计方式等不同有关。
综上所述,本研探讨NSCLC患者血清外泌体miR-17-5p和miR-20b-5p的表达并分析其临床诊断价值,发现miR-17-5p和miR-20b-5p是潜在的诊断NSCLC的生物标志物。由血清外泌体miR-17-5p和miR-20b-5p联合血清SCCA、CYFRA21-1和CEA建立的NSCLC诊断模型,对于NSCLC具有较高的诊断效能,并与TNM分期具有重要的关系,是理想的诊断模型。也为进一步研究其在NSCLC中的作用机制和临床意义奠定基础。
