液体培养基硝酸还原酶试验快速检测临床常用抗结核药物最小抑菌浓度和临界浓度效果评价
2022-07-29杜晶辉黄自坤龚菁菁刘基波
杜晶辉, 黄自坤, 刘 旻, 龚菁菁, 王 丹, 刘基波, 刘 旭
(1.天津中医药大学第一附属医院 国家中医针灸临床医学研究中心检验科,天津 300193;2.南昌大学第一附属医院检验科,江西 南昌 330006;3.天津中医药大学第一附属医院 国家中医针灸临床医学研究中心感染疾病科,天津 300193)
结核病是严重危害人类健康的感染性疾病。对利福平和异烟肼耐药的多重耐药结核分枝杆菌(multidrug resistant-Mycobacterium tuberculosis,MDR-MTB)引起的耐药问题日益严重,随着广泛耐药结核分枝杆菌(extensively drug-resistantMycobacterium tuberculosis,XDRMTB)的出现,结核分枝杆菌(Mycobacterium tuberculosis,MTB)耐药问题已经成为全球性的健康问题,并使世界卫生组织结核病控制计划的实施受到限制[1]。XDR-MTB是指除MDR-MTB外对任何氟喹诺酮类药物和3种二线注射药物(卷曲霉素、卡那霉素和阿米卡星)中至少1种耐药的MTB。全国结核病耐药性基线调查报告最新数据表明,中国肺结核患者中,耐药结核病、多重耐药结核病和广泛耐药结核病的发生率分别为38.25%、8.32%和0.68%[2]。因此,快速、准确的药物敏感性试验结果对及时调整治疗策略,最大程度地减少耐药菌株的出现非常关键。
目前,广泛使用的MTB体外药物敏感性试验的标准方法是琼脂比例法(agar proportion method,APM)和绝对浓度法。这2种方法需要在固体培养基上培养病原,较费时费力,不能满足临床的需求。虽然分子线性探针技术和MGIT 960法可快速检测MTB的耐药性[3-4],但由于成本高,且需要复杂的基础设施,在大多数发展中国家无法普及。资源有限的医疗机构迫切需要准确、快速、低成本的MTB体外药物敏感性试验方法。
2011年,世界卫生组织推荐采用硝酸还原酶试验(nitrate reductase assay,NRA)筛查疑似MDR-MTB感染患者,NRA比常规APM更快捷,较MGIT 960法和分子线性探针技术成本低[5]。NRA通常是在传统的罗氏培养基进行[6-7],也可在液体培养基中进行[8]。有研究发现,采用液体培养基的NRA可快速检测MTB对利福平和异烟肼等一线抗结核药物的耐药性,结果可靠且成本低[9]。目前,采用液体培养基NRA检测MTB对二线抗结核药物耐药性的研究较少。本研究通过多中心数据,分析液体培养基NRA快速检测临床分离MDR-MTB和XDRMTB菌株对利福平、异烟肼、氧氟沙星、阿米卡星、卡那霉素和卷曲霉素的耐药性的性能。
1 材料和方法
1.1 研究对象
参与研究的实验室包括天津中医药大学第一附属医院检验科、江西省胸科医院结核病参考实验室、昆明医科大学第三附属医院检验科和上海市第一人民医院宝山分院临床微生物学实验室。收集4个实验室2009年1月—2011年12月临床分离MTB菌株,从中随机选取730株(4个实验室分别为158、119、253、200株)进行检测。
本研究分为3个阶段进行。第1阶段确定每种药物的最小抑菌浓度(minimum inhibitory concentration,MIC)范围,共对206株临床分离MTB[108株MDR-MTB(4个实验室分别为23、18、37、30株)、20株完全敏感菌株(4个实验室各5株)、78株对至少1种受试药物耐药的非MDR-MTB菌株(4个实验室分别为16、12、27、23株)]进行检测,质控菌株MTB H37Rv菌株(ATCC 27294)购自美国菌种保藏中心。第2阶段根据第1阶段确定的MIC,每种药物选取3个测试浓度(MIC和MIC上下各1个浓度梯度),在4个实验室对50株MTB菌株[26株MDR-MTB(包括8株XDR-MTB),6株完全敏感菌株,18株对至少1种受试药物耐药的非MDR-MTB]进行盲测,将检测结果与APM或MGIT 960法结果进行比较。第3阶段,采用第2阶段确定的临界浓度检测730株MTB,比较3种方法药物敏感性试验结果。所有临床分离菌株均在罗氏培养基上进行新鲜传代培养,所有实验室检测人员均具有NRA的操作经验,或曾接受过相关培训。
1.2 方法
1.2.1 液体培养基NRA法 液体培养基NRA法按照ADIKARAM等[8]的描述进行。使用Middlebrook 7H9肉汤基质和0.31%甘油、10%油性白蛋白-葡萄糖-过氧化氢酶(美国BD公司),以及0.1%硝酸盐(美国Sigma公司)制备NRA液体培养基。第1阶段使用的药物浓度为:利福平4~0.125 mg/L、异烟肼0.8~0.025 mg/L、氧氟沙星8~0.25 mg/L、阿米卡星8~0.25 mg/L、卡那霉素20~0.62 mg/L、卷曲霉素20~0.62 mg/L。第2阶段使用的药物浓度为:利福平0.5、1和2 mg/L,异烟肼0.1、0.2和0.4 mg/L,氧氟沙星1、2和4 mg/L,阿米卡星2、4和8 mg/L,卡那霉素2.5、5和10 mg/L,卷曲霉素2.5、5和10 mg/L。第3阶段使用的药物浓度为:利福平1 mg/L、异烟肼0.2 mg/L、氧氟沙星2 mg/L、阿米卡星2 mg/L、卡那霉素5 mg /L、卷曲霉素2.5 mg/L。每种含药物的培养管均接种100 μL 1.0麦氏浊度菌悬液,对照培养管中接种100 μL 1∶10稀释的相同的菌悬液,将培养管置于37 ℃培养箱孵育。7 d后,向其中1支对照培养管中加入0.5 mL新鲜配制的Griess显色试剂(将50%盐酸、0.2%磺胺、0.1%N-1-萘基乙二胺盐酸盐按照1∶2∶2的比例混匀)。如果在对照培养管中观察到颜色变化,则将Griess显色试剂添加到所有含药物的培养管中;如果没有颜色变化,则将培养管重新放入培养箱继续孵育,在第14天重复该过程,如果需要,在第21天重复该过程。如果含药培养管中所显示的粉红色与1∶10稀释对照培养管中的粉红色相同或颜色更深,则认为该菌株具有抗性;如果1∶10稀释对照培养管颜色发生变化,而含药培养管在孵育21 d后颜色仍未发生变化,则认为该菌株对抗菌药物敏感。以从高浓度至低浓度6个药物浓度含药培养管中无颜色变化的培养管的药物浓度为MIC。在4个实验室中确定每种药物的临界浓度与参考方法进行比较的结果,将确定的临界浓度作为每种药物判断敏感或耐药的折点。在更换药物和试剂批号时,应使用1株完全敏感菌株和1株MDR-MTB菌株进行质控试验,以验证培养基是否正确,配置试验操作是否正确。细菌污染可能会导致假阳性结果,为确保培养基中没有污染,使用液体培养基前,在绵羊血琼脂平板上划线培养,以排除其他细菌生长。NRA的结果解读应是在未知参考方法药物敏感性试验结果的情况下进行,避免干扰对颜色的主观判读。
1.2.2 APM体外药物敏感性试验 用罗氏培养斜面上的MTB菌落制备菌悬液,通过APM进行间接药物敏感性试验。根据世界卫生组织指南推荐的标准比例法,在7H10琼脂上进行APM检测,临界浓度为:利福平1 mg/L、异烟肼0.2 mg/L、氧氟沙星2 mg/L、卡那霉素5 mg/L、卷曲霉素10 mg/L[10]。
1.2.3 MGIT 960法药物敏感性试验 世界卫生组织建议MGIT 960法仅适用于阿米卡星药物敏感性试验,本研究根据说明书要求进行检测,阿米卡星的MGIT 960法临界浓度为1 μg/mL。
1.2.4 差异的解决 如果NRA与APM或MGIT 960法结果不一致,则进行重复检测。如重复检测后结果仍不一致,则对每种特定药物的耐药基因进行测序,重新计算NRA对每种药物的灵敏度和特异性,并定义为“修正后”。
1.2.5 聚合酶链反应(polymerase chain reaction,PCR)和测序 对于NRA与APM或MGIT 960法不一致的结果,参考文献[11-12]对已知的耐药基因rpoB(利福平);inhA、katG、ahpC(异烟肼);gyrA、gyrB(氧氟沙星);rrs(阿米卡星、卡那霉素、卷曲霉素);eis(卡那霉素)和tlyA(卷曲霉素)进行测序。使用十六烷基三甲基溴化铵氯化钠溶液进行核酸提取[13]。基因测序由北京基因组研究所完成,使用Clonemanager软件进行测序结果分析。
1.3 统计学方法
采用SPSS 17.0软件进行统计分析。以APM或MGIT 960法为参考方法评估NRA法的敏感性、特异性和准确性,计算菌株NRA检测阳性所需的时间。
2 结果
2.1 第1阶段结果
用液体培养基NRA检测了206株临床分离的MTB,结果显示NRA法与APM或MGIT 960法MIC具有很高的一致性。NRA检测6种药物的MIC分别为:利福平1 mg/L、异烟肼0.2 mg/L、氧氟沙星2 mg/L、阿米卡星4 mg/L、卷曲霉素5 mg/L、卡那霉素5 mg/L。
(1)利福平耐药性检测有3个不一致的结果。NRA得到的MIC值为0.5 mg/L,判定为敏感;而APM法判定为耐药。rpoB基因测序结果表明,有2株分离株存在与利福平耐药性相关的突变位点(S531L、D516Y)。因此,这2株菌株被判定为耐药。本研究根据测序结果重新计算了修正后NRA的敏感性、特异性和准确性,得到NRA检测利福平耐药性的敏感性和特异性分别为98.7%和100.0%。见表1。
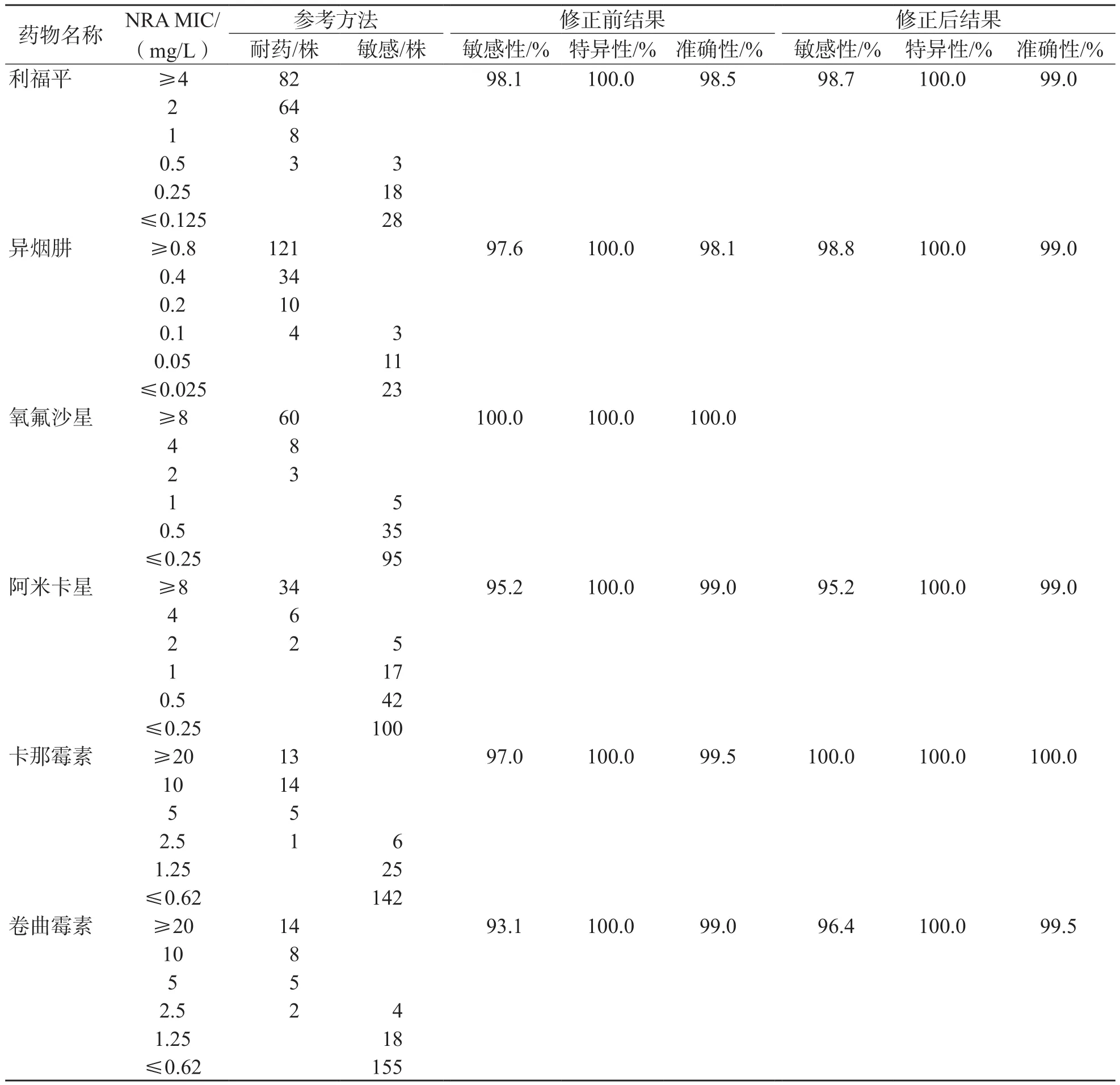
表1 第1阶段药物敏感性试验结果
(2)异烟肼耐药性检测有4个不一致的结果。NRA得到的MIC值为0.1 mg/L,判定为敏感;而APM法判定为耐药,katG、inhA和ahpC测序结果显示,有2株分离株基因组中仅含有katG突变,其相应的氨基酸突变为S315T。因此,修正后的NRA检测异烟肼耐药性的敏感性和特异性分别为98.8%和100.0%。见表1。
(3)氧氟沙星耐药性检测结果显示,NRA与APM法的一致性为100%。
(4)阿米卡星耐药性检测有2个不一致的结果。NRA得到的MIC值为2 mg/L,判定为敏感;而MGIT 960法判定为耐药。rrs基因测序结果显示,有2株分离株基因组中含有与阿米卡星耐药相关的突变(A1401G)。因此,修正后的NRA检测阿米卡星耐药性的敏感性和特异性分别为95.2%和100.0%。见表1。
(5)卡那霉素耐药性检测有1个不一致结果。NRA得到的MIC值为2.5 mg/L,判定为敏感;而APM判定为耐药;rrs或eis测序结果显示,rrs和eis基因组中没有任何突变。
(6)卷曲霉素耐药性检测有2个不一致的结果。NRA得到的MIC值为2.5 mg/L,判定为敏感;而APM判定为耐药,rrs基因测序结果表明,其中1株菌株的基因组中含有A1401G突变。因此,修正后的NRA检测卷曲霉素耐药性的敏感性和特异性分别为96.4%和100.0%。见表1。
2.2 第2阶段结果
利福平临界浓度为1 mg/L时结果最一致,总准确性为98.0%;异烟肼临界浓度为0.2 mg/L时结果最一致,总准确度为98.5%;氧氟沙星临界浓度为2 mg/L时结果最一致,总准确性为98.5%;阿米卡星临界浓度为2 mg/L时结果最一致,总准确性为97.5%;卡那霉素临界浓度为5 mg/L时结果最一致,总准确性为97.5%;卷曲霉素临界浓度为2.5 mg/L时结果最一致,总准确性为97.0%;见表2。4个实验室检测6种药物的敏感性、特异性、准确性见表3。
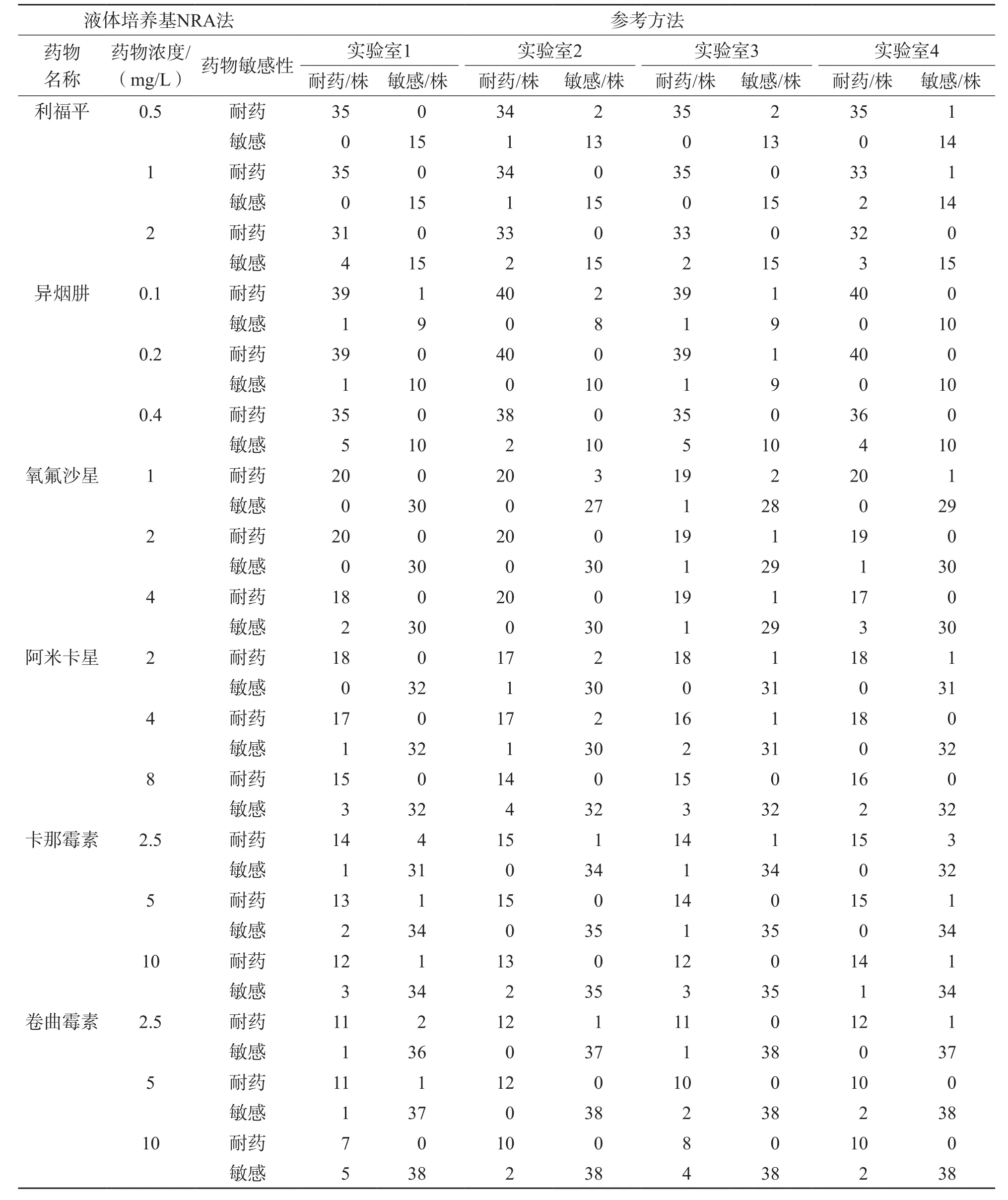
表2 确定6种药物临界浓度

表3 4个实验室检测6种药物的敏感性、特异性和准确性
2.3 第3阶段结果
采用第2阶段确定的临界浓度检测730株MTB临床分离株。4个实验室采用液体培养基NRA法与参考方法进行体外药物敏感性试验结果。结果显示,利福平耐药性检测准确性为97.0%~100.0%,总准确性为98.4%;异烟肼准确性为96.8%~99.2%,总准确性为98.1%;氧氟沙星准确性为98%~100%,总准确性为98.8%;阿米卡星准确性为96.8%~98.5%,总准确性为97.9%;卡那霉素准确性为96.4%~99.5%,总准确性为97.9%;卷曲霉素准确性为96.8%~100.0%,总准确性为98.2%;见表5。NRA、APM和MGIT 960法结果不一致的菌株的测序结果见表6。

表4 4个实验室液体培养基NRA与参考方法药物敏感性试验结果 株
2.4 样本周转时间(turn-around time,TAT)及污染率
NRA检测的中位时间为7 d,APM为21 d(P<0.001)。在第3阶段,采用NRA,76.2%(556/730)的MTB 7 d便可得到结果;采用APM,5.2%(38/730)的MTB 21 d才能得到结果。液体培养基没有细菌或真菌的污染,7H10琼脂中有5个样品污染,MGIT 960法培养基有8个样品污染。
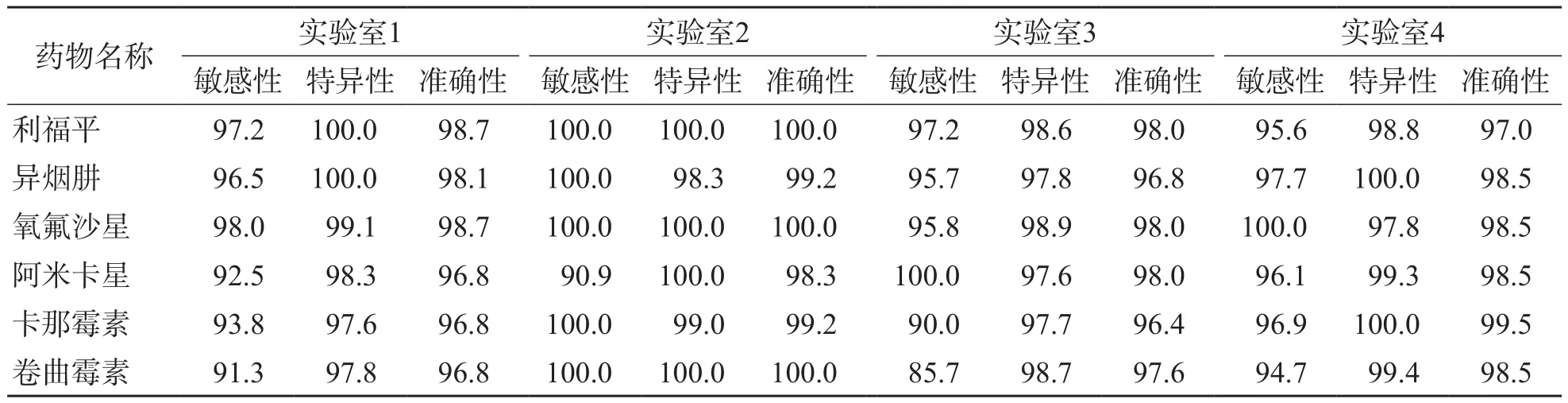
表5 4个实验室液体培养基NRA检测6种药物的敏感性、特异性及准确性 %

表6 第3阶段药物敏感性试验结果不一致菌株基因测序结果
3 讨论
本研究的目的是确定液体培养基NRA检测一线和二线抗结核药物的临界浓度,并通过多中心数据评估液体培养基NRA的检测性能。
首先,本研究确定了液体培养基NRA检测6种临床常用的抗结核药物的MIC值,根据MIC值确定NRA检测每种药物的临界浓度。本研究结果显示,NRA得到的6种药物的临界浓度与MGIT 960法得到的结果[10]相似(表7)。本研究结果显示,采用液体培养基NRA时,利福平的临界浓度为1 mg/L、氧氟沙星和阿米卡星的临界浓度为2 mg/L、卡那霉素的临界浓度为5 mg/L、卷曲霉素的临界浓度为2.5 mg/L。为验证本研究确定的临界浓度,4个实验室共进行了1 200次检测,只有13个(1.1%)假敏感结果和13个(1.1%)假耐药结果,证实了相关研究[8-14]确定的利福平临界浓度为1 mg/L,氧氟沙星临界浓度为2 mg/L的适用性。

表7 液体培养基NRA法确定的MIC和最终临界浓度与MGIT 960法比较 mg/L
在第3阶段,本研究进行了多中心前瞻性评估,采用第2阶段确定的临界浓度,通过对6种药物的耐药性结果检测评估液体培养基NRA同时检测MDR-MTB和XDR-MTB的性能,结果显示,NRA与参考方法(APM或MGIT 960法)结果一致性较高。对于不一致的结果,通过NRA、APM或MGIT 960法进行重复检测来确认;对于重复检测后仍然不一致的结果,对基因组中已知耐药相关基因进行测序,为表型检测的正确性或可靠性判断提供了间接证据,结果显示,在45个不一致的结果中,有11个检测到阿米卡星、卡那霉素和卷曲霉素耐药最常见的突变rrsA1401G;而对于氧氟沙星的耐药性,本研究发现的最常见的gyrA突变位点是D94G,与相关报道一致[15]。
近年来,许多研究采用固体培养基NRA对二线抗结核药物进行体外药物敏感性试验,结果显示其具有很高的敏感性和特异性[7,15-17]。有研究发现,液体培养基NRA检测氧氟沙星的耐药性性能优异[14]。本研究中,液体培养基NRA检测利福平、异烟肼和二线抗结核药物耐药性的敏感性和特异性都非常好,其中检测利福平、异烟肼和氧氟沙星耐药性的敏感性与相关研究结果[9,14]一致。本研究通过多中心数据证实了液体培养基NRA可以筛查XDR-MTB感染。
体外药物敏感性试验的TAT对于制定合适的治疗方案非常重要。本研究结果显示,采用液体培养基NRA检测,有76%的样本在接种第7天即可获得结果,与传统的APM相比[18],时间显著缩短。NRA的TAT与MGIT 960法相似,但不需要昂贵的设备,成本较低。此外,液体培养基NRA检测较相关研究报道的LJ培养基也更快[19]。NRA需要反复打开培养管,易产生污染,但本研究中污染率为0,可能的原因为:(1)严格的人员培训,人员培训中除了操作技术部分,更注重生物安全及防止污染,为了保证操作一致,并防止污染,每次的操作人员均固定;(2)每次试验均在专用的生物安全柜(条件允许时采用BⅡ全排型生物安全柜)中进行,并在试验前采用75%乙醇擦拭1次,随后把所有试验所需的材料按清洁区和污染区分类放置于安全柜中的不同区域,试验过程中操作人员双手不再离开安全柜;(3)试验过程中使用灭菌耗材进行操作,可在红外线消毒器附近进行操作,如有污染发生,及时消毒并更换手套;(4)试验完成后再次用75%乙醇擦拭,并用紫外线照射30 min。目前,针对病原对某些药物(如利福平)的耐药性检测,有更快速的分子检测方法,但这些检测方法不能检测所有药物的耐药情况[20]。因此,NRA等表型检测方法为医疗资源有限的实验室(尤其是发展中国家的实验室)快速、准确、低成本地检测MDRMTB或XDR-MTB提供了一个非常可靠的选择。本研究尚存在一些不足,NRA需要多次加入显色剂才能最终判读结果;相对于APM和绝对浓度法,试验过程中需反复打开培养管,人工操作次数更多,根据国际生物安全准则,MTB的体外药物敏感性试验需要BSL-3设施,因此所有操作均应在生物安全柜内进行[18,21];NRA是通过目测判定颜色,存在一定的主观误差。
综上所述,液体培养基NRA具有检测速度更快、成本低(不需要特殊的设备或试剂)、易于操作等优点,在保证生物安全要求的条件下,可在医疗资源有限的实验室开展MTB一线和二线抗结核药物的体外药物敏感性试验。
