转录因子Foxp1 在TGF-β1 诱导的VSMC表型转化中的作用
2022-07-29蓝林辉王志维
蓝林辉 王志维
武汉大学人民医院心血管外科 湖北 武汉 430060
急性Stanford A 型主动脉夹层是一种十分危重的急性主动脉综合征疾病,尽管它能通过手术以及混合血管内技术进行治疗,但是死亡率和发病率仍然 很 高[1]。主 动 脉 平 滑 肌 细 胞(vascular smooth muscle cell,VSMC)在维持血管结构中起关键作用,是心血管系统的重要组成部分,其表型转化与主动脉夹层的进展关系密切;转化生长因子(transforming growth factor,TGF)-β1 已被证明能够诱导主动脉平滑肌表型转化,促进VSMC 的增殖迁移,从 而 使 收 缩 型VSMC 转 化 为 合 成 型VSMC[2]。有研究显示,TGF-β1 被测定为叉头框蛋白P1(forkhead box protein p1,Foxp1)在内皮细胞(ECs)中的直 接 下 游 靶 基 因,Foxp1 能 通 过 调 节TGF-β1 抑 制病理性心脏重塑[3];然而还未有相关实验对Foxp1在主动脉夹层中的作用进行研究,故本实验通过检测Foxp1 在主动脉夹层主动脉壁中的表达以及Foxp1 对TGF-β1 诱导的VSMC 表型转化的调控作用这两个方面来进行研究。
1 材料与方法
1.1 材料
1.1.1主动脉壁以及VSMC 的获取 主动脉标本分为正常组和夹层组;夹层组标本来自武汉大学人民医院2019 年6 月—2020 年6 月冻存的急性Stanford A 型主动脉夹层患者术中切除的升主动脉壁,随机选取10 例;正常组标本来自同期我院冻存的心脏移植捐赠者的升主动脉壁,随机选取5 例。VSMC 提取自原代大鼠主动脉血管平滑肌细胞。
1.1.2试 剂 TGF-β1(InvivoGen);Foxp1 质 粒(武汉科鹿生物科技有限公司);DMEM 高糖培养基(HyClone);胎牛血清(杭州天杭生物科技有限公司);PBS、青霉素-链霉素溶液(100×)(吉诺生物医药技术有限公司);胰酶-EDTA(吉诺生物医药技术有限公司);三氯甲烷、无水乙醇、异丙醇(国药集团化学试剂);Lipofectamine(ThermoFisher);GAPDH(ab181602)、α-SMA(ab124964)、SM22α(ab14106)、骨桥蛋白(OPN;ab63856)(Abcam);Foxp1(#4402)(CST);HRP-Goat anti Rabbit(AS1107)、HRPRabbit anti Goat(AS1108)、HRP - Goat anti Rat(AS1093)、HRP-Rabbit anti Sheep(AS1245)、BCA蛋白质浓度测定试剂盒(AS1086)、RIPA 总蛋白裂解液(AS1004)(ASPEN)。
1.2 方法
1.2.1大鼠主动脉血管平滑肌细胞原代培养 参考文献[4]方法进行VSMC 原代培养。无菌条件下迅速分离大鼠主动脉,分离过程中避免损伤食管与肺组织,将主动脉转移到培养皿中,PBS 清洗1 遍,无菌眼科镊剥离血管外膜,显微剪纵行剪开血管,眼科弯镊刮除血管内皮细胞。显微剪将中膜剪成1 mm³大小碎片,均匀铺平于6 cm²细胞培养皿,在培养箱放置30 min,使组织块紧贴皿底,加入5 mL 含20%胎牛血清的DMEM 高糖培养基,放入37 ℃和5%CO2培养箱中培养。每3 d 换液一次,当细胞生长达到亚融合状态(约80%融合)时,去除组织块,用0.25%胰酶消化细胞,进行传代培养,传代至3代后按照需要进行细胞干预及后续实验。
1.2.2Foxp1 质粒转染VSMC (1)转染前1 d,每孔(6 孔板)5×105细胞接种于2 mL 培养基中。(2)用250 μL Opti-MEM 无血清培养基将Plasmid 稀释至浓度50 nmol/L,室温下孵育5 min。(3)用250 μL Opti-MEM 无血清培养基稀释5 μL Lipofectamine 2000,室温下孵育5 min。(4)稀释的Plasmid 和Lipofectamine 2000 混合,室温下放置20 min。(5)将500 μL 转染液和1 500 μL 基础培养基加入每孔中。(6)37 ℃,5%CO2培养箱中培养,6 h 后换完全培养基。24 h 后使用倒置显微镜观察转染效果,将转染结果以图片记录。
1.2.3VSMC 不同处理 将体外培养的细胞(每孔1.5 mL)接种在6 孔板中,将细胞分为3 组。(1)+TGF-β1 组:VSMC 放入添加5 ng/mL TGFβ1 的 完 全 培 养 基 中 培 养24 h;(2)Foxp1 质 粒 组:VSMC 转染Foxp1 的重组质粒,完全培养基中培养24 h;(3)Foxp1 质 粒+TGF-β1 组:VSMC 转 染Foxp1 的重组质粒,放入添加5 ng/mLTGF-β1 的完全培养基中培养24 h。空白对照组:VSMC 不做特殊处理,完全培养基中培养24 h;每组设6 孔。
1.2.4RT-PCR 和Western Blot 检测 收集主动脉壁组织匀浆,RT-PCR 和Western Blot 方法检测其Foxp1、TGF-β1、α-SMA、SM22α、OPN 的mRNA和蛋白的表达情况;收集培养的各组细胞,RT-PCR和Western Blot 方 法 检 测 其Foxp1、α - SMA、SM22α、OPN 的表达情况。PCR 引物序列:Foxp1上游引物,5'-TCTACAGAACCCAAAGCTGCC-3',下 游 引 物,5'-TGTATTTGTCTGAGTACCGCCTG-3';TGF-β1 上 游 引 物,5'-GTGGCTGAACCAAGGAGACG-3',下 游 引 物,5'-AGGTGTTGAGCCCTTTCCAG-3';α-SMA 上 游 引 物,5'-AGCATCCGACCTTGCTAACG-3',下游引物,5'-CCAGAGTCCAGCACAATACCAG-3';SM22α上游引物,5'-CCCTCCATGGTCTTCAAGCA-3',下游引物,5'-GCCCAAAGCCATTACAGTCCT-3';OPN 上 游 引 物,5' - GATAGTGTTTTGGGCCCTGAG-3',下 游 引 物,5'-TCCTGTAAGTTTGCCTGCCTC-3'。
1.2.5统计学方法 计量资料以均数±标准差(±s)表示,应用独立样本t检验和单因素方差分析进行均值比较。通过SPSS 软件对数据进行分析,P<0.05 为差异有统计学意义。
2 结果
2.1 两组主动脉壁中Foxp1 mRNA 和蛋白的表达情况RT-PCR 和Western Blot 的检测结果显示,夹层组主动脉壁中Foxp1 的mRNA 和蛋白较正常组表达明显下调(均P<0.05),同时检测出TGFβ1、骨桥蛋白(OPN)的mRNA 和蛋白表达上调(均P<0.05),以及α-SMA、SM22α 的mRNA 和蛋白表达下调(均P<0.05)(图1)。
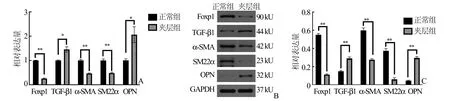
图1 RT-PCR 和Western Blot 检测两组主动脉壁中Foxp1、TGF-β1、α-SMA、SM22α 及OPN 的表达
2.2 Foxp1 质粒转染结果VSMC 转染Foxp1 的重组质粒24 h 后,将细胞放置在倒置显微镜下观察,镜下可见大量转染成功的细胞(图2)。

图2 倒置显微镜观察Foxp1 质粒转染结果(×200)
2.3 RT-PCR 检测各组细胞中Foxp1 以及VSMC表型标志物的mRNA 表达情况RT-PCR 检测结果显示,转染Foxp1 质粒的VSMC 于完全培养基培养24 h 后,Foxp1 的mRNA 表达水平较空白对照组显著上调(P<0.05);VSMC 放入添加5 ng/mL TGF-β1 的完全培养基中培养24 h 后,收缩型细胞标志物α-SMA、SM22α 的mRNA 表达水平较空白对照组显著下调,且合成型细胞标志物OPN 的mRNA 表达水平较空白组显著上调(均P<0.05);VSMC 转染Foxp1 的重组质粒,放入添加5 ng/mL TGF-β1 的完全培养基中培养24 h 后,其收缩型细胞标志物α-SMA、SM22α 的mRNA 表达水平较单独TGF-β1 处理组显著上调,且合成型细胞标志物OPN 的mRNA 表达水平较单独TGF-β1 处理组下调(均P<0.05)(图3)。
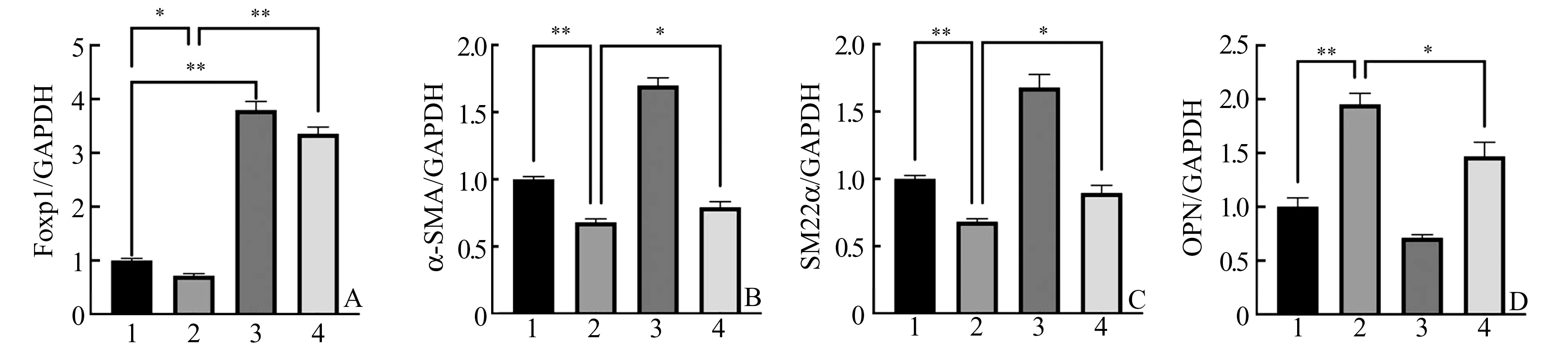
图3 Foxp1、α-SMA、SM22α 和OPN 在各组细胞中mRNA 的表达水平
2.4 Western Blot 检测各组细胞中Foxp1 以及VSMC 表型标志物的蛋白表达情况检测结果显示,转染Foxp1 质粒的VSMC 于完全培养基培养24 h 后,Foxp1 的蛋白表达水平较空白对照组显著上调(P<0.05);VSMC 放入添加5 ng/mL TGF-β1的完全培养基中培养24 h 后,收缩型细胞标志物α-SMA、SM22α 的蛋白表达水平较空白对照组显著下调,且合成型细胞标志物OPN 的蛋白表达水平较空白组显著上调(均P<0.05);VSMC 转染Foxp1的重组质粒,放入添加5 ng/mL TGF-β1 的完全培养基中培养24 h 后,其收缩型细胞标志物α-SMA、SM22α 的蛋白表达水平较单独TGF-β1 处理组显著上调,且合成型细胞标志物OPN 的蛋白表达水平较单独TGF-β1 处理组下调(均P<0.05)(图4)。

图4 Foxp1、α-SMA、SM22α和OPN在各组细胞中蛋白的表达水平
3 讨论
Foxp1 是Fox 家族的多结构域转录调控因子,基因位于染色体3p14.1 区域,长度628 kb,其特有的结构域包括一个发散的DNA 结合的有翼螺旋、亮氨酸拉链、锌指和多聚谷氨酸束[5]。Foxp1 广泛表达于血管、心肌和心内膜,并与心血管系统疾病发生发展有着密切关系[6]。以往对于Foxp1 的研究主要集中于肿瘤和免疫等方向,但近年来Foxp1 对于心血管系统的调控成为了一个新的热点,Foxp1已被证明参与了血管发育和生长的调控过程。研究表明,Foxp1 基因敲除可抑制斑马鱼血管平滑肌细胞的增殖并导致斑马鱼血管形成缺陷,提示了Foxp1 可能通过促进血管平滑肌细胞的增殖以调控血管生成[7]。另有研究显示,TGF-β1 为Foxp1 在血管内皮细胞中的直接下游靶基因,EC-Foxp1 能通过TGF-β1/内皮素-1 信号通路调节病理性心肌纤维化和心肌肥大,表明Foxp1 可以通过TGF-β1 调控心肌细胞的生物学行为[3]。
主动脉壁由外膜、中膜和内膜三层结构组成,其中膜的主要成分为VSMC,其主要作用为保持血管壁的结构完整、维持血管张力以及调节血管直径等[8];VSMC 有收缩和合成型两种表型,正常生理状态下,VSMC 以低速率增殖,保持其细胞特性并表达高水平的收缩蛋白;病理状态下,VSMC 失去其收缩特性并分化为合成表型,诱发主动脉瘤和夹层[9]。TGF-β1 是一种多效应细胞因子,调节多种生理过程,如细胞的增殖、分化、凋亡和迁移[10]。研究表明,TGF-β1 是VSMC 表型转化的主要驱动因子[9,11],应用TGF-β1 刺激人主动脉血管平滑肌细胞后可检测出α-SMA、SM22α 表达下调以及OPN 的表达上调,这提示VSMC 发生了表型转化。
本实验中,进行了大鼠主动脉血管平滑肌细胞的原代培养,将细胞转染Foxp1 的重组质粒,根据Zhu 等[12]实验结果,选择浓度为5 ng/mL 的TGF-β1加入完全培养基中培养细胞24 h,以促进细胞的表型转化。将细胞做不同处理后分为3 组,并设立空白对照组;采用RT-PCR 和Western Bolt 方法检测Foxp1 以及VSMC 表型转化的相关标志分子(α-SMA、SM22α、OPN)。检测结果显示:+TGFβ1 组中的α-SMA、SM22α 的mRNA 和蛋白表达量较空白对照组减少,OPN 的mRNA 和蛋白表达量较空白对照组增加,再次验证VSMC 在TGF-β1 刺激下可发生表型转化。与+TGF-β1 组相比,Foxp1质粒转染+TGF-β1 组α-SMA、SM22α 的mRNA 和蛋白表达量增加,OPN 的mRNA 和蛋白表达量减少;可见上调Foxp1 可以抑制TGF-β1 诱导VSMC表型转化。同时对主动脉标本的检测显示:在夹层组主动脉壁中Foxp1 的表达量较正常组明显下调,且TGF-β1 的表达量明显上调,提示了Foxp1 可能通过抑制TGF-β1 诱导的VSMC 表型转化,直接或间接参与了主动脉夹层的发生进展。
本实验表明Foxp1 可以抑制TGF-β1 诱导的VSMC 表型转化,可能参与主动脉中层退行性变导致主动脉夹层发生形成。针对Foxp1 对TGF-β1 的信号传导,可能对临床上主动脉夹层的治疗提供新的思路,然而Foxp1 与TGF-β1 信号通路之间的机制尚不明确,需进一步研究探讨。
