孕早期血清25羟维生素D水平对子痫前期的预测价值
2022-07-28李雪芹黎婷婷
李雪芹,黎婷婷,许 鹏
(重庆大学附属三峡医院妇产科,重庆 万州 404000)
子痫前期(pre-eclampsia,PE)是妊娠20周后孕妇出现高血压病并伴有蛋白尿,或不伴有蛋白尿但有心、肺、肝、肾等重要脏器或血液系统、消化系统、神经系统的异常,进而导致胎盘-胎儿受累等表现的疾病,是妊娠高血压疾病的常见类型[1-2]。有报道显示:在全世界范围内该病的发病率为2%~8%,国内发病率为1.92%,全世界每年约有6万孕产妇因PE而死亡[3]。目前对于该病的发病机制尚未完全明确,普遍认为可能与遗传、免疫耐受失衡、炎症反应、血管内皮损伤有关。维生素D状态的最佳生物标志物是血清25-羟基维生素D[25-hydroxy-vitamin D,25(OH)D],其代表钙和骨的代谢状态,并与体脂肪、血糖控制、脂质代谢和血压呈负相关。有调查显示国内80%的孕妇存在维生素D不足的情况,北方地区尤为严重[4-5]。越来越多的证据显示维生素D缺乏与妊娠期糖尿病、流产、早产、妊娠期高血压疾病等不良妊娠结局的发生相关[6]。虽然有研究证实孕早期及孕中晚期25(OH)D水平均与PE发生相关[7],但关于孕早期25(OH)D水平能否作为PE的预测指标目前尚无定论,因此本研究旨在通过分析孕早期25(OH)D水平对PE的预测价值,以期为该病的早期预测提供参考依据。
1资料与方法
1.1一般资料
选择2018年2月至2020年1月在重庆大学附属三峡医院进行产前检查的1 086例孕妇进行研究,孕妇均知情同意,本研究已通过医院伦理审查。纳入标准:①孕周在8~13+6周的单胎产妇;②在我院定期产检;③行25(OH)D检测;④在我市居住2年以上;⑤年龄在35岁以下,身体质量指数(BMI)<24kg/m2;⑥神志清醒,可配合进行相关检查。排除标准:①经产妇;②妊娠期合并高血压、风湿免疫系统疾病者;③妊娠期糖尿病患者;④在25(OH)D检测前未补充维生素D。参照《妊娠期高血压疾病诊治指南(2015)》[8]中PE的相关诊断标准,共有75例孕妇被诊断为PE,作为观察组,在剩余的1 011例健康孕妇中根据年龄(±1岁)、末次月经时间(±2周)按1∶2的原则进行匹配,选择150例健康孕妇作为对照组。
1.2方法
①25(OH)D水平检测方法:在孕8~13+6周抽取调查对象空腹外周静脉血2mL,以3 000r/min离心15min后分离血清,采用电化学发光免疫法对孕妇25(OH)D水平进行检测,试剂盒购于德国罗氏诊断试剂有限公司,操作均由专业人员严格按试剂盒说明进行。②根据孕20周后孕妇的血压及实验室检查结果将观察组分为轻度PE组和重度PE组。其中血压≥140/90mmHg、尿蛋白≥0.3g/24h或随机尿蛋白(+)者为轻度PE;血压≥160/110mmHg、尿蛋白≥2.0g/24h或随机尿蛋白(++),血清肌酐>106μmol/L,血小板<100×109L为重度PE[8]。
1.3统计学方法
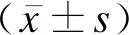
2结果
2.1观察组和对照组孕妇一般情况及25(OH)D水平比较
观察组和对照组孕妇的年龄、入组时孕周及BMI差异均无统计学意义(P>0.05)。观察组孕妇的收缩压、舒张压、24h尿蛋白定量均高于对照组,25(OH)D水平低于对照组(P<0.05),见表1。

表1 观察组和对照组孕妇一般情况及25(OH)D水平比较
2.2轻度PE组和重度PE组患者一般情况及25(OH)D水平比较
轻度PE组、重度PE组患者的年龄、入组时孕周及BMI差异均无统计学意义(P>0.05)。重度PE组患者的收缩压、舒张压、24h尿蛋白定量均高于轻度PE组,25(OH)D水平低于轻度PE组(P<0.05),见表2。

表2 轻度PE组和重度PE组患者一般情况及25(OH)D水平比较
2.3 PE患者25(OH)D水平与血压、24h尿蛋白定量的相关性分析
PE患者的25(OH)D水平与血压、24h尿蛋白定量的相关性分析结果显示:25(OH)D水平与血压、24h尿蛋白定量均呈显著负相关关系(r值分别为-0.618、-0.753、-0.624,P<0.05),见表3。

表3 PE患者的25(OH)D水平与血压、24h尿蛋白定量
2.4 25(OH)D水平对PE预测价值的ROC分析
ROC曲线显示,25(OH)D水平预测PE的截断值为24.03μg/L,敏感度为88.0%,特异性为82.0%,曲线下面积(area under the cure,AUC)为0.864,95%CI为0.811~0.916,P<0.05,见图1。
3讨论
3.1孕早期预测PE的价值
PE是临床上常见的妊娠期并发症,目前关于PE的发病机制有多种假说,其中两阶段假说较完整地解释了PE的发生、发展过程,该假说将PE分为临床前期与临床期,临床前期主要是由于遗传、环境等因素导致胎盘浅着床,但此时孕妇尚无任何临床表现;临床期则是因为胎盘血流灌注量下降导致胎盘的缺血缺氧,引起大量胎盘因子释放进入母体血液循环中,导致孕妇出现炎症反应、内皮损伤而引起PE的各种临床症状[9-10]。目前临床上多根据孕妇在孕20周后的临床表现对PE进行诊断,若能在孕早期进行预测并针对性地采取干预措施将有助于降低PE的发生率。
3.2孕早期25(OH)D水平下降对PE的影响
维生素D是脂溶性维生素的一种,主要以维生素D2、D3的形式存在,维生素D2主要存在于植物体内,维生素D3则主要存在于高级动物中,由皮肤中7-脱羟胆固醇经紫外线照射转化而来或由食物中获取[11]。维生素D3本身无活性,经二次羟基化后可产生25(OH)D,多项研究证实25(OH)D在调节钙磷代谢、骨质矿化方面具有重要的作用,另外25(OH)D还参与免疫调控、细胞增殖等过程[12]。本研究结果显示观察组孕妇的25(OH)D水平低于对照组且25(OH)D水平随着PE严重程度的加重而降低,与相关研究结果一致[13]。在妊娠过程中随着胎儿的生长发育,其对钙的需求量也明显增加,可导致母体出现一系列的代偿性生理活动以促进母体对食物中钙离子的吸收并向胎盘转运,此过程可引起母体中25(OH)D水平下降。正常状况下,孕早期滋养层细胞胎盘中可通过局部作用及旁分泌作用而储存25(OH)D,25(OH)D并与维生素D受体结合后作用于血管内皮生长因子(vascular endothelial growth factor,VEGF)启动子,从而增加血管内皮细胞VEGF的表达。当25(OH)D水平下降时可导致VEGF合成量较少,影响了子宫螺旋动脉的重铸而引起胎盘浅着床,最终引起PE[14]。
3.3 PE患者25(OH)D水平与血压、24h尿蛋白定量的相关性
相关性分析结果显示: PE患者的25(OH)D水平与血压、24h尿蛋白定量均呈显著负相关关系(P<0.05)。关于25(OH)D水平对PE患者血压的影响可能与以下几方面因素有关[15-16]:①25(OH)D可抑制肾上腺素基因的转录,对肾素-血管紧张素系统起负反馈调节作用,当25(OH)D水平下降可使肾素-血管紧张素分泌增加而引起病理性的血压升高;②25(OH)D水平的大幅度下降还可引起继发性甲状腺功能亢进,导致甲状旁腺激素水平的升高而增强血管平滑肌的紧张性,引起动脉粥样硬化而升高血压;③25(OH)D缺乏还与胰岛素抵抗及代谢综合征的发生密切相关,当25(OH)D水平明显下降时可导致胰岛素抵抗增强而引起血压升高。24h尿蛋白定量是PE患者肾功能损害的检测指标,关于25(OH)D水平对PE患者24h尿蛋白定量的影响机制可能与25(OH)D可修补Ca2+依赖性K+通道而调节肾素-血管紧张素系统,PE患者的肾损害与局部肾素-血管紧张素系统密切相关。25(OH)D缺乏还可引起肾小管局部血管紧张素Ⅱ水平升高而导致肾间质纤维增生等后续效应,使肾小管的重吸收作用受损[17]。另外,25(OH)D水平下降还可加速动脉粥样硬化而累及肾脏组织,可引起肾小球前血管结构及功能出现异常而影响其滤过功能,使尿蛋白量升高[18]。
3.4 25(OH)D水平对PE的预测价值
25(OH)D水平预测PE的截断值为24.03μg/L,敏感度为88.0%,特异性为82.0%,AUC为0.864,95%CI为0.811~0.916(P<0.05),提示孕早期25(OH)D水平预测PE具有较高的敏感性与特异性。25(OH)D对PE的影响除前文阐述的机制外,还可能与以下几方面原因有关[19-20]:①25(OH)D缺乏一方面可引起氧化应激反应而使血管内皮细胞受累,另外还可通过减少维生素D受体及1-α羟化酶等分子机制,引起血管内皮功能受损,最终导致PE;②25(OH)D还直接或间接地参与细胞增殖、分化,当维生素D受体减少时,25(OH)D调控HOA 10等着床相关靶基因的表达减少,维生素D的免疫抑制作用受限导致细胞移植耐受作用减弱而增加PE发生的风险;③分子遗传学研究发现维生素D受体基因rs 2228570多态性与PE的发生风险具有较高的相关性,该多态性位点是维生素D受体基因的起始密码子,此位点发生改变则可引起维生素D受体基因翻译起始点的改变从而影响其结构的改变,这将影响25(OH)D的正常生物学效应而增加PE的发生风险。
综上所述,PE患者孕早期25(OH)D水平低于健康产妇,且25(OH)D水平随着PE程度的增加而降低,PE患者的25(OH)D水平与其血压、24h尿蛋白定量均呈负相关关系,孕早期25(OH)D预测PE的截断值为24.03μg/L。
