未足月胎膜早破早发性新生儿感染与血小板-淋巴细胞比值的关系分析
2022-07-27翟景梅
翟景梅
(安阳市妇幼保健院,河南 安阳 455000)
新生儿早发性感染表现为短暂的烦躁不安、哭声无力,且24 h内体温并无较大波动,并无明显特异临床表现,难以与其他疾病鉴别。其中早产儿合并感染较为足月儿多见,约75%~85%为自发性早产,其中约50%为未足月胎膜早破(Preterm premature rupture of the membranes,PPROM)所致[1],及时评估病情变化是PPROM新生儿感染治疗的关键。血培养是诊断败血症的“金标准”,耗时常长、易受抗菌药干扰,阳性率低,血浆中炎性相关细胞的比值或许能为疾病诊断提供参考。血小板-淋巴细胞比值(PLR)、中性粒细胞-淋巴细胞比值(NLR)是机体炎症指标,可提示重症感染[2]。目前有关PLR、NLR对新生儿感染病情评估研究较少,本研究回顾性分析早产儿临床资料,探究PLR、NLR对新生儿感染的评估价值。
1 资料与方法
1.1 一般资料
选择2018年3月~2020年3月出生后6 h内收入新生儿病房的合并宫内感染高危因素的PPROM早产儿114例,男68例、女46例。感染组52例、非感染组62例。感染组根据结局分死亡组2例,存活组50例。感染组包括:肺炎38例、肺炎合并ARDS 8例、败血症4例、脑膜炎1例、尿路感染1例。入选标准:腹泻、PROM≥18 h、子宫触痛、羊水浑浊、气味难闻、母亲妊娠晚期体温>38.5℃、母亲B族链球菌寄生、分娩期应用抗菌药物[3]。排除标准;母胎血型不合;合并染色体疾病;经检测显示有代谢性疾病;采血时出生超24 h;临床资料不全。
1.2 方法
据感染结局分感染组52例、非感染组62例;据感染组临床结局分死亡组2例、存活组50例。
1.3 观察指标
收集所有入组新生儿PLR、NLR、白细胞计数(WBC)、白蛋白(ALB)数值。
1.4 统计学方法
2 结果
2.1 感染组、非感染组比较(见表1)

表1 感染组、非感染组实验室指标比较
2.2 死亡组、存活组比较(见表2)

表2 死亡组、存活组实验室指标比较
2.3 PLR、NLR与新生儿感染相关性(见表3)
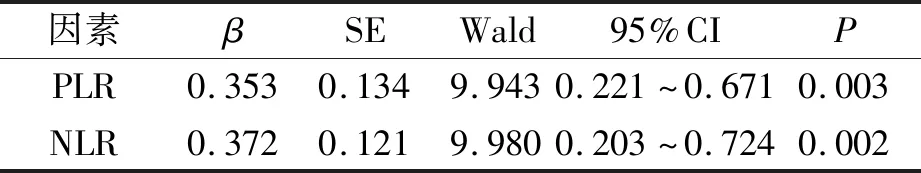
表3 Cox多因素分析
3 讨论
PPROM病因较多,但临床上较为常见的是细菌感染所致。感染后可导致致胎膜破裂,引发机体炎症反应,还可诱发子宫收缩,导致早产,继而导致新生儿感染发生。儿科医师可通过实验室检查及临床经验予以抗生素治疗,但早产儿体质娇弱、各大系统发育不成熟,因败血症而导致死亡的风险依旧较高,且存活患儿可留有后遗症,尤其是破膜孕周越小,患儿预后越差[3]。PPROM患者破膜前病情较隐匿,只能借助炎症指标、临床症状等评估处理,破膜超12 h用抗生素预防感染。
因预防性应用抗生素可造成假阴性,而CRP、PCT等检查可提高其检出率,但特异性较低,创伤、外科术后CRP、PCT均可升高,与感染无关[2-4]。PLR、NLR是炎症指标,已有多项研究指出其与肿瘤预后具有相关性,同时有研究指出,PLR、NLR增高可作为PPROM发生发展的有效指标,但PLR、NLR与PPROM新生儿感染相关性的研究较少[1,3]。本研究结果显示感染组WBC、ALB水平低于非感染组,死亡组ALB水平低于存活组。WBC是新生儿感染常用指标,但正常参考值范围较宽,不能提供相对敏感的感染信息[2]。感染后内毒素刺激肝非实质细胞产生炎性介质,抑制ALB mRNA表达,在重症感染儿中尤为明显。因此,ALB也可用作感染指标。但早产儿胎龄小,肝脏发育不完善,对于蛋白合成也有影响,因此诊断PPROM早发性新生儿感染证据不够充分。本研究显示感染组PLR、NLR水平高于非感染组,死亡组PLR水平高于存活组,同时相关性分析证实PLR、NLR是PPROM早发性新生儿感染的独立影响因素。PLR评估新生儿感染可能与血小板作用有关,感染后血小板可促进纤维蛋白在炎性分子周围聚集,避免其被免疫细胞消灭。NLR评估感染可能与中性粒细胞免疫功能有关,感染后,中性粒细胞被激活,并分泌其他生物活性因子,达到抗炎作用。炎症反应可抑制淋巴细胞增殖,淋巴细胞、血小板、中性粒细胞可表示炎症反应与机体免疫间的平衡状态,感染患儿PLR、NLR水平均较高。PLR、NLR作为PPROM新生儿早发性感染指标虽具有较强操作性,但二者同样受其他干扰因素影响[3,4],可造成检测结果不准确等问题。本研究中死亡组、存活组NLR水平无明显差异,可能与样本量过少有关,后续可扩大数据行进一步分析。
综上所述,PLR、NLR与PPROM早发性新生儿感染具有较强相关性,但单独作为检测指标具有一定局限性,可与其他指标共同应用,为患儿临床诊断及预后评估提供参考。
