巨噬细胞缺氧/复氧及M2型极化对小鼠心肌细胞凋亡的影响及机制
2022-07-27索森森李爱琴原玲玲李世朋毋领娟柴文文宰娇娇
索森森,李爱琴,原玲玲,李世朋,毋领娟,柴文文,宰娇娇,郭 鹏
(焦作市人民医院心内科,河南 焦作 454000)
缺血性心脏病主要表现为急性ST段抬高型心肌梗死,是冠状动脉粥样硬化性心脏病最严重的类型之一,在世界范围内呈现出高病死率和高致残率的特点[1]。缺血再灌注(ischemia reperfusion,IR)可对心肌细胞造成不可逆的损伤,即心肌IR损伤[2]。目前,心肌IR损伤的确切病理生理学机制仍不清楚。心肌梗死后梗死区域有明显的白细胞浸润,心肌梗死后1 h白细胞即可释放促炎细胞因子如肿瘤坏死因子(tumor necrosis factor,TNF)-α、白细胞介素(interleukin,IL)-1β和IL-6,3~5 d后炎症反应转变为抗炎修复反应[3]。在心肌梗死早期,虽然炎症反应可发挥抗心肌损伤的作用,但长期的炎症反应可能会通过促进左心室扩张和过度瘢痕形成而损害左心室的收缩与舒张功能[4]。因此,及时纠正促炎与抗炎失衡是保护心肌梗死后心肌细胞的关键。巨噬细胞作为机体重要的免疫细胞,在不同微环境中可被诱导极化为促炎型(M1表型)和抗炎型(M2表型)巨噬细胞,发挥损害/保护心肌细胞作用,决定着炎症的发生发展方向[5]。有研究发现,IL-10可诱导巨噬细胞向M2表型极化,抑制炎症反应,促进组织修复、重塑、血管生成及稳定内环境[6-7]。基于此,本研究通过缺氧/复氧处理巨噬细胞模拟心肌IR损伤的发生环境,探讨心肌IR损伤环境下IL-10所诱导的巨噬细胞M2表型极化对心肌细胞凋亡的影响及机制。
1 材料与方法
1.1 细胞小鼠巨噬细胞和小鼠心肌细胞均由上海交通大学医学院附属新华医院实验室提供。
1.2 主要试剂与仪器达尔伯克改良伊格尔培养基(Dulbecco′s modified Eagle medium,DMEM)、磷酸盐缓冲液(phosphate buffered solation,PBS)、胎牛血清(fetal bovine serum,FBS)、胰蛋白酶、TRIzol试剂盒、反转录试剂盒均购自中国上海赛默飞世尔科技公司;IL-1β、TNF-α、IL-10、转化生长因子 (transforming growth factor,TGF)-β酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测试剂盒购自中国上海拜力生物科技有限公司,人膜联蛋白V-异硫氰酸荧光素(annexin V-fluorescein isothiocyanate,Annexin V-FITC)细胞凋亡检测试剂盒购自上海碧迪医疗器械有限公司;酶标仪购自上海赛默飞世尔科技公司,实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)仪购自上海拜力生物科技有限公司,流式细胞仪购自美国贝克曼公司。本实验所用引物均由生工生物工程(上海)股份有限公司合成。
1.3 细胞培养与分组小鼠巨噬细胞和小鼠心肌细胞均培养于含体积分数10%胎牛血清、体积分数1%青链霉素双抗的DMEM中。根据培养条件,将小鼠巨噬细胞分为对照组(A组)、缺氧/复氧组(B组)、IL-10组(C组),将小鼠心肌细胞分为对照组(D组)、缺氧/复氧组(E组)、缺氧/复氧+IL-10组(F组)。
A组巨噬细胞培养于含体积分数21%O2、体积分数5% CO2的37 ℃恒温培养箱中;B组巨噬细胞培养于含体积分数3%~5%O2、体积分数5% CO2的37 ℃恒温培养箱中;A组和B组巨噬细胞培养24 h后置于含体积分数21%O2、体积分数5% CO2的37 ℃恒温培养箱中继续培养6 h,然后分别倒出A组和B组巨噬细胞上层培养基,1 000 r·min-1离心3 min,取上清液和细胞备用。C组巨噬细胞于含体积分数21%O2、体积分数5% CO2的37 ℃恒温培养箱中培养18 h后,使用含终质量浓度 50 mg·L-1IL-10 新鲜完全培养基培养6 h,然后收集培养基上清液和细胞备用[7]。
小鼠心肌细胞培养于含体积分数21%O2、体积分数5% CO2的37 ℃恒温细胞培养箱中;将A组培养基上清液和新鲜完全培养基等体积混合培养D组心肌细胞,将B组培养基上清液和新鲜完全培养基等体积混合培养E组心肌细胞,将B组和C组培养基上清液等体积混合培养F组心肌细胞。
1.4 实时荧光定量PCR法检测各组巨噬细胞中诱导性一氧化氮合酶(inducible nitric oxide synthase,iNOS)、CD86、精氨酸酶-1(arginase-1,Arg-1)、CD206 mRNA相对表达量取制备好的A组、B组和C组巨噬细胞,根据TRIzol试剂盒说明书提取总RNA。取1 μg总RNA反转录为cDNA,按照反转录试剂盒中说明书进行操作。将cDNA作为模板进行实时荧光定量PCR,反应体系20 μL:TB Green Premix Ex Taq 10.0 μL,上下游引物各0.4 μL,ROX Reference Dye 0.4 μL,cDNA 2.0 μL,ddH2O 6.8 μL。反应条件:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,72 ℃延伸60 s,共行40个循环。甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)上游引物序列为5′-AGGTCGGTGTGAACGGATTTG-3′,下游引物序列为5′-TGTAGACCATGTAGTTGAGG-3′;iNOS上游引物序列为5′-AACAGGGAGAAAGCGCAAAA-3′,下游引物序列为5′-CCTCACATACTGTGGACGGG-3′;CD86上游引物序列为5′-ACTTACGGAAGCACCCACGTG-3′,下游引物序列为5′-TTGTAAATGGGCACGGCAGA-3′;Arg-1上游引物序列为5′-AGCCAGGGACTGACTACCTTA-3′,下游引物序列为5′-TTGGGAGGAGAAGGCGTTTGT-3′;CD206上游引物序列为5′-AGTCAGAACAGACTGCGTGGA-3′,下游引物序列为5′-CCAGAGGGATCGCCTGTTCTG-3′。以GAPDH为内参,采用2-ΔΔCt法计算各目的基因相对表达量。实验重复3次,取均值。
1.5 ELISA法检测巨噬细胞的培养基上清液中IL-1β、TNF-α、IL-10、TGF-β蛋白相对表达量使用IL-1β、TNF-α、IL-10、TGF-β ELISA检测试剂盒和酶标仪检测A组、B组、C组以及B组和C组等体积混合上清液(B+C组上清液)中IL-1β、TNF-α、IL-10、TGF-β蛋白水平,严格根据试剂盒说明书进行操作。以所测标准品的吸光度值为横坐标,标准品的浓度为纵坐标绘制标准曲线,得到直线回归方程,将A组、B组、C组、B+C组样品的吸光度值代入直线回归方程,得出各组IL-1β、TNF-α、IL-10、TGF-β蛋白相对表达量。实验重复3次,取均值。
1.6 流式细胞术检测各组心肌细胞凋亡情况收集D组、E组、F组培养24 h的心肌细胞,调整细胞密度至1×109L-1,取100 μL心肌细胞悬液,1 000 r·min-1离心3 min,取沉淀物,预冷PBS冲洗3次,加入5 μL Annexin V-FITC、10 μL碘化丙啶(propidium iodide,PI)混合均匀,室温、避光静置15 min,加入1×Binding buffer缓冲液195 μL,使用流式细胞仪检测心肌细胞凋亡情况。
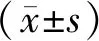
2 结果
2.1 A组、B组和C组巨噬细胞中iNOS、CD86、Arg-1、CD206 mRNA相对表达量比较结果见表1。B组巨噬细胞中iNOS、CD86 mRNA相对表达量显著高于A组,Arg-1、CD206 mRNA相对表达量显著低于A组,差异有统计学意义(P<0.05)。C组巨噬细胞中Arg-1、CD206 mRNA相对表达量显著高于A组,差异有统计学意义(P<0.05)。A组与C组巨噬细胞中iNOS、CD86 mRNA相对表达量比较差异无统计学意义(P>0.05)。
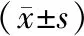
表1 A组、B组和C组巨噬细胞中iNOS、CD86、Arg-1、CD206 mRNA相对表达量比较
2.2 A组、B组、C组和B+C组巨噬细胞的培养基上清液中IL-1β、TNF-α、IL-10、TGF-β蛋白相对表达量比较结果见表2。B组巨噬细胞的培养基上清液中IL-1β、TNF-α蛋白相对表达量显著高于A组,IL-10、TGF-α蛋白相对表达量显著低于A组,差异有统计学意义(P<0.05)。C组巨噬细胞的培养基上清液中TGF-α蛋白相对表达量显著高于A组,差异有统计学意义(P<0.05)。B+C组巨噬细胞的培养基上清液中IL-1β、TNF-α蛋白相对表达量显著低于B组,IL-10、TGF-β蛋白相对表达量显著高于B组,差异有统计学意义(P<0.05)。A组与C组巨噬细胞的培养基上清液中IL-1β、TNF-α蛋白相对表达量比较差异无统计学意义(P>0.05)。
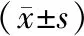
表2 A组、B组、C组和B+C组巨噬细胞的培养基上清液中IL-1β、TNF-α、IL-10、TGF-β蛋白相对表达量比较
2.3 D组、E组和F组心肌细胞凋亡率比较结果见图1。D组、E组、F组心肌细胞培养24 h时的细胞凋亡率分别为(18.76±1.11)%、(31.72±1.03)%、(20.51±1.02)%。E组心肌细胞凋亡率显著高于D组,差异有统计学意义(P<0.05)。F组心肌细胞凋亡率显著低于E组,差异有统计学意义(P<0.05)。
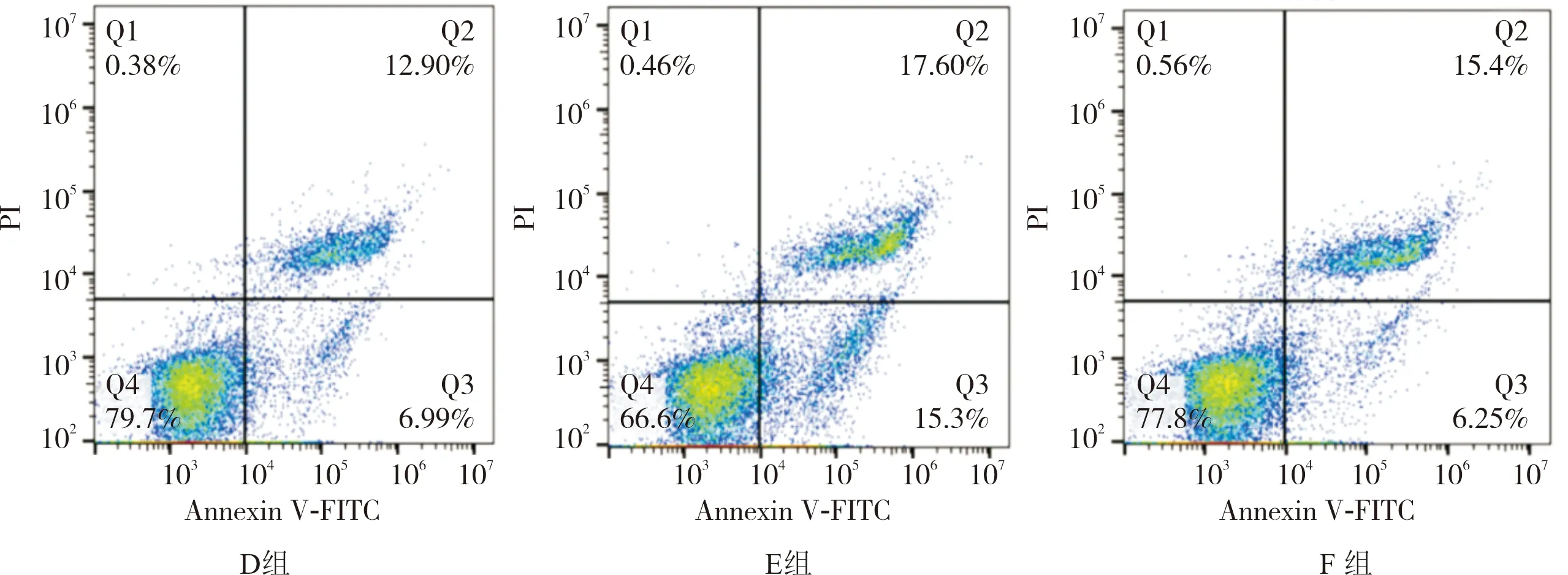
图1 D组、E组和F组心肌细胞凋亡情况
3 讨论
巨噬细胞作为外周循环系统中重要的免疫细胞,在机体受损时发挥介导炎症反应、清除死亡细胞及细胞碎片、损伤修复等功能[8]。巨噬细胞在心肌损伤和损伤修复中发挥多种作用,静息状态下的巨噬细胞可分别向M1表型和M2表型极化,M1型极化的巨噬细胞可持续产生细胞因子和趋化因子,形成促炎环境,增加心肌梗死面积;M2型极化的巨噬细胞可清除死亡细胞和细胞碎片,抑制胰岛素抵抗,促进心脏组织的重塑和再生[8-9]。研究发现,在心肌梗死后1~3 d 内M1型极化的巨噬细胞占主导地位,释放如TNF-α、IL-1β等促炎因子,导致心肌细胞损伤;5 d后M2型巨噬细胞在炎症消退过程中逐渐占主导地位,分泌IL-10、TGF-β等抗炎细胞因子,促进组织修复、重塑、血管生成及稳定内环境[10-12]。因此,调节巨噬细胞极化方向有可能是治疗心肌梗死的潜在靶点。
巨噬细胞的极化是由靶器官周围微环境的生理病理信号调控的,例如细胞因子、生长因子以及病原相关的分子模式等[13]。干扰素-γ、脂多糖和粒细胞巨噬细胞集落刺激因子可诱导巨噬细胞向M1表型极化,M1型巨噬细胞被激活后产生大量促炎细胞因子(IL-1β、TNF-α、IL-6、IL-12)、膜表面蛋白(CD80和CD86)、活性氧和活性氮[14]。CD86、iNOS为M1型巨噬细胞极化的直接标记蛋白;促炎因子IL-1β、TNF-α为M1型巨噬细胞极化的间接标志物,主要参与巨噬细胞引起的炎症反应。免疫复合物、补体、凋亡细胞和巨噬细胞集落刺激因子可诱导巨噬细胞向M2表型极化,M2型巨噬细胞的高表达标志物包括膜表面蛋白(CD163、CD206、Arg-1)、抗炎细胞因子TGF-β和IL-10等[15]。 Arg-1、CD206为M2型巨噬细胞极化的直接标记蛋白;抗炎细胞因子IL-10、TGF-β为M2型巨噬细胞极化的间接标志物,主要发挥抑制炎症作用。基于此,本研究采用实时荧光定量PCR法检测各组巨噬细胞中膜表面蛋白iNOS、CD86、Arg-1、CD206 mRNA相对表达量,采用ELISA法检测巨噬细胞的培养基上清液中IL-1β、TNF-α、IL-10、TGF-β蛋白相对表达量,以反映缺氧/复氧及IL-10干预对巨噬细胞表型极化的影响。
本研究结果显示,B组巨噬细胞中iNOS、CD86 mRNA相对表达量显著高于A组,Arg-1、CD206 mRNA相对表达量显著低于A组;B组巨噬细胞的培养基上清液中IL-1β、TNF-α蛋白相对表达量显著高于A组,IL-10、TGF-β蛋白相对表达量显著低于A组,说明缺氧/复氧导致巨噬细胞向M1表型极化且释放大量促炎细胞因子。本研究结果发现,A组与C组巨噬细胞中iNOS、CD86 mRNA相对表达量比较差异无统计学意义,A组与C组巨噬细胞的培养基上清液中IL-1β、TNF-α蛋白相对表达量比较差异无统计学意义;C组巨噬细胞中Arg-1、CD206 mRNA相对表达量显著高于A组,C组巨噬细胞的培养基上清液中TGF-β蛋白相对表达量显著高于A组;说明IL-10诱导巨噬细胞向M2表型极化且释放大量抗炎细胞因子。
IL-10是一种抗炎细胞因子,可抑制促炎细胞因子的产生[16-21]。有研究发现,与正常小鼠比较,IL-10基因缺陷小鼠由衰老导致的左心室功能障碍和炎症反应更严重[22]。心肌梗死后使用IL-10治疗可降低心肌组织的炎症反应并改善左心室收缩功能[23-24]。本研究结果发现,B+C组巨噬细胞的培养基上清液中IL-1β、TNF-α蛋白相对表达量显著低于B组,IL-10、TGF-β蛋白相对表达量显著高于B组,说明IL-10所诱导的M2型巨噬细胞释放了大量抗炎细胞因子,且抑制了巨噬细胞缺氧/复氧所致的炎症因子表达。
本研究结果显示,E组心肌细胞凋亡率显著高于D组,F组心肌细胞凋亡率显著低于E组,说明缺氧/复氧所致的巨噬细胞M1型极化促进了心肌细胞凋亡,而IL-10诱导的巨噬细胞M2型极化抑制了巨噬细胞缺氧/复氧导致的心肌细胞凋亡。原因可能为,IL-10诱导巨噬细胞向M2表型极化,从而促进巨噬细胞分泌抗炎细胞因子,抑制心脏微环境炎症反应,进而抑制心肌细胞凋亡。
综上所述,IL-10可通过诱导巨噬细胞M2型极化拮抗缺氧/复氧导致的炎症反应,从而抑制心肌细胞的凋亡。未来可将M2型巨噬细胞极化作为研究心肌I/R损伤的切入点,并继续深入探究巨噬细胞极化在心肌I/R损伤及心功能障碍中的具体作用机制。
