不同wCa/wP对宽带激光熔覆生物陶瓷涂层性能的影响
2022-07-27彭兰张国芬罗迪迪王琴甘英睿朱玉发刘其斌
彭兰,张国芬,罗迪迪,王琴,甘英睿,朱玉发,刘其斌
不同Ca/P对宽带激光熔覆生物陶瓷涂层性能的影响
彭兰,张国芬,罗迪迪,王琴,甘英睿,朱玉发,刘其斌
(贵州大学 材料与冶金学院,贵阳 550025)
对不同Ca/P的宽带激光熔覆生物陶瓷涂层性能进行研究,探究Ca/P对涂层硬度、生物相容性及生物活性的影响规律,寻求最优试验参数,为以后制备性能优良的涂层提供参考。运用梯度设计思想,采用宽带激光熔覆技术,在钛合金表面分别制备Ca/P为1.35、1.40、1.45的梯度生物陶瓷涂层。利用X射线衍射仪(XRD)、扫描电镜(SEM)、金相显微镜、显微硬度仪、模拟体液浸泡试验、体外细胞试验,研究不同Ca/P对生物陶瓷涂层组织结构、生物相容性以及生物活性的影响。XRD结果表明,涂层主要由CaTiO3、HA、Ca2SiO4、CaO、TCP等相组成。硬度测试表明,Ca/P=1.45的涂层平均显微硬度最高,而Ca/P=1.35的涂层平均硬度最低。体外细胞试验表明,所有涂层上的MG63分布均匀,细胞形态良好,Ca/P=1.40的涂层上的OD值增长较快,共同培养至第5天时,测得的OD值远高于其他涂层,相较于第1天的OD值增加最多。SBF浸泡试验表明,3种Ca/P的陶瓷涂层都在表面覆盖了类骨磷灰石,Ca/P=1.40的涂层,经浸泡后表面覆盖了最多的类骨磷灰石。观察细胞生长形态,细胞的许多丝状伪足紧贴在涂层上,使得细胞可以粘附在涂层上并生长,呈现出正常的梭形形态,具备较完整的细胞膜,Ca/P=1.40的涂层上粘附的细胞数量更多、分布更为均匀。当Ca/P=1.40时,Ca-P生物陶瓷涂层不仅拥有良好的生物矿化能力,能够形成更多类骨磷灰石,而且涂层上增殖吸附的细胞数量最多,涂层表现出良好的生物相容性和生物活性。
激光熔覆;Ca/P涂层;微观组织;生物相容性;生物活性
医用硬组织植入材料是一种用来修复和替代人体受损的硬组织器官,重建其生理功能的人工材料,包括金属材料、陶瓷材料以及各种有机聚合材料。作为人体硬组织植入材料,需要具有足够的强度、耐磨性和耐疲劳性,同时具备较好的生物相容性和生物活性,能够长期承担植入区的生理载荷,并与植入区的生理组织形成良好的化学结合,而不会引起人体的不良反应。
在金属材料中,钛及其合金在人体生理环境下的生物相容性良好,密度小,耐腐蚀,弹性模量接近天然骨[1],故被广泛应用于制造人工关节,但其耐磨性不足,且不具备生物活性,植入人体主要靠机械嵌位来实现固位,不利于长期在人体内行使生物功能。在陶瓷材料中,磷酸三钙(TCP)具有较好的生物活性,植入人体后容易被生物组织所吸收、利用[2-3];羟基磷灰石(HA)是构成骨骼和牙齿的主要矿物,含有人体组织必需的Ca和P元素,能通过在骨组织界面形成类骨磷灰石层,诱导骨组织再生长,加强骨结合和骨愈合,是目前公认的生物相容性和生物活性最佳的陶瓷材料[4]。但是HA的脆性较大,不适于承力部位[5]。因此,将钛合金优异的力学性能与HA良好的生物活性结合起来,构建一种生物复合材料十分有必要。
刘其斌等[6-9]运用梯度设计思想,采用激光熔覆技术,在钛合金表面制备了力学性能和生物性能均优良的梯度生物陶瓷涂层。激光熔覆的生物陶瓷涂层与基材之间呈现冶金结合,植入人体后不易脱落,成骨性能优异[10]。在激光快速成形过程中,Ca-P生物陶瓷涂层的物相在较大程度上受到原料粉末Ca/P的影响[4],Ca/P深刻影响涂层中HA和TCP的量,因此可以通过调节Ca/P来进一步提高HA和TCP的生成数量。刘其斌团队[7-8,11]研究发现,适当添加La2O3、CeO2、Y2O3等稀土氧化物有利于细化涂层组织,提高基体与涂层的结合强度。他们的研究还发现,掺杂La2O3的Ca-P生物陶瓷涂层中合成的生物活性相HA+TCP的量与La2O3的掺杂量密切相关。当La2O3的质量分数为0.6%时,HA+β-TCP的生成量最多,生物陶瓷涂层的生物活性最好[[12-13]。硅在动物体中主要以硅酸的形式存在,与骨骼的成长及结构密切相关,含硅羟基磷灰石(Si-HA)与HA具有相同的晶体结构。将硅掺入HA的晶格中,SiO44–会取代部分PO43–,使其与自然骨成分更接近,有效提高了HA的活性[14]。付齐[15]研究表明,掺杂10%(质量分数)SiO2的涂层中,HA+TCP的形成量最多,具有最佳的生物相容性和细胞活性,涂层中裂纹较少,涂层与基体的结合最好。
以上研究均只针对La2O3和SiO2掺杂量对HA+TCP的形成量以及涂层生物性能的影响,没有涉及不同Ca/P对涂层性能的影响研究。因此,本文利用宽带激光熔覆技术,运用梯度设计思想,选定0.6% La2O3和10% SiO2,分别制备Ca/P为1.35、1.40、1.45的生物陶瓷涂层,系统研究不同Ca/P对生物陶瓷涂层微观组织、生物相容性以及生物活性的影响。
1 试验
1.1 材料
基体材料为医用钛合金Ti-6Al-4V,涂层材料为CaHPO4·2H2O、CaCO3、Ti、La2O3和SiO2粉末(所有粉末皆购自麦克林,纯度为分析纯)。
1.2 设备
试验所用设备有:RC-LMS-6000-R激光器、1/1 000电子天平、玛瑙球磨罐、球磨机、烘干箱(DHG- 9246A)、金相显微镜(OLYMPUS GX51)、X衍射测试仪(X'Pert Powder PANalytical B.V.)、显微硬度仪(DHV-1000Z)、扫描电镜(SUPRA-40)、蒸汽灭菌锅(LDZX-30FBS)、洁净工作台、CO2细胞培养箱(MCO-15AC,SANYO)、显微镜(OLYMPUS IX73)、酶联免疫检测仪(THERMO Varioskan Flash)、倒置荧光显微镜(LEICADMI4000B)等。
1.3 方法
由于基材与涂层粉末的热膨胀系数、熔点、密度等参数相差较大,在激光熔覆后的固化过程中,涂层容易产生裂纹、气孔等缺陷,因此将与基材线膨胀系数相近的Ti粉掺杂到陶瓷粉末中,改善基体和涂层热膨胀系数失配,降低裂纹产生的可能性。为了实现涂层的平稳过渡和结构优化,采用成分梯度设计法(见表1),增加2层过渡层。HA中的Ca/P为1.67,但在激光熔覆过程会存在Ca和P的烧损,尤其是P的熔点过低,在高温下严重烧蚀[16]。因此,在粉末配比时适当提高P的含量以抵消其损耗,设计Ca/P分别为1.35、1.40、1.45,同时掺杂0.6% La2O3和10% SiO2来制备陶瓷涂层。不同Ca/P涂层的成分(M代表涂层原材料的混合体)设计如下:
1)Ca/P=1.35,M=83.09%CaHPO4·2H2O+16.91% CaCO3;
2)Ca/P=1.40,M=81.12%CaHPO4·2H2O+18.88% CaCO3;
3)Ca/P=1.45,M=79.25%CaHPO4·2H2O+20.75% CaCO3。
表1 陶瓷涂层的成分梯度设计表(以Ca/P=1.35为例)
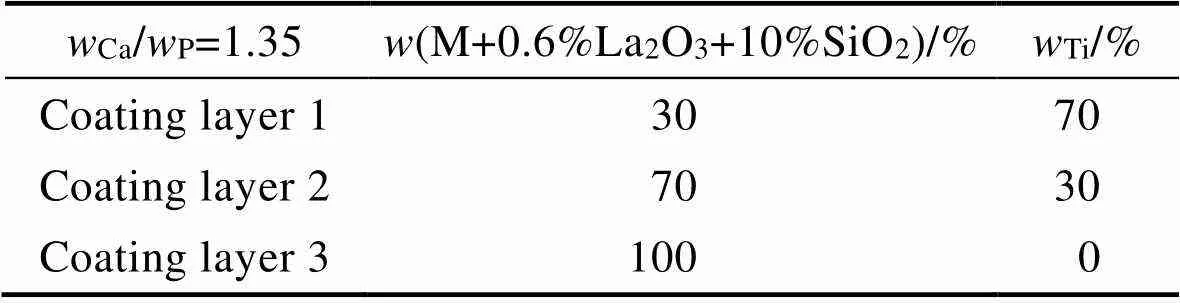
Tab.1 Composition gradient design table of ceramic coating (taking Ca/P=1.35 as an example)
涂层制备步骤如下:
1)用200#、400#金相砂纸打磨除去基材Ti-6Al-4V表面的氧化皮,然后用去离子水和酒精清洗后放入烘箱干燥。用电子天平称量粉末并进行配制,将配好的粉末放入球磨罐中,注入无水乙醇直至完全淹没粉末,然后将球磨罐封盖放入球磨机,球磨8 h。球磨完毕后将球磨罐取出,放进60 ℃的烘箱中干燥10 h,直至无水乙醇完全挥发且粉末达到干燥状态,然后进行筛粉,筛完粉后,将粉末放入密封袋中干燥保存。
2)将干燥保存的第一梯度层粉末与粘结剂均匀混合,借助模具预涂覆于打磨过的Ti-6Al-4V基材上,用金属刮刀刮匀压紧涂层,并平整表面,控制涂层厚度在0.5 mm左右。
3)用RC-LMS-6000-R激光器进行激光熔覆处理,输出功率为5 kW,扫描速度为7 mm/s,光斑尺寸为20 mm×2 mm。随着高能激光束在样品表面扫描行进,无机粉末与基材表面薄层同时熔化,形成熔池,熔池快速凝固,形成合金化层。用刷子清理第一梯度涂层表面后,预置第二梯度层粉末进行熔覆,形成合金化层+陶瓷层的梯度涂层。同理进行第三梯度涂层激光熔覆处理,得到完整的梯度生物陶瓷层涂层。
1.4 组织与性能表征
1)物相分析。使用X'Pert Powder PANalytical B.V.型X射线衍射仪对样品涂层表面的物相成分进行分析,辐射源为CuKα。
2)涂层截面形貌观察。首先用镶样机进行样品制备,然后用金相砂纸对样品进行磨制,随后用抛光机对样品进行抛光,清洗干净后,用OLYMPUS GX51型金相显微镜观察样品的截面形貌。
3)涂层显微硬度分析。用DHV-1000Z型显微硬度仪对样品的横截面进行显微硬度测定,载荷为 1 kg,保荷时间为15 s,分别以0.1 mm的距离从陶瓷层到基材进行测试,重复3次。
4)体外活性检测。将样品浸入含有5 mL模拟体液(SBF溶液)的试管中,将试管置于37 ℃的恒温摇床中,间隔48 h更换SBF溶液。取出浸泡7 d的样品,用去离子水轻轻冲洗,然后在烘箱中干燥24 h。样品干燥后喷金,通过SUPRA-40型扫描电镜观察不同Ca/P的生物陶瓷涂层在浸泡7 d前后的的表面形貌。
5)体外细胞试验。在材料表面培养细胞到预定时间后,向含样品的孔板孔中加入100 μL CCK-8溶液,将培养板用锡纸包覆,置于37 ℃的CO2培养箱中3 h,然后通过酶联分析仪在450 nm波长处分别测定培养1、3、5 d的每个孔中溶液的吸光度(OD值),以评估具有不同Ca/P的陶瓷涂层的细胞活性和数量。将样品与MG63细胞在24孔板中培养6 d后取出,用1 mL PBS洗涤样品,然后在含有1 mL PBS溶液和1 μL FDA染料的孔板中对样品染色约3 min,用倒置荧光显微镜观察不同Ca/P的样品共培养6 d的MG63细胞的数量和生长形态分布。
6)细胞生长形态观察。样品与细胞共同培养第3天后进行细胞固定,将样品涂层置于2.5%戊二醛溶液中,并在4 ℃下保存24 h后,将涂层用PBS溶液清洗2次后放入24孔板中,每次10 min。然后用30%、50%、70%、90%、100%的酒精溶液连续进行细胞脱水15 min。最后将其浸泡在100%酒精溶液中,干燥至临界点,通过SUPRA-40型扫描电镜观察细胞的初始生长形态及其在涂层上的附着情况。
2 结果与讨论
2.1 XRD分析
不同Ca/P陶瓷涂层的XRD图谱见图1。由图1可见,涂层主要由CaTiO3、HA、Ca2SiO4、CaO、TCP等组成。其中,TCP与HA是生物活性相,CaTiO3能够降低基体和涂层热膨胀系数差异,Ca2SiO4快速降解给涂层中HA的形成提供了Ca2+,有利于生成类骨磷灰石。另一方面,Ca2SiO4的存在增加了表面能和表面润湿性,使得涂层表面更容易粘附骨细胞[17]。由图1还可看出,Ca/P为1.40和1.45时,HA的衍射峰比较强,这表明该涂层会具有较好的生物活性。植入人体后,TCP比HA更易降解,与人体组织液发生水化合成HA,诱导成骨,同时能促进人工关节周围更多的La3+离子的持续释放,从而缓解磨屑病[18]。
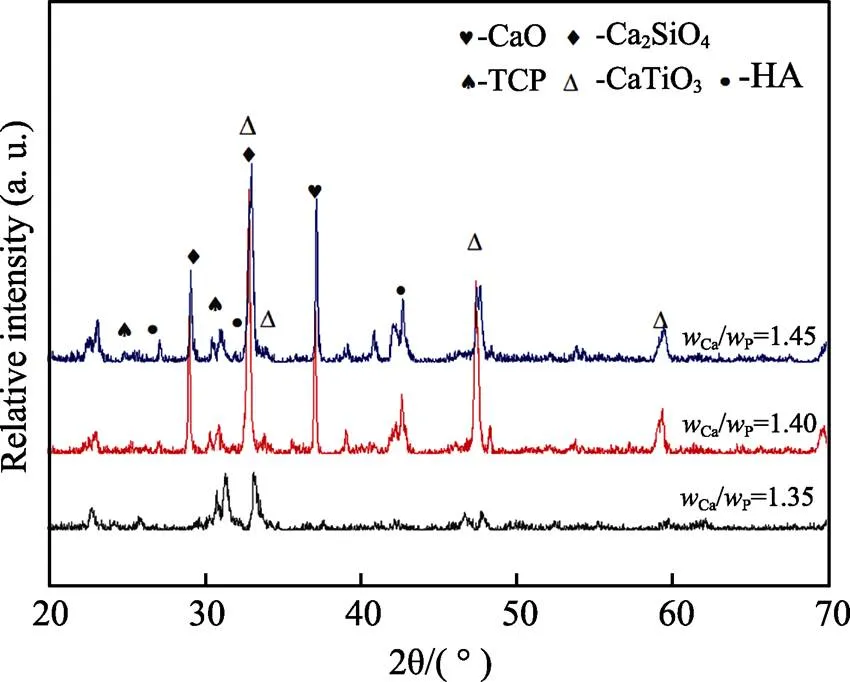
图1 不同Ca/P生物陶瓷涂层的XRD图谱
2.2 截面形貌和显微硬度分析
不同Ca/P陶瓷涂层的截面形貌和显微硬度如图2所示。由图2a—c可见,涂层自上而下分为陶瓷层、合金化层和基体3个部分。随着Ca/P的增大,涂层中的横、纵向长宽裂纹明显减少,涂层的烧结质量提高。Ca/P=1.45的涂层截面上裂纹较少,孔洞数量较少,尺寸较小,涂层更致密。原因可能是该涂层上生成的CaTiO3较多,涂层热应力最大程度降低,减小了涂层的开裂机率,保证了涂层强度,同时也减少了重金属离子游离至人体中的几率,保证了涂层的安全性。由于激光熔覆层快速加热和冷却的特性,涂层上不可避免地会出现微小的裂纹和孔洞,这种微孔的结构为新骨在涂层表面的生长提供了有利条件,新骨填满空隙需要时间,新骨在较小孔洞里生长更快[19],且这种微孔结构的涂层具有较高的孔隙率和较好的连通性,会有更好的骨修复效果。由图2d可见,从陶瓷层到基体硬度曲线呈先上升、后下降的趋势。其中,Ca/P为1.45涂层的平均显微硬度最高,而Ca/P为1.35涂层的平均硬度最低。结果表明,陶瓷涂层的硬度分布与不同Ca/P密切相关,Ca/P越大,涂层的平均硬度越高。原因可能是陶瓷涂层的Ca/P越大,在激光熔覆过程中熔池内存在的钙原子就越多,钙原子为熔池内的晶粒提供更多形核质点,形成大小分布比较均匀的晶体,致密度提高,通过细晶强化机制提高了涂层的平均硬度。此外,生成的CaO在一定程度上也能起到提高形核率,细化晶粒的作用。

图2 不同wCa/wP陶瓷涂层的截面形貌(a)—(c)和显微硬度曲线(d)
2.3 细胞相容性分析
不同Ca/P的陶瓷涂层培养6 d的MG63细胞荧光染色图见图3a—c。可以看出,所有涂层上的MG63分布均匀,细胞形态良好,表明所有涂层均无毒性,细胞可以在涂层上稳定生长和增殖。OD值的大小反映了细胞相容性的强弱,不同Ca/P陶瓷涂层与MG63细胞共同培养1、3、5 d的光密度值(OD值)如图3d所示。从图3d可以看出,随着培养时间的增加,所有涂层上的OD值都在增加,Ca/P为1.35和1.45的涂层的OD值增长缓慢。Ca/P=1.40的涂层上的OD值增长较快,共同培养至第5 d时,测得的OD值远高于其他涂层,相较于第1天的OD值增加最多。这表明其涂层表面增殖的细胞最多,细胞活性最强,生物活性最好。
2.4 体外活性分析
图4a—c为不同Ca/P陶瓷涂层未经SBF模拟体液浸泡的表面形貌,可以看出,涂层表面较平整。图4d—f为不同Ca/P陶瓷涂层在SBF模拟体液中浸泡7 d后的表面形貌。由图4d—f可见,3种Ca/P的陶瓷涂层经过SBF浸泡后,都在表面覆盖了类骨磷灰石[15]。Ca/P=1.40的涂层经浸泡后,表面覆盖了大量的类骨磷灰石,表明此涂层生物活性较好,原因可能是此涂层中生成的Ca2SiO4最多,Ca2SiO4快速降解给涂层中HA 的形成提供了更多的Ca2+,使得该涂层在SBF溶液中实现良好的HA沉积。同时SiO44–可以进入 HA 中代替PO32–,生成含硅类骨磷灰石[16],促进新骨在磷酸钙生物活性材料上的形成。同时,植入区域中局部Ca2+浓度的升高,也会与生理环境中存在的PO43–和CO32–结合,重新沉积出碳酸磷灰石,形成新骨[20]。
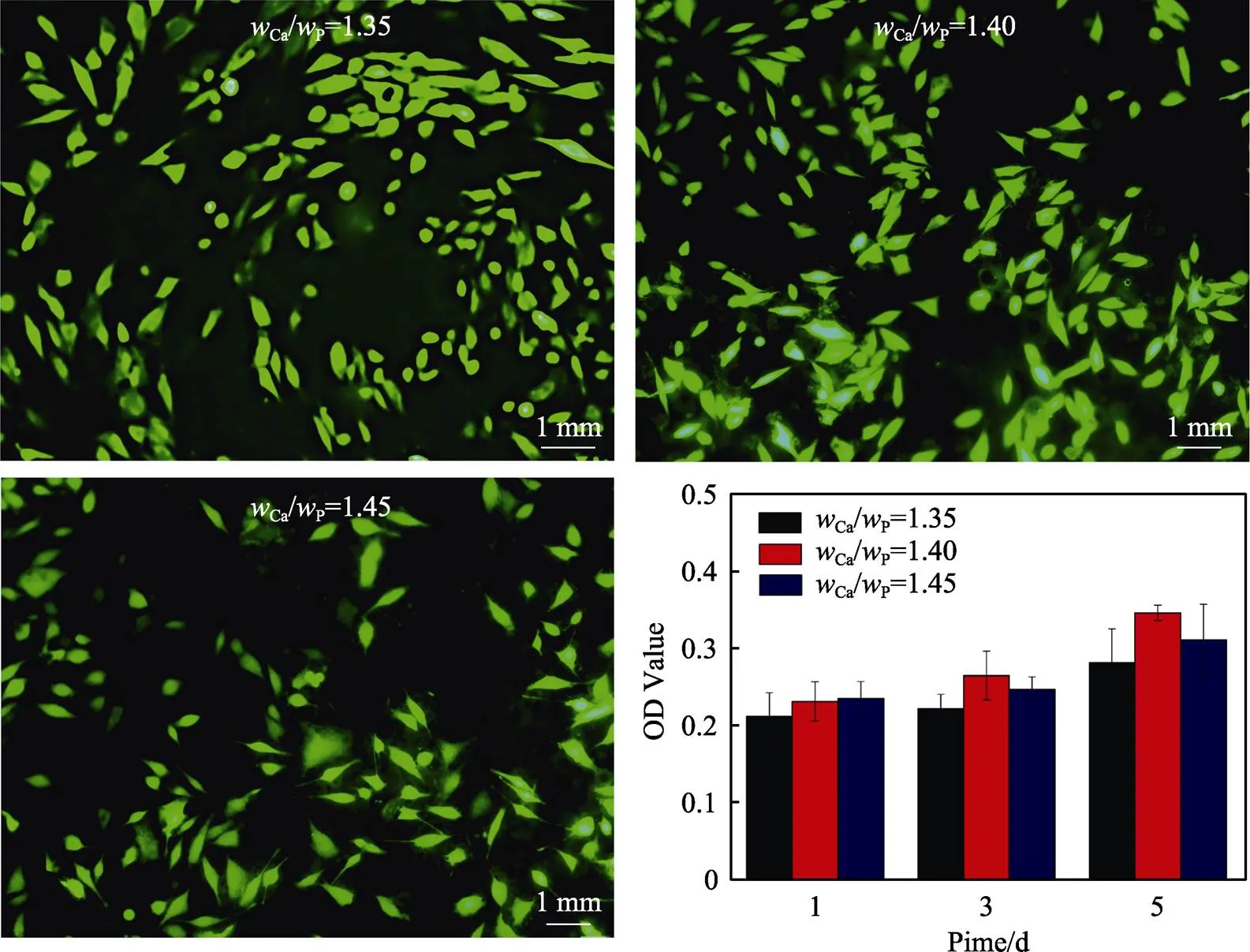
图3 不同wCa/wP涂层上培养6 d的MG63细胞荧光染色图(a)—(c)和OD值(d)

图4 不同wCa/wP陶瓷涂层浸泡SBF溶液7 d前(a)—(c)后(d)—(f)的表面形貌
2.5 细胞生长形态分析
不同Ca/P涂层进行细胞固定后,MG63细胞在其表面的生长形态如图5所示。由图5可以看出,细胞的许多丝状伪足紧贴在涂层上,使得细胞可以粘附在涂层上并生长,呈现出正常的梭形形态,具备较完整的细胞膜。Ca/P=1.40的涂层上粘附的细胞数量更多,分布更为均匀,表明涂层上细胞的生长状态最佳。原因可能是该涂层中生成的TCP量较多,TCP降解时将Ca2+和PO43–释放到介质中,从而提供了与蛋白质结合的原材料,然后蛋白质沉积在涂层上。蛋白质的吸附和沉积现象是细胞粘附于材料并增殖的关键因素,Ca/P=1.40的涂层比其他涂层提供了更多的蛋白质粘附原材料[18]。

图5 MG63细胞在不同Ca/P涂层表面的生长形态
3 结论
本文研究了不同Ca/P对涂层微观结构、显微硬度、生物活性和生物相容性的影响。结果表明,不同钙磷比的涂层物相均由CaTiO3、HA、Ca2SiO4、CaO及TCP组成,当Ca/P=1.40时,涂层中催化合成的生物活性相HA+TCP的数量最多。随着Ca/P增大,涂层上的横、纵向裂纹减少,涂层的烧结质量提高。Ca/P=1.45的涂层截面上的纵、横向裂纹数量较少,孔洞少,且尺寸较小,涂层致密度更高。陶瓷涂层的硬度分布与Ca/P密切相关,Ca/P越大,涂层的平均硬度越高,Ca/P=1.45涂层的平均显微硬度最高。3种Ca/P陶瓷涂层对细胞均无毒性,细胞在涂层上可以稳定增殖生长。Ca/P=1.40的陶瓷涂层上增殖的细胞最多,细胞活性最强,生长形态良好,涂层表面生成的类骨磷灰石最多,生物相容性和生物活性最好,是优异的骨修复候选材料。
[1] 陈艳飞. 生物医用钛合金显微组织和力学性能的研究[D]. 哈尔滨: 哈尔滨工业大学, 2006.
CHEN Yan-fei. Research on Microstructure and Mechanical Properties of Biomedical Titanium Alloys[D]. Harbin: Harbin Institute of Technology, 2006.
[2] CAO Wan-peng, HENCH L L. Bioactive Materials[J]. Ceramics International, 1996, 22(6): 493-507.
[3] HENCH L L. Bioceramics[J]. Journal of the American Ceramic Society, 1998, 81(7): 1705-1728.
[4] 胡江. 激光快速成形制备钛表面HA涂层及其成骨相关性能研究[D]. 西安: 第四军医大学, 2011.
HU Jiang. Preparation and Biological Performance of HA Coatings Fabricated by Laser Rapid Forming on Cp-Ti[D]. Xi'an: The Fourth Military Medical University, 2011.
[5] TADIC D, BECKMANN F, SCHWARZ K, et al. A Novel Method to Produce Hydroxyapatite Objects with Interconnecting Porosity that Avoids Sintering[J]. Biomaterials, 2004, 25(16): 3335-3340.
[6] LIU Qi-bin, ZOU Jiang-long, ZHENG Min, et al. Effect of Y2O3Content on Microstructure of Gradient Bioceramic Composite Coating Produced by Wide-Band Laser Cladding[J]. Journal of Rare Earths, 2005, 23(4): 446-450.
[7] LIU Qi-bin, LI Wen-fei, YANG Bang-cheng. Microstructure and Biocompatibility of Gradient Bioceramic Composite Coating Fabricated by Wide-Band Laser Cladding[J]. Key Engineering Materials, 2007, 342-343: 685- 688.
[8] LIU Qi-bin, WU Ling, YANG Bang-cheng. Gradient Rare-Earths Bioceramic Composite Coating Fabricated by Wide- Band Laser Cladding and Its Bioactivity[J]. Materials Science Forum, 2009, 610-613: 1224-1226.
[9] 蒋海兵, 刘其斌, 张玲琰. Y2O3-CeO2稀土氧化物对激光熔覆生物陶瓷涂层中HA的影响[J]. 中国表面工程, 2014, 27(3): 38-42.
JIANG Hai-bing, LIU Qi-bin, ZHANG Ling-yan. Effect of Rare Earth Oxide Y2O3-CeO2on HA in Laser Cladding Bioceramic Coating[J]. China Surface Engineering, 2014, 27(3): 38-42.
[10] 张亚平, 高家诚, 文静. 激光熔覆生物陶瓷涂层生物相容性的研究[J]. 材料科学与工程, 1999, 17(3): 20-22.
ZHANG Ya-ping, GAO Jia-cheng, WEN Jing. Research for Biocom Patibility of the Bioceram Ic Coating by Laser Cladding[J]. Materials Science and Engineering, 1999, 17(3): 20-22.
[11] 刘栋, 刘其斌. 宽带激光熔覆生物陶瓷梯度涂层及其生物活性[J]. 红外与激光工程, 2010, 39(4): 741-745.
LIU Dong, LIU Qi-bin. Preparation and Bioactivity of Bioceramic Gradient Coating by Wide-Band Laser Cladding[J]. Infrared and Laser Engineering, 2010, 39(4): 741-745.
[12] ZHANG Shi-wei, LIU Qi-bin, LI Long, et al. The Controllable Lanthanum Ion Release from Ca-P Coating Fabricated by Laser Cladding and Its Effect on Osteoclast Precursors[J]. Materials Science and Engineering: C, 2018, 93: 1027-1035.
[13] 白杨, 刘其斌, 徐鹏, 等. 稀土含量对Ca-P陶瓷涂层组织及细胞相容性的影响[J]. 中国表面工程, 2016, 29(5): 66-71.
BAI Yang, LIU Qi-bin, XU Peng, et al. Effects of Rare Earth Content on Microstructure and Cell Compatibility of Ca-P Ceramic Coating Fabricated by Laser Cladding[J]. China Surface Engineering, 2016, 29(5): 66-71.
[14] XIAO Feng-juan, CHANG Hong, HAN Yu-fang, et al. Wet Synthesis and Structural Characterization of bio- Ceramics with silicon-Substituted Hydroxyapatite[J]. 硅酸盐学报, 2007, 35(9): 1194-1199.
XIAO Feng-juan, CHANG Hong, HAN Yu-fang, et al. Wet Synthesis and Structural Characterization of bio- Ceramics with silicon-Substituted Hydroxyapatite[J]. Journal of the Chinese Ceramic Society, 2007, 35(9): 1194-1199.
[15] 付齐. 激光熔覆SiO2/Ca-P梯度稀土涂层中La3+可控析出及其对破骨细胞活性的抑制作用[D]. 贵阳: 贵州大学, 2020.
FU Qi. The Controllable Release of La3+in SiO2/Ca-P Gradient Rare-Earth Coating Fabricated by Laser Cladding and Its Inhibitory Effect on Osteoclast Activity[D]. Guiyang: Guizhou University, 2020.
[16] 张时维. 激光熔覆La3+可控析出Ca-P陶瓷涂层及其对破骨细胞活性的抑制作用[D]. 贵阳: 贵州大学, 2018.
ZHANG Shi-wei. The Controllable Lanthanum Ion Released from Ca-P Coating Fabricated by Laser Cladding and Its Inhibition on Osteoclast[D]. Guiyang: Guizhou University, 2018.
[17] WEBSTER T J, SIEGEL R W, BIZIOS R. Osteoblast Adhesion on Nanophase Ceramics[J]. Biomaterials, 1999, 20(13): 1221-1227.
[18] FU Qi, LIU Qi-bin, LI Long, et al. Study on Microstructure, Microhardness, Bioactivity, and Biocompatibility of La2O3-Containing Bioceramic Coating Doping SiO2Fabricated by Laser Cladding[J]. Journal of Biomedical Materials Research Part B: Applied Biomaterials, 2020, 108(5): 2099-2107.
[19] 张聪, 郑长福, 李颖明, 等. 多孔HA-β-TCP生物活性复合陶瓷诱导成骨的实验研究[J]. 中华外科杂志, 1993, 31(12): 722-725.
ZHANG Cong, ZHENG Chang-fu, LI Ying-ming, et al. Experimental Study on the Induction of Osteogenesis by Porous HA-β-TCP Bioactive Composite Ceramics[J]. Chinese Journal of Surgery, 1993, 31(12): 722-725.
[20] NAKAMURA T, YAMAMURO T, HIGASHI S, et al. A New Glass-Ceramic for Bone Replacement: Evaluation of Its Bonding to Bone Tissue[J]. Journal of Biomedical Materials Research, 1985, 19(6): 685-698.
Effects of Different Ca/P on Properties of Bioceramic Coating Prepared by Broadband Laser Cladding
,,,,,,
(College of materials and metallurgy, Guizhou University, Guizhou Guiyang 550025, China)
This paper aims to study the performance of broadband laser cladding bioceramic coatings with differentCa/P, explore the influence ofCa/Pon coating hardness, biocompatibility and biological activity and seek the optimal experimental parameters to provide a reference for the future preparation of coatings with excellent performance. In biomedical implant materials, bioceramic coatings prepared by laser cladding technology on titanium alloy surface have attracted wide attention due to their excellent mechanical properties and osteogenic properties. At present, relevant studies only focus on the influence of La2O3and SiO2doping amount on the formation of HA+TCP and coating biological properties, and do not involve the influence of differentCa/Pon coating properties. Therefore, this paper adopts the broadband laser cladding technology and the composition gradient design idea. The titanium alloy Ti-6Al-4V is used as the matrix material, the coating material is CaHPO4·2H2O, CaCO3and Ti powder, and the doping materials are selected as 0.6wt.% La2O3and 10wt.% SiO2. This paper adopted to gradient design idea, using broadband laser cladding technology. Gradient bioceramic coatings withCa/Pof 1.35, 1.40 and 1.45 were prepared. And by using X-ray diffractometer (XRD), scanning electron microscope (SEM), metallographic microscope, microhardness tester, simulated body fluid immersion test, in vitro cell test, system research differentCa/Pof biological ceramic coating structure, the effects of differentCa/Pon the coating structure, biocompatibility and bioactivity of bioceramic coatings were studied. the influence of the biocompatibility and bio activity, to seek the optimal experimental parameters, provide a reference for future preparation of high performance coating. XRD shows that the coating is mainly composed of CaTiO3, HA, Ca2SiO4, CaO and TCP phases. WhenCa/P=1.40, the number of HA+TCP is the largest. Hardness test shows that the higher theCa/Pis, the higher the average hardness of the coating is. The coating withCa/P=1.45 has fewer cracks and the highest average microhardness, while the coating withCa/P=1.35 has the lowest average hardness. In vitro cell experiments showed that MG63 cells on all the coatings were evenly distributed and had good growth morphology, indicating that all the coatings had no toxicity to cells. Among them, The OD value of the coating withCa/P=1.40 increased rapidly, and the OD value measured on the fifth day of co-culture was much higher than that of other coatings, and the OD value increased the most compared with that on the first day. SBF solution immersion experiment showed that the threeCa/Pceramic coatings were covered with osteoid apatite on the surface. The coating withCa/P=1.40 was covered with the most osteoid apatite after soaking. It was found that many filamentous pseudopods of the cells were closely attached to the coating, so that the cells could adhere to the coating and grow, and showed a normal spindle shape with relatively complete cell membrane. The coating withCa/P=1.40 adhered to more cells and distributed more evenly. In conclusion, whenCa/P=1.40,Ca/Pbioceramic coating not only has good biomineralization ability and can form more bone-like apatite, but also has the largest number of cells proliferated and adsorbed on the coating, showing good bioactivity and biocompatibility.
laser cladding; Ca-P coating; microstructure; biocompatibility; bioactivity
TG174.453
A
1001-3660(2022)07-0363-07
10.16490/j.cnki.issn.1001-3660.2022.07.036
2021–06–21;
2022–03–08
2021-06-21;
2022-03-08
刘其斌(1965—),男,博士,教授,主要研究方向为激光先进材料制备和电子陶瓷。
LIU Qi-bin (1965-), Male, Doctor, Professor, Research focus: preparation of electronic ceramics with advanced laser materials.
彭兰, 张国芬, 罗迪迪, 等. 不同Ca/P对宽带激光熔覆生物陶瓷涂层性能的影响[J]. 表面技术, 2022, 51(7): 363-369.
PENG Lan, ZHANG Guo-fen, LUO Di-di, et al. Effects of DifferentCa/Pon Properties of Bioceramic Coating Prepared by Broadband Laser Cladding[J]. Surface Technology, 2022, 51(7): 363-369.
责任编辑:刘世忠
