玉米醇溶蛋白–香芹酚纳米颗粒的制备及其性能研究
2022-07-27郑华明王江丽田宇航陈龙李富明刘礼全
郑华明,王江丽,田宇航,陈龙,李富明,刘礼全
玉米醇溶蛋白–香芹酚纳米颗粒的制备及其性能研究
郑华明1,王江丽1,田宇航1,陈龙1,李富明1,刘礼全2
(1.武汉工程大学 等离子体化学与新材料湖北省重点实验室,武汉 430205;2.麻城市人民医院,湖北 麻城 438300)
利用天然抗菌剂来保护食品品质和延长食品的货架期。研究利用玉米醇溶蛋白自组装的特性包覆香芹酚植物精油,然后用酪蛋白酸钠作为稳定剂来制备载香芹酚复合纳米粒子。玉米醇溶蛋白纳米颗粒对香芹酚具有良好的包封率(71.52%~80.09%)。扫描电子显微镜(SEM)显示香芹酚复合纳米粒子分布均匀,呈球形,粒径为80~220 nm。同时,包覆香芹酚的纳米粒子具有良好的复溶性、储存稳定性和抗氧化性能,并且对金黄色葡萄球菌、大肠杆菌表现出良好的抗菌性能。将该复合纳米颗粒应用于食品包装中,可有效地提高食品的抗氧化特性和抗菌性,抑制食品腐败变质、延长食品货架期,在食品工业中具有潜在的应用前景。
玉米醇溶蛋白;香芹酚;纳米颗粒;酪蛋白酸钠
香芹酚(Carvacrol,Car),又名2–甲基–5–异丙基苯酚,是一种微黄色至黄色的油状有香味化合物[1],广泛存在于天然植物精油中。由于香芹酚具有优异的抗菌性、抗氧化活性、安全性和抗衰老等药理作用[2-3],已受到越来越多研究者的关注。香芹酚不溶于水、易挥发和独特的气味等性能限制了它在食品保鲜工业中的应用[4]。研究者们通过制备脂质体[5]、微胶囊、乳剂[6]等负载体系或将香芹酚精油添加到薄膜中[7]的方法来提高香芹酚的稳定性和缓释性能。通过对不同类型负载体系的比较研究发现将富含活性成分的粒子减小到纳米尺寸后可以有效提高其疗效、溶解性和生物利用度[8]。玉米醇溶蛋白(Zein)资源丰富、价格低廉、已被美国食品和药物管理局定为公认安全(GRAS)食品[9]。玉米醇溶蛋白结构中含有大量的非极性氨基酸[10],具有亲水的顶部和疏水的外表面,表现出独特的溶解性能。它不溶于水,但可溶于体积分数为60%~90%的乙醇水溶液中[11]。玉米醇溶蛋白具有自组装特性和生物相容性[12],通过反溶剂沉淀法[13],高极性的水环境会诱导不同的玉米蛋白椭球通过其侧面的疏水基团彼此聚集,从而生成玉米蛋白纳米颗粒,因此,它可以作为生物活性成分的传递系统。
在实际应用中玉米醇溶蛋白存在部分缺点。首先,玉米醇溶蛋白的等电点接近中性,由于等电点附近的疏水引力大,静电斥力弱,导致形成的纳米粒子(Nanoparticles,NPs)容易发生团聚[14];其次,疏水的外表面使形成的纳米粒子干燥后在水中的分散性极差。
为了解决香芹酚纳米粒子在水中的复溶性,文中采用简单的反溶剂沉淀法,利用玉米醇溶蛋白的自组装特性和酪蛋白酸钠(Sodium Caseinate,SC)的乳化特性,制备了一种包封率高、复溶性强的香芹酚纳米颗粒,将它应用于食品包装中,可有效地提高食品的抗氧化特性和抗菌性,抑制食品腐败变质、延长食品货架期。
1 实验
1.1 材料与试剂
主要材料与试剂:Car,纯度≥99.9%,上海麦克林生化科技有限公司;Zein,食品级,北京索莱宝科技有限公司;SC,纯度为99%,上海梯希爱化成工业发展有限公司;大肠杆菌ATCC25922菌株、金黄色葡萄球菌ATCC25923菌株,江西省人民医院;其他试剂,分析纯,国药集团化学试剂有限公司。
1.2 设备与仪器
主要设备与仪器:Nicolet 6700傅里叶红外光谱仪,Thermo Fisher;Lambda35紫外分光光度计,Perkin Elmer;Zetasizer Nano–ZS90激光粒度仪,Malvern;SIGMA 300场发射电子显微镜,Zeiss;DSC–60差示扫描热量仪,岛津;ZWY–2102C恒温培养振荡器,上海智城分析仪器制造有限公司。
1.3 方法
1.3.1 香芹酚纳米颗粒的制备
香芹酚纳米颗粒的制备参照Littoz等[15]的实验方法,并进行了修改。取0.2 g玉米醇溶蛋白和0.1 g香芹酚溶于10 mL的体积分数为80%的乙醇溶液中,在45 ℃下搅拌2 h,待其完全溶解。然后取2 mL制得的溶液滴加到8 mL去离子水中,在400 r/min条件下搅拌5 min。在40 ℃下旋蒸去除样品中残余的乙醇,并补充去离子水到原体积,即得玉米醇溶蛋白–香芹酚分散液。
首先称取一定量的酪蛋白酸钠溶于10 mL去离子水中,然后将10 mL上述分散液滴加到酪蛋白酸钠溶液中,调节pH至6.6,最终形成玉米醇溶蛋白/酪蛋白酸钠负载香芹酚的纳米颗粒分散体。实验中设定zein与SC的质量比分别为4∶1、2∶1、1∶1、1∶2,所有样品经冷冻干燥后研磨成粉末,备用。
1.3.2 纳米粒子的傅里叶变换红外光谱检测
采用溴化钾压片法测定样品的红外光谱(FT–IR)。将风干的复合粒子与溴化钾以质量比1∶100进行混合,然后用玛瑙研钵研成均匀粉末。扫描条件设置:光谱范围为500~4 000 cm−1,扫描次数为64次,分辨率为4 cm−1。用溴化钾压片作为空白对照,每个样品的光谱采集在相同条件下重复3次。
1.3.3 纳米粒子的包封率的测定
纳米粒子的包封率(Encapsulation Efficiency)的测定参照Wang等[12]的测定方法,并进行了修改。香芹酚–乙醇溶液标准曲线的建立:配制一定质量浓度(10~50 µg/mL)的香芹酚–乙醇标准溶液,以香芹酚的浓度为横坐标,吸光度值为纵坐标,经拟合后标准曲线的函数方程为=0.0143 9+0.006 1(2=0.999)。
将4 mL新制备的分散液与16 mL石油醚混合,充分搅拌10 min后,取0.5 mL的上层有机溶剂相转移到25 mL的试剂瓶中,并在通风柜中静置30 min,使石油醚完全挥发。然后加入4 mL无水乙醇以溶解试剂瓶中的香芹酚。利用紫外分光光度计在276 nm处测定吸光度值,以式(1)计算包封效率。
(1)
式中:0为总含油量;1为游离含油量。
1.3.4 纳米粒子的粒径和Zeta电位
采用激光粒度仪(Zetasizer Nano–ZS90)测定了香芹酚纳米颗粒的粒径、平均电位和PDI值。所有样品均用去离子水稀释至适当浓度,调节pH值为6.6,在25 ℃条件下测量3次,取平均值。
1.3.5 纳米粒子的复溶性研究
取20 mg冻干后的纳米粒子溶于10 mL去离子水中,将溶液静置一段时间后,观察其分散情况及分散液的稳定性。
1.3.6 纳米粒子的表观形貌分析(FE–SEM)
将冻干后的粉末均匀的撒在导电胶上,并进行喷金。采用德国Zeiss SIGMA 300 场发射电子显微镜观察香芹酚纳米颗粒的微结构及形貌。
1.3.7 纳米粒子的热稳定性分析(DSC)
采用差式扫描量热仪(DSC–60,日本岛津)分析香芹酚纳米粒子的热稳定性。称取大约5 mg的样品,将其放入一个铝制样品盒中,密封,在铝盒中心打孔。在温度为30~270 ℃、氮气流速为20 mL/min下,先将样品加热到100 ℃,平衡10 min后冷却至30 ℃,然后加热到270 ℃,样品的加热与冷却速率均为10 ℃/min。
1.3.8 纳米粒子的抗氧化性能研究
采用DPPH法[16]测定香芹酚纳米粒子〔(zein)∶(SC)=1∶2〕的抗氧化活性。向10 mL试剂瓶中依次添加3 mL的DPPH–乙醇溶液(质量浓度为40 mg/L)和3 mL不同质量浓度的纳米粒子分散液(0、60、80、100、120、140 µg/mL),混匀后,在室温避光条件下,振荡孵育1 h。吸取上清液,于=525 nm处观察吸光度值的变化。以DPPH–乙醇溶液加去离子水作为空白对照。抗氧化活性以DPPH清除率为指标,计算见式(2)。
(2)
式中:0为空白对照的吸光度值;1为不同质量浓度香芹酚纳米粒子溶液的吸光度值。
1.3.9 纳米粒子的抗菌性能研究
用平板计数法检测香芹酚纳米粒子〔(zein)∶(SC)=1∶2〕对大肠杆菌和金黄色葡萄球菌的抗菌效果。将香芹酚纳米粒子溶于生理盐水中,配制成不同质量浓度(分别为0、2、6、10 mg/mL)的溶液,在紫外灯照射下灭菌完全,备用。
将大肠杆菌及金黄色葡萄球菌分别接种于固体培养基中,在恒温(37 ℃)恒湿箱中培养24 h。取大肠杆菌和金黄色葡萄球菌单菌落在不同液体培养基中活化培养24 h。用生理盐水使菌液浓度大约为108CFU/mL,然后在8.9 mL的液体培养基中加0.1 mL稀释好的菌液和1 mL不同质量浓度的粒子溶液。采用振荡法,振荡培养24 h后,稀释至合适的浓度后进行涂平板,利用菌落数计算抑菌率,见式(3)。
(3)
式中:为抑菌率;0为空白对照组的菌落数;1为不同质量浓度样品的菌落数。
2 结果与分析
2.1 纳米粒子的FT–IR分析
共混体系的红外光谱分析可以鉴别物质间的氢键相互作用。红外吸收峰的频率(波数)变化越大,氢键相互作用越强。各组分和复合纳米颗粒的FT–IR光谱见图1。玉米醇溶蛋白和酪蛋白酸钠在3 440.66 cm−l和3 448.51 cm−1处分别出现了特征峰,这是由于羟基的伸缩振动;2种蛋白质的红外光谱在1 600~1 400 cm−1区域的酰胺基的红外特征峰分布相似[17],1 630 cm−l左右为酰胺Ⅰ带,1 540 cm−l左右为酰胺Ⅱ带。香芹酚在1 650~1 400 cm−1由于苯环的骨架振动有4个吸收峰,在3 021.56 cm−1处的吸收峰是芳环不饱和碳氢伸缩振动产生的,当有烷基存在时,表现为烷基C—H峰的一个肩峰,2 960~2 869 cm−1处吸收峰为烷基C—H峰。当玉米醇溶蛋白与酪蛋白酸钠反应时,其 —OH特征峰值移动到3 438.29 cm−1,包覆香芹酚后,峰值进一步移动到3 402.24 cm−l。该峰值变化表明,由于玉米醇溶蛋白结构中的酰胺键与SC、Car中的羟基相互作用,使三者物质间形成了强烈的氢键[18]。Zein/SC/Car中,在1 450.80 cm−l处观察到一个振动峰,这是由于香芹酚结构中的苯环振动引起的,进一步证实了香芹酚被成功包埋在纳米粒子中。2 920 cm−l处的峰对应玉米醇溶蛋白结构中的—CH3振动。包覆香芹酚的复合纳米颗粒中,—CH3的振动峰蓝移到 2 960.43 cm−l处,这是由于玉米醇溶蛋白具有很强的疏水性[19]。上述结果表明,zein、SC和Car三者主要通过静电作用和疏水驱动作用使它形成稳定的复合物纳米颗粒。
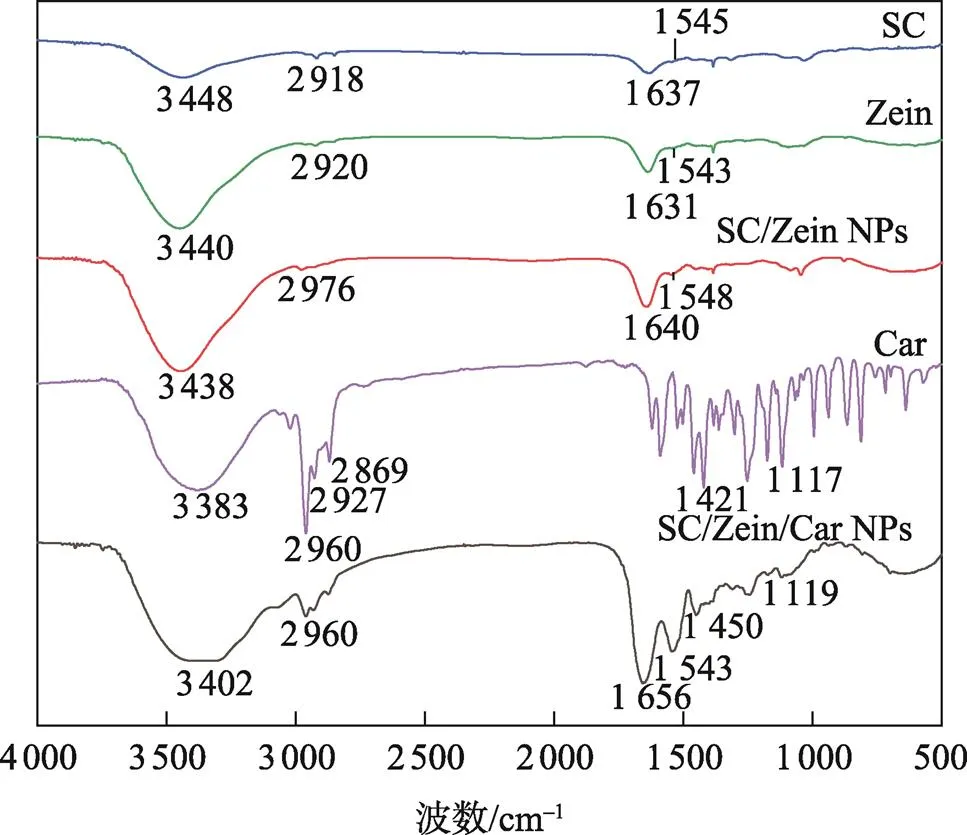
图1 Zein、Car、SC、zein/SC、zein/SC/Car的FT–IR谱图
2.2 纳米粒子包封率分析
包封率是脂质体的关键质量属性,它指的是包封在脂质双分子层中的药物含量占总投药量的百分比,能反映出脂质体中药物包封程度的高低。在固定玉米醇溶蛋白和香芹酚的质量条件下,纳米粒子的包封率受zein/SC比值的影响见图2。从图2中可以发现,(zein)∶(SC)=1∶2时,纳米粒子的包封率最高达到80.09%,并且随着酪蛋白酸钠质量的增加,纳米粒子的包封率也逐渐增加。Wang等[20]也发现了同样的变化趋势。虽然(zein)∶(SC)=4∶1式样的包封率也较高,但其稳定性和复溶性都较差。适量的酪蛋白酸钠可作为玉米醇溶蛋白/香芹酚纳米粒子表面的静电稳定剂,能防止纳米粒子自发聚集形成大颗粒。
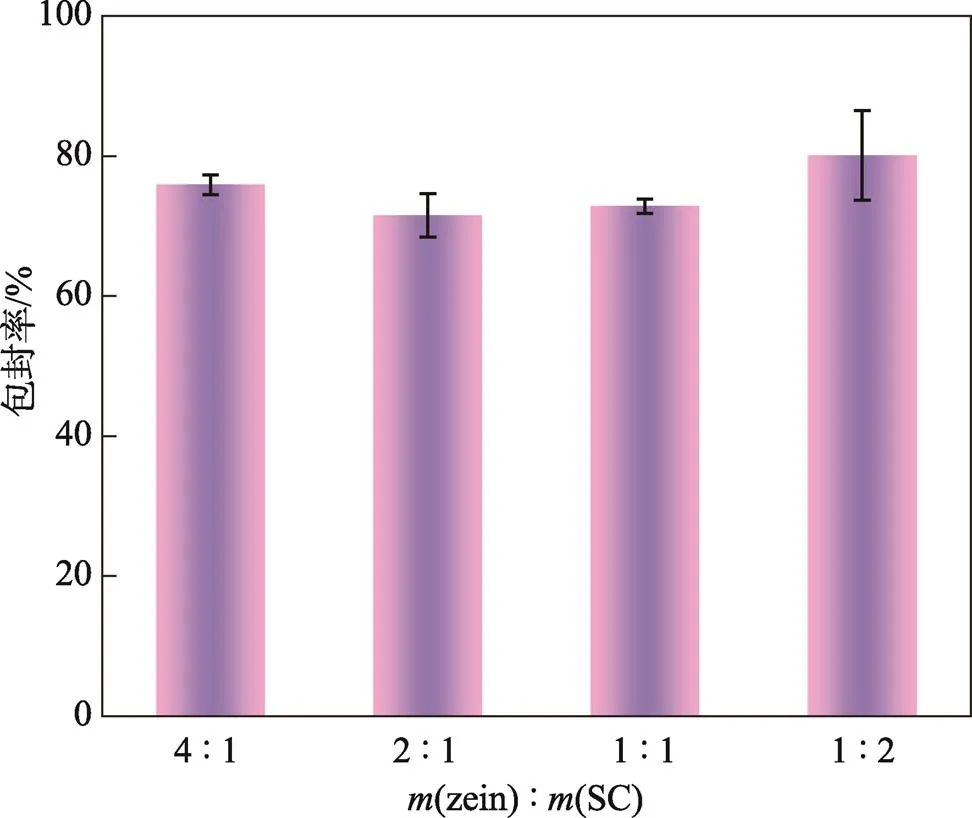
图2 不同zein/SC质量比对纳米粒子包封率的影响
2.3 粒径分布及其电位
通过表1可以看出,在pH为6.6时,随着SC含量的增加纳米粒子的粒径逐渐减少,PDI值也在减小。通常采用PDI值来检测悬浮液的粒径分布均匀性,较低的PDI值表明更均匀的粒径分布。实验中所制备的样品的PDI值为0.112~0.126,表明粒子分布均匀,单分散且稳定。当(zein)∶(SC)=1∶2时,形成的纳米粒子的粒径大约为130 nm,分布集中。由于zein、SC分子间容易形成氢键[21],随着SC含量的增加,两者结构中形成的氢键越致密,导致生成的纳米粒子的粒径减少且分散性提高。从图3可以发现,不同zein/SC质量比对纳米粒子电位的影响与对粒径的影响有些许差别,随着SC含量的增加,纳米粒子的电位先增大后减小,在(zein)∶(SC)=1∶1时电位最大为−40 mV,(zein)∶(SC)=1∶2时电位约为−38 mV。
表1 不同zein/SC质量比的包覆香芹酚纳米粒子的粒径和PDI值
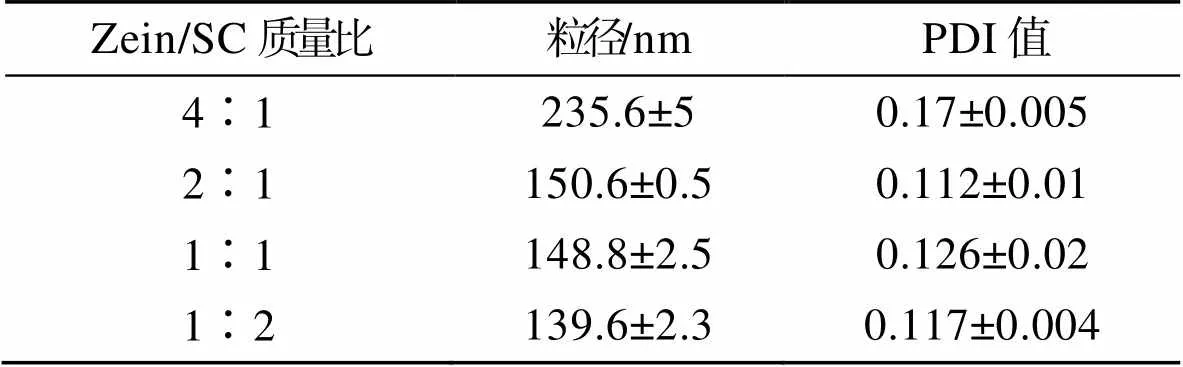
Tab.1 Size and PDI value of coated carvaterol nanoparticles with different mass ratios of zein/SC
注:数值表示为平均值±标准差(=3)。
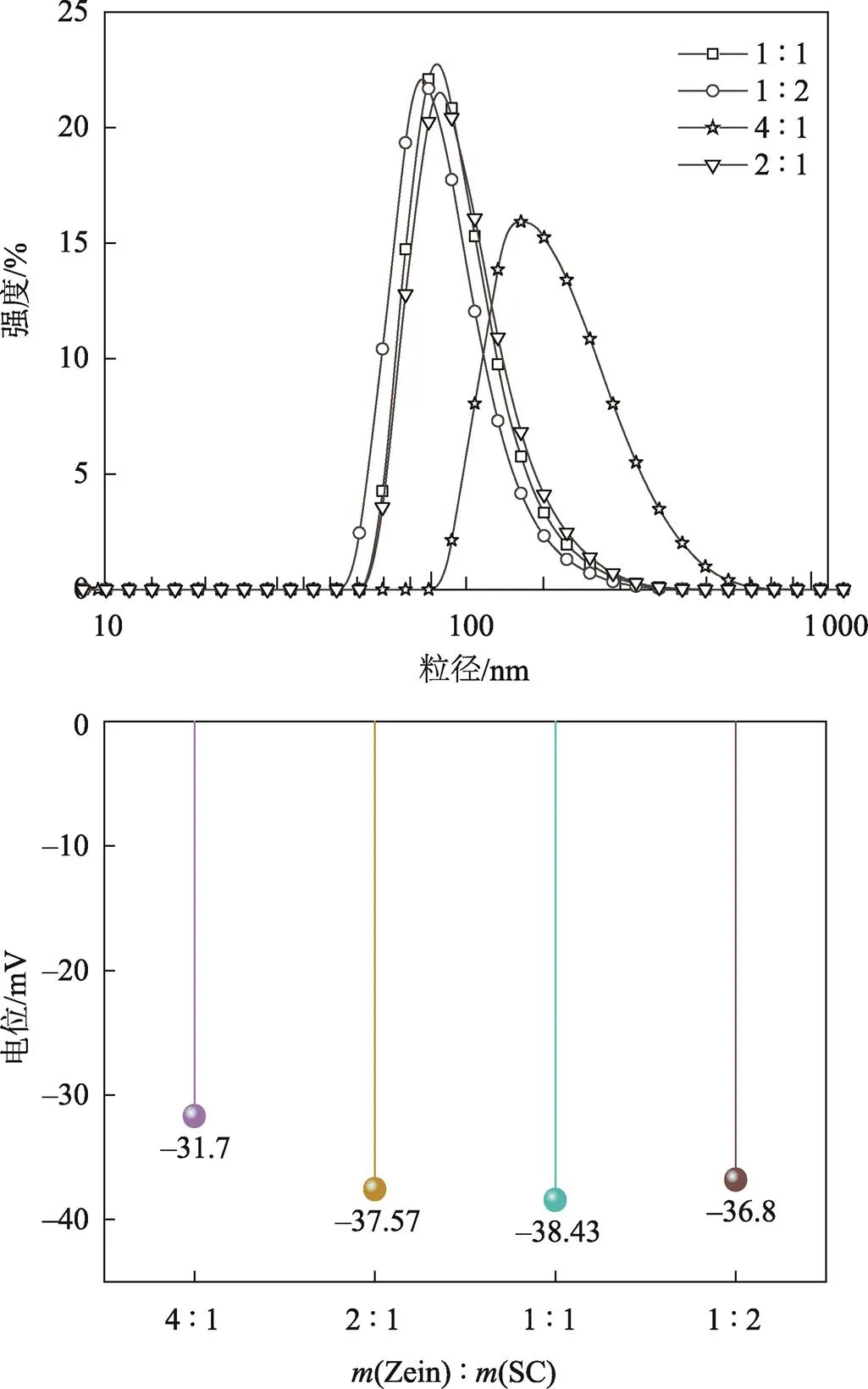
图3 不同zein/SC质量比对粒子粒径和电位的影响
2.4 复溶性
试剂做成冻干粉后不仅可以简化输运方式,同时还可以提高试剂的稳定性。复溶性是衡量冻干粉性能好坏的一项重要指标。zein/SC/Car NPs、zein/SC NPs、zein/Car NPs和不同zein/SC质量比的zein/SC/Car NPs纳米粒子在相同浓度下去离子水中的溶解状态见图4。从图4可以发现,未添加SC的zein/Car NPs的复溶性较差,瓶底部存在大量沉淀且有明显的分层现象;而添加SC的NPs的复溶性都较好,形成澄清、均一的溶液,这与Patel等[22]报道相一致。不同zein/SC质量比的包覆香芹酚纳米粒子都溶于水中,但稳定性不同;(zein)∶(SC)=4∶1的复合纳米粒子在静止1 h后出现沉淀,其他样品的稳定性较好;静置30 d后,(zein)∶(SC)=4∶1的复合纳米粒子完全沉淀,(zein)∶(SC)=2∶1和(zein)∶(SC)=1∶1的复合纳米粒子也出现了不同程度的沉淀,只有(zein)∶(SC)=1∶2的复合纳米粒子未出现沉淀,溶液依旧澄清透明。
2.5 纳米粒子的表观形貌FE–SEM
通过FE–SEM观察复合纳米粒子的形貌,见图5。包覆香芹酚的复合纳米颗粒具有完美的球形结构,部分颗粒表面出现了塌陷,这主要是因为当溶液在低温下干燥时,水的扩散速度较慢,导致纳米粒子的结构容易出现收缩和倒塌[23]。从图5可以发现,(zein)∶(SC)=1∶2的复合纳米粒子粒径为80~120 nm,其纳米粒子分布均匀。这是因为适量的酪蛋白酸钠可以与蛋白质相互作用,粒子表面形成负电荷的COO−,促使粒子互相排斥,不容易团聚。而(zein)∶(SC)=4∶1的复合纳米粒子粒径分布不均,在220 nm~2 μm内,这是由于缺乏SC,导致形成的复合纳米粒子不稳定,容易发生团聚从而形成大颗粒。
2.6 纳米粒子的DSC
玻璃化转变温度(g)可以用来研究高分子聚合物的热稳定性能[24]。玉米醇溶蛋白、酪蛋白酸钠、包覆香芹酚纳米颗粒的DSC见图6,zein和SC的g分别约为160 ℃和202 ℃,这与Pereira等[25]的报道一致。SC在120 ℃左右观察到的宽阔吸热峰,这主要是因为样品中水分蒸发引起的。包覆香芹酚纳米颗粒在158 ℃和197 ℃时出现了2个不同的g,与纯的zein和SC的g温度一致。表明2种生物聚合物之间没有相互作用,主要是通过非共价键相互作用结合在一起的。

图4 不同zein/SC质量比包覆香芹酚纳米粒子的复溶性及其分散稳定性

图5 载香芹酚纳米粒子的FE–SEM图
注: a–c为(zein)∶(SC)=1∶2, d–f为(zein)∶(SC)=4∶1。
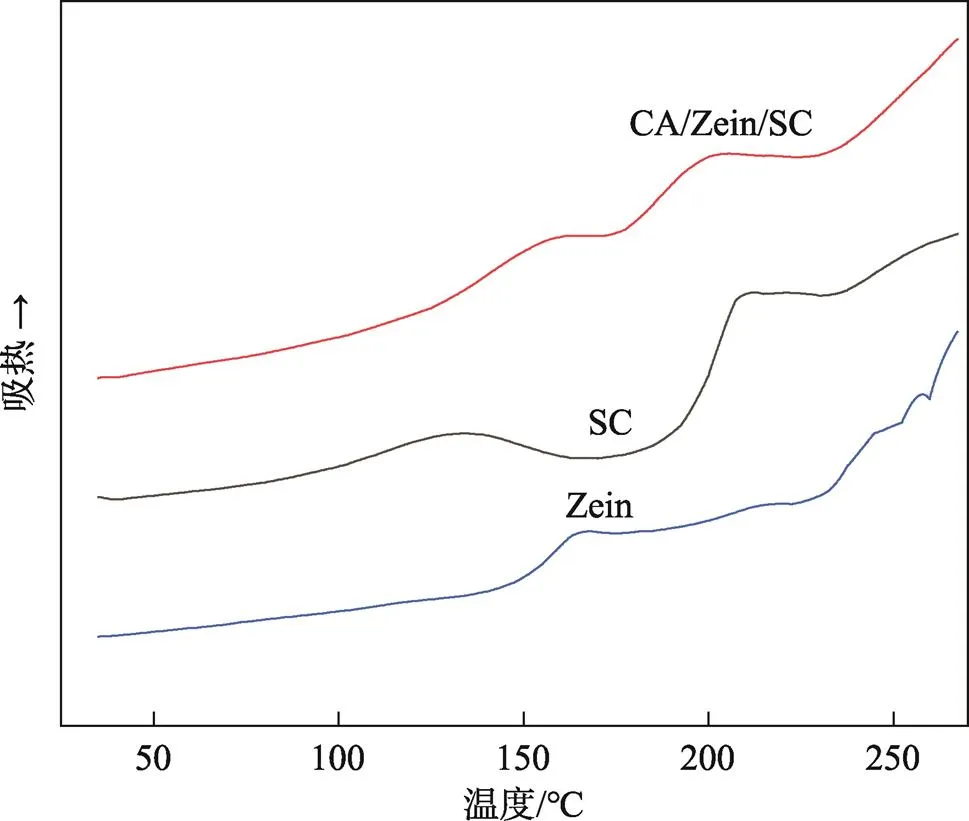
图6 包覆香芹酚纳米颗粒、酪蛋白酸钠、玉米醇溶蛋白的DSC图
2.7 抗氧化性能
以空白组为对照,DPPH自由基清除率为指标,考察包覆香芹酚纳米粒子的抗氧化活性。由图7可知,随着包覆香芹酚纳米粒子质量浓度从60 μg/mL增加到140 μg/mL,抗氧化能力也随之提高,最高为54%左右,并且DPPH清除率的变化率也越来越大。当质量浓度达到80 μg/mL时,纳米粒子的DPPH清除率为25%左右,与关桦楠等[26]的研究相似。结果表明,制备的包覆香芹酚纳米粒子在适宜质量浓度下具有良好的抗氧化活性,香芹酚含量越高,形成的纳米粒子的抗氧化活性越好。
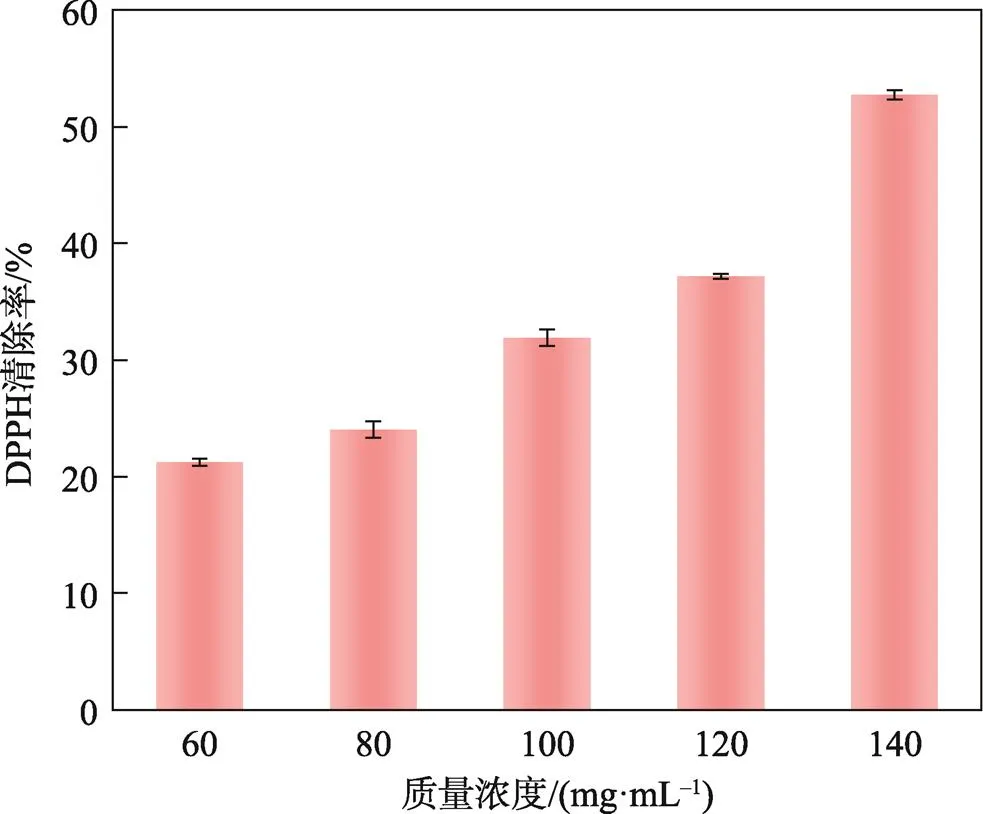
图7 不同质量浓度的zein/SC/Car纳米粒子的DPPH清除率
2.8 抗菌性能
包覆香芹酚纳米粒子对大肠杆菌和金黄色葡萄球菌的抗菌效果见图8。随着质量浓度的增加,平板上存活的菌落数逐渐减小,表明包覆香芹酚纳米粒子对大肠杆菌和金黄色葡萄球菌具有良好的抗菌效果,对金黄色葡萄球菌的抗菌结果:当纳米粒子的质量浓度为2、6、10 mg/mL时,抑菌率分别为40%、66%和80%;对大肠杆菌的抗菌结果:当纳米粒子的质量浓度为2、6、10 mg/mL时,抑菌率分别为33%、40%和66.7%。包覆香芹酚纳米粒子对2种菌的抑菌效果不同,从抑菌结果可以发现它对金黄色葡萄球菌更敏感。
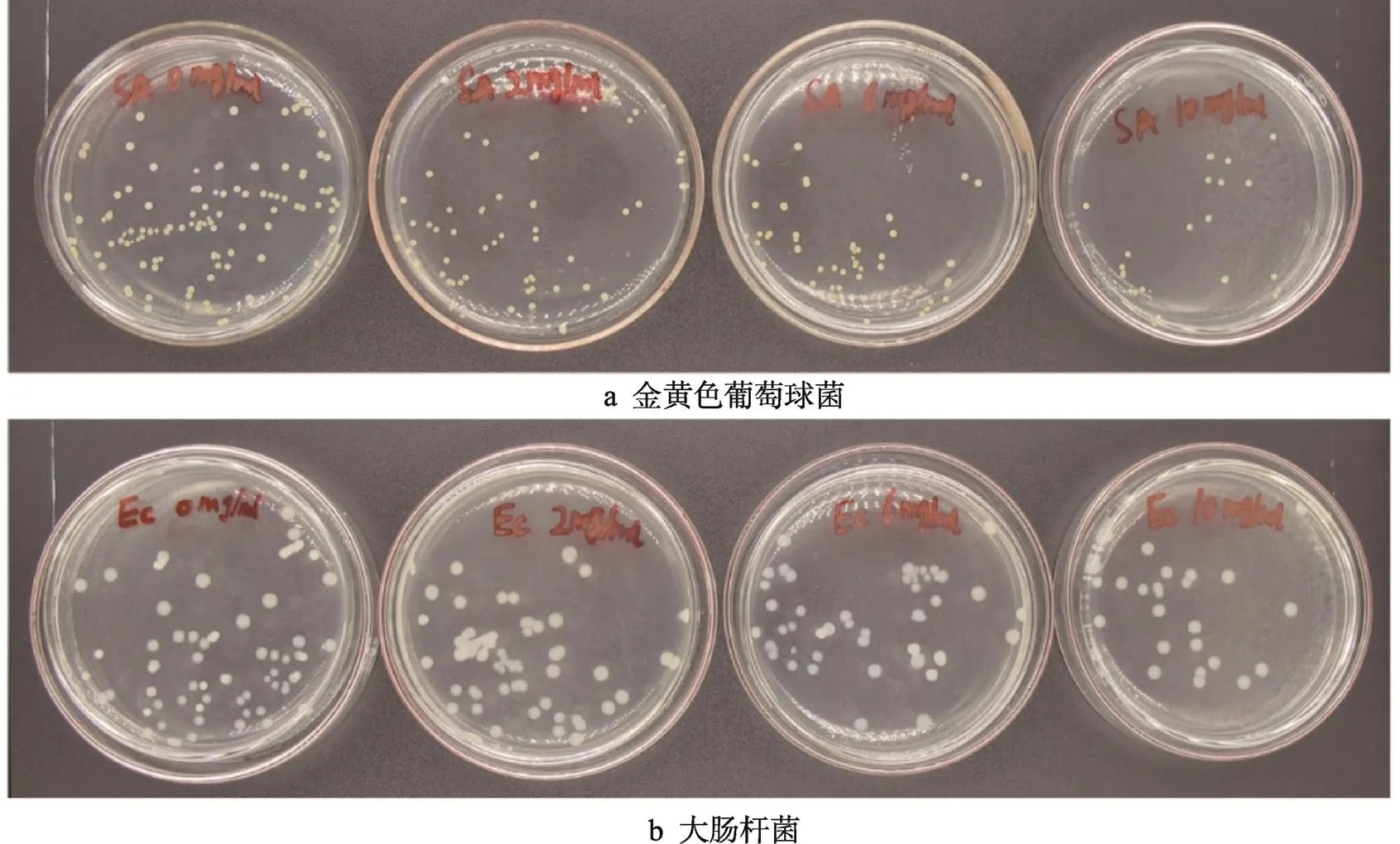
图8 不同质量浓度的zein/SC/Car纳米粒子的抗菌效果
3 结语
研究采用反溶剂沉淀法制备了包覆香芹酚的复合纳米粒子,通过在纳米粒子表面添加酪蛋白酸钠来提高纳米粒子的储存稳定性和复溶性,使香芹酚的抗菌和抗氧化性能更好地得到应用。通过红外光谱和DSC分析证实香芹酚被成功包埋在复合纳米颗粒中,复合纳米粒子的形成主要是由于3种物质间形成了氢键。Zein/SC质量比为1∶2时的复合纳米粒子粒径小、包封率高且具有更好的复溶性和储存稳定性,表现出较好的抗氧化性能和抗菌性能。Zein/SC/Car纳米粒子在食品保鲜和延长食品货架寿命方面中具有广阔的应用前景。
[1] LIU Fang, JIN Pan-pan, SUN Zhi-lan, et al. Carvacrol Oil Inhibits Biofilm Formation and Exopolysaccharide Production of Enterobacter Cloacae[J]. Food Control, 2021, 119: 107473.
[2] DONSÌ F, FERRARI G. Essential Oil Nanoemulsions as Antimicrobial Agents in Food[J]. Journal of Biotechnology, 2016, 233: 106-120.
[3] FIGUEROA-LOPEZ K J, TORRES-GINER S, ENESCU D, et al. Electrospun Active Biopapers of Food Waste Derived Poly(3-Hydroxybutyrate-Co-3- Hydroxyvalerate) with Short-Term and Long-Term Antimicrobial Performance[J]. Nanomaterials (Basel, Switzerland), 2020, 10(3): 506.
[4] SILVA F T D, CUNHA K F D, FONSECA L M, et al. Action of Ginger Essential Oil (Zingiber Officinale) Encapsulated in Proteins Ultrafine Fibers on the Antimicrobial Control in Situ[J]. International Journal of Biological Macromolecules, 2018, 118: 107-115.
[5] DE CARVALHO S, NORONHA C, FLORIANI C. Optimization of Α-Tocopherol Loaded Solid Lipid Nanoparticles by Central Composite Design[J]. Industrial Crops and Products, 2013, 49: 278-285.
[6] FELÍCIO I M, SOUZA R L, OLIVEIRA M C, et al. Development and Characterization of a Carvacrol Nanoemulsion and Evaluation of Its Antimicrobial Activity Against Selected Food-Related Pathogens[J]. Letters in Applied Microbiology, 2020, 72: 299-306.
[7] XU Tian, GAO Cheng-cheng, YANG Yu-ling, et al. Retention and Release Properties of Cinnamon Essential Oil in Antimicrobial Films Based on Chitosan and Gum Arabic[J]. Food Hydrocolloids, 2018, 84: 84-92.
[8] YEN F L, WU T H, TZENG C W, et al. Curcumin Nanoparticles Improve the Physicochemical Properties of Curcumin and Effectively Enhance Its Antioxidant and Antihepatoma Activities[J]. Journal of Agricultural and Food Chemistry, 2010, 58(12): 7376-7382.
[9] WEISSMUELLER N T, LU H D, HURLEY A, et al. Nanocarriers from GRAS Zein Proteins to Encapsulate Hydrophobic Actives[J]. Biomacromolecules, 2016, 17(11): 3828-3837.
[10] FENG S, SUN Y, WANG D, et al. Effect of Adjusting pH and Chondroitin Sulfate on the Formation of Curcumin-Zein Nanoparticles: Synthesis, Characterization and Morphology[J]. Carbohydrate Polymers, 2020, 250: 116970.
[11] DAI Lei, WEI Yang, SUN Cui-xia, et al. Development of Protein-Polysaccharide-Surfactant Ternary Complex Particles as Delivery Vehicles for Curcumin[J]. Food Hydrocolloids, 2018, 85: 75-85.
[12] WANG Lei, ZHANG Yue. Eugenol Nanoemulsion Stabilized with Zein and Sodium Caseinate by Self-Assembly[J]. Journal of Agricultural and Food Chemistry, 2017, 65(14): 2990-2998.
[13] KRINGEL D, DA SILVA W, BIDUSKI B. Free and Encapsulated Orange Essential Oil into a Β-Cyclodextrin Inclusion Complex and Zein to Delay Fungal Spoilage in Cakes[J]. Journal of Food Processing and Preservation, 2020, 44(5): 14411.
[14] HU K, MCCLEMENTS D J. Fabrication of Surfactant-Stabilized Zein Nanoparticles: A pH Modulated Antisolvent Precipitation Method[J]. Food Res Int, 2014, 64: 329-335.
[15] LITTOZ F, MCCLEMENTS D J. Bio-Mimetic Approach to Improving Emulsion Stability: Cross-Linking Adsorbed Beet Pectin Layers Using Laccase[J]. Food Hydrocolloids, 2007, 22(7): 1203-1211.
[16] HAMELIAN M, VARMIRA K, VEISI H. Green Synthesis and Characterizations of Gold Nanoparticles Using Thyme and Survey Cytotoxic Effect, Antibacterial and Antioxidant Potential[J]. Journal of Photochemistry & Photobiology, B: Biology, 2018, 184: 71-79.
[17] CHANG C, WANG T, HU Q, et al. Caseinate-Zein- Polysaccharide Complex Nanoparticles as Potential Oral Delivery Vehicles for Curcumin: Effect of Polysaccharide Type and Chemical Cross-Linking[J]. Food Hydrocolloids, 2017, 72: 254-262.
[18] MARCELLO S. Formation and Characterization of Zein-Caseinate-Pectin Complex Nanoparticles for Encapsulation of Eugenol[J]. LWT-Food Science and Technology, 2018, 89: 596-603.
[19] ZHANG H, FU Y, XU Y, et al. One-Step Assembly of Zein/Caseinate/Alginate Nanoparticles for Encapsulation and Improved Bioaccessibility of Propolis[J]. Food & Function, 2019, 10(2): 635-645.
[20] WANG Lei, XUE Jia, ZHANG Yue. Preparation and Characterization of Curcumin Loaded Caseinate/Zein Nanocomposite Film Using PH-Driven Method[J]. Industrial Crops & Products, 2019, 130: 71-80.
[21] LUIS A I S, CAMPOS E V R, DE OLIVEIRA J L, et al. Zein Nanoparticles Impregnated with Eugenol and Garlic Essential Oils for Treating Fish Pathogens[J]. ACS Omega, 2020, 5(25): 15557-15566.
[22] PATEL A R, BOUWENS E C M, VELIKOV K P. Sodium Caseinate Stabilized Zein Colloidal Particles[J]. Journal of Agricultural and Food Chemistry, 2010, 58(23): 12497-12503.
[23] BEIRÃO-DA-COSTA S, DUARTE C, BOURBON A I, et al. Inulin Potential for Encapsulation and Controlled Delivery of Oregano Essential Oil[J]. Food Hydrocolloids, 2013, 33(2): 199-206.
[24] TORRES-GINER S, LAGARON J M. Zein-Based Ultrathin Fibers Containing Ceramic Nanofillers Obtained by Electrospinning I Morphology and Thermal Properties[J]. Journal of Applied Polymer Science, 2010, 118(2): 778-789.
[25] PEREIRA R N, SOUZA B W S, CERQUEIRA M A, et al. Effects of Electric Fields on Protein Unfolding and Aggregation: Influence on Edible Films Formation[J]. Biomacromolecules, 2010, 11(11): 2912-2918.
[26] 关桦楠, 宋岩, 龚德状, 等. 废弃黑葵花籽壳绿色制备金纳米粒子及其抗氧化和催化性能[J]. 食品科学, 2020, 41(8): 14-20.
GUAN Hua-nan, SONG Yan, GONG De-zhuang, et al. Green Synthesis of Gold Nanoparticles Using Waste Black Sunflower Seed Shell Extract and Evaluation of Antioxidant and Catalytic Activities[J]. Food Science, 2020, 41(8): 14-20.
Preparation and Properties of Zein-Carvacrol Nanoparticles
ZHENG Hua-ming1, WANG Jiang-li1, TIAN Yu-hang1, CHEN Long1, LI Fu-ming1, LIU Li-quan2
(1. Hubei Key Laboratory of Plasma Chemical and Advanced Materials, Wuhan Institute of Technology,Wuhan 430205, China; 2. People's Hospital of Macheng City, Hubei Macheng 438300, China)
The work aims to protect the food quality and extend the shelf life of the food with natural antibacterial agent. The carvacrol essential oil was coated through the self-assembly properties of zein and then carvacrol composite nanoparticles were prepared with sodium caseinate as the stabilizer. The zein nanoparticles had a high encapsulation efficiency (71.52% ~ 80.09%) on carvacrol and the carvacrol composite nanoparticles were uniformly distributed and spherical, with a particle size range of 80 ~ 220 nm. Meanwhile, the nanoparticles coated on carvacrol had good resolubility, storage stability and antioxidant properties, and showed good antibacterial properties againstandThese composite nanoparticles can effectively improve the antioxidant and antibacterial properties of food, inhibit food spoilage and prolong the shelf life, which has potential application prospects in the food industry.
zein; carvacrol; nanoparticles; sodium caseinate
TS210.1
A
1001-3563(2022)13-0000-08
10.19554/j.cnki.1001-3563.2022.13.007
2021–12–01
武汉工程大学第十三届研究生教育创新基金(CX2021181);武汉工程大学教学研究项目(X2018027)
郑华明(1980—),男,博士,武汉工程大学副教授,主要研究方向为全生物降解材料、智能包装材料。
刘礼全(1979—),男,本科,中级工程师,主要研究方向为设备维护与管理。
责任编辑:曾钰婵
