非洲猪瘟病毒感染后猪外周血淋巴细胞Toll样受体信号通路的lncRNA-mRNA分析
2022-07-27陈世钰蒋亚君郝玉欣黄建新郭晓宇朱鸿飞吴佳俊
陈世钰,崔 帅,蒋亚君,鑫 婷,王 洋,郝玉欣,黄建新,郭晓宇,朱鸿飞,吴佳俊,贾 红
(1.中国农业科学院北京畜牧兽医研究所,北京 100193;2.中国动物疫病预防控制中心,北京 102618;3.大理农林职业技术学院,大理 671003)
非洲猪瘟(African swine fever,ASF)是由非洲猪瘟病毒(African swine fever virus,ASFV)感染引起的猪的急性、热性、高度接触性传染病。ASFV是一种核质大DNA病毒,长度介于170~190 kb[1],共含有150多个开放阅读框(open reading frame,ORF),其中34个编码结构蛋白,但目前仍有很多蛋白功能未知[2-3]。1921年ASF首次在肯尼亚暴发[4],随后在撒哈拉以南非洲大部分地区和撒丁岛流行[5]。ASFV在20世纪50年代首次进入欧洲,到1995年从西班牙和葡萄牙彻底根除[6]。2007年欧洲再次暴发疫情,并传播至乌克兰、欧盟东部国家、波兰、俄罗斯等国家[1,7]。2018年中国辽宁首次报道ASF疫情[8],随后传播至全国,造成巨大的经济损失。ASFV传播方式多样,主要通过易感动物直接接触传播,或污染的猪肉、车辆、人及蜱间接传播[9]。发病动物表现高热、出血和多器官病变,短时间内死亡。试验性感染后7~10 d出现临床症状,可被视为感染晚期[10]。
长链非编码RNA(long non-coding RNA,lncRNA)是一种非编码、长度>200 nt的RNA分子,位于细胞核或细胞质中,具有一定功能,可在转录、转录后及表观修饰等多个水平上调节靶基因的表达[11-12],在细胞增殖、自噬、凋亡及疾病发生发展等多个过程中发挥重要作用。本研究利用高通量测序技术成功构建了猪外周血淋巴细胞的lncRNA文库,通过GO功能和KEGG信号通路富集分析,初步鉴定出影响Toll样受体信号通路的调控网络,为进一步阐述病毒炎症反应和病毒复制等提供了一定理论依据,为ASF的防控提供技术支撑。
1 材料与方法
1.1 材料
1.1.1 试验动物及毒株 10头英系大白猪购自北京市SPF猪育种管理中心,所有猪检测ASFV、猪繁殖与呼吸综合征病毒(PRRSV)、猪圆环病毒(PCV)、猪伪狂犬病病毒(PRV)及其抗体,结果均为阴性。本试验所用毒株ASFV CADC-HN09株由中国动物疫病预防控制中心提供。试验动物饲养于中国动物疫病预防控制中心P3实验室
1.1.2 主要试剂及仪器 TRIzol®Reagent、Plant RNA Purification Reagent、UNG酶、Qubit 4.0(Invitrogen公司);TruseqTMSmall RNA sample pre Kit、cBot Truseq PE Cluster Kit v3-cBot-HS、Novaseq 6000 SBS Kit v3-HS(200 cycles)(Illumina公司)。NanoDrop2000分光光度计(Thermo公司);琼脂糖(北京全式金生物技术有限公司);RNA提取试剂盒、lnRcute lncRNA First-Strand cDNA Kit、lnRcute lncRNA qPCR Kit(SYBR Green)、DL2000 DNA Marker(天根生化科技(北京)有限公司)。实时荧光定量PCR仪(型号:ABI 7900HT)。
1.2 方法
1.2.1 试验动物分组及处理 将猪分为试验组(5头)和对照组(5头),分别接种1 mL 102HAD50的ASFV强毒和等剂量的PBS。于第7天采集前腔静脉血,用淋巴细胞分离试剂盒分离淋巴细胞,细胞样品于-80 ℃保存备用。
1.2.2 RNA提取与质量检测 试验组和对照组各随机选取3个样品进行高通量测序。采用TRIzol法提取样品总RNA,1.0%琼脂糖凝胶电泳检测样品完整性,NanoDrop2000分光光度计检测样品浓度与纯度。其中,28S/18S为1.8~2.2,RIN值>7代表提取RNA完整性较好;浓度≥50 ng/μL、总量不低于1 μg即满足建库要求。
1.2.3 测序数据及质量控制 基于边合成边测序(sequencing by synthesis,SBS)技术,采用Illumina 高通量测序平台对cDNA文库进行测序,产出大量的高质量的原始数据(Raw data),其大部分碱基质量分值能达到或超过Q30。对原始测序数据进行质量过滤,去除测序接头序列、低质量读段、含N比例超过10%的序列及长度过短序列,得到高质量的质控数据(Clean data)。
1.2.4 参考基因组比对分析 质控后的原始数据,即Clean data(reads),因测序片段是mRNA随机打断的,为确定这些片段由哪些基因转录而来,使用HISAT2数据库将质控后的测序数据比对到猪参考基因组(https://www.ncbi.nlm.nih.gov/genome/?term=txid9822[Organism:exp]),进而获得用于后续转录本组装、表达量计算等的Mapped data,同时对该次转录组进行测序比对。
1.2.5 lncRNA差异表达分析 获得所有lncRNA表达量后,对表达数据进行统计学分析,进而筛选不同样本之间显著差异的基因。筛选过程以log2|FoldChange|≥1且P<0.05为标准,满足条件的为显著差异lncRNA,并对筛选到的差异lncRNA进行可视化展示。
1.2.6 差异表达lncRNA靶基因预测及富集分析 对差异表达lncRNA采用反式调控(trans法)进行靶基因预测,即当lncRNA与一些距离较远的基因在表达量上存在正相关或负相关的情况时,就可通过样本间lncRNA与蛋白编码基因的表达量相关性分析来预测其靶基因,并对筛选到的差异表达lncRNA进行靶基因GO功能和KEGG信号通路富集分析。
1.2.7 Toll样受体信号通路调控网络 根据GO功能和KEGG信号通路富集分析结果,筛选Toll样受体信号通路,挖掘出调控该通路的内源性lncRNA及相关靶基因。根据差异表达的内源性lncRNA预测其反式调控的靶基因mRNA,初步挖掘调控该通路的lncRNA-mRNA调控网络。
1.2.8 实时荧光定量RT-PCR验证筛选的lncRNA 为确保测序结果的准确性,通过实时荧光定量RT-PCR方法进一步验证所筛选lncRNA。以U6作为内参基因,引物信息见表1。引物由生工生物工程(上海)股份有限公司合成。反转录及实时荧光定量PCR体系和程序参照试剂盒要求进行。
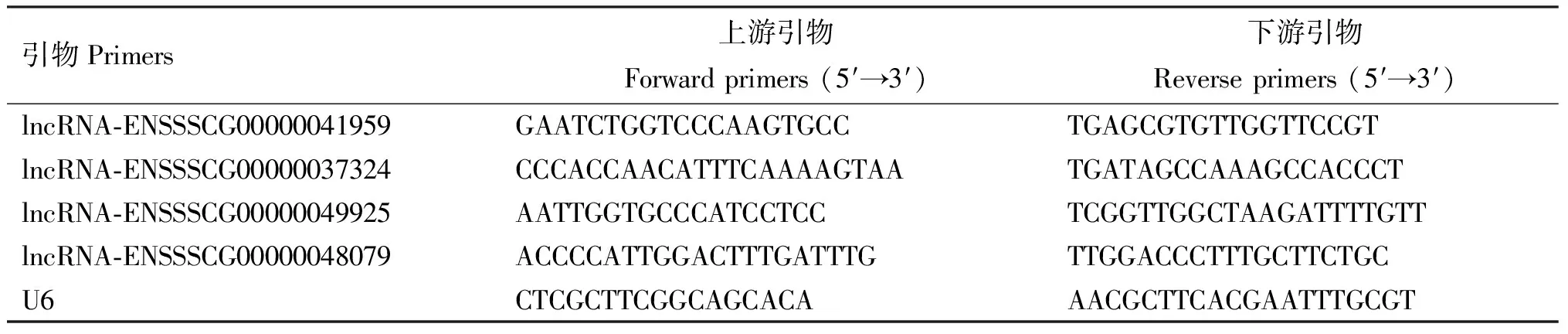
表1 引物信息
2 结 果
2.1 测序数据
2组样品经过高通量测序后,得到Raw reads,结果见表2。原始文库经过去除低质量和受污染的序列后,获得Raw reads 519 473 712条,Clean reads 504 387 798条,而纯净序列/原始序列集中在92%~98%,说明低质量数据较少,测序效果良好。对照组GC含量在50%左右,而试验组GC含量却维持在56%以上,说明病毒感染导致宿主基因组中GC含量升高。
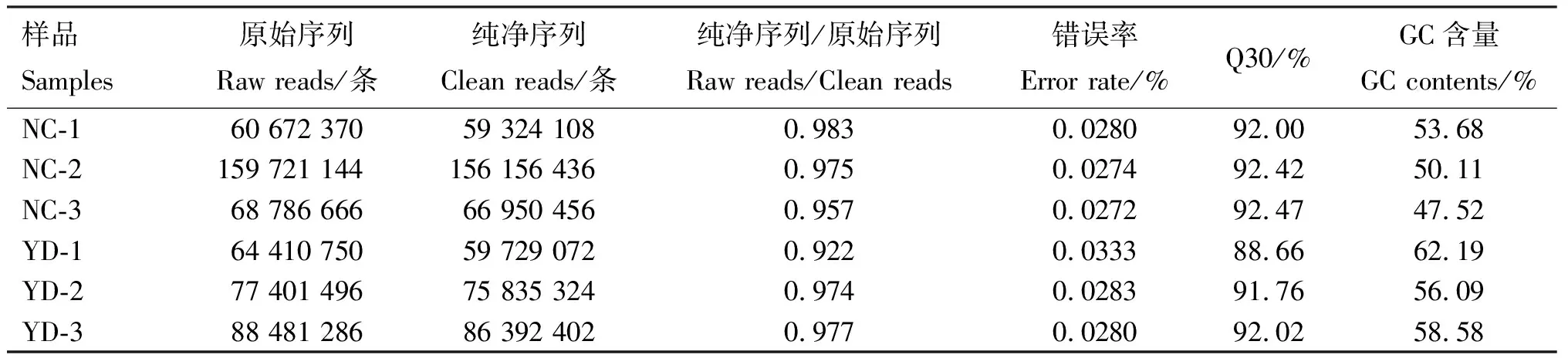
表2 测序数据统计结果
2.2 比对效率
使用HISAT2数据库对测序数据进行注释并将其定位到猪参考基因组,分析序列在基因组上的分布情况,结果见表3。由表3可知,纯净序列的总体比对率在79%~93%,将其去重后的唯一比对率稍有下降,维持在63%~90%,以上结果表明,仅有少量reads可比对到参考基因组多个位置,多数reads为唯一匹配。

表3 比对率统计
2.3 差异表达的lncRNA
利用高通量测序技术对差异表达的lncRNA进行分析,以log2FoldChange为横坐标、log10FDR为纵坐标对6个样本中的差异lncRNAs绘制火山图(图1),直观反映了样本间差异表达的分布情况,将上调和下调的显著性差异表达进行统计,结果显示,上调表达lncRNAs 38个,下调表达lncRNAs 35个。
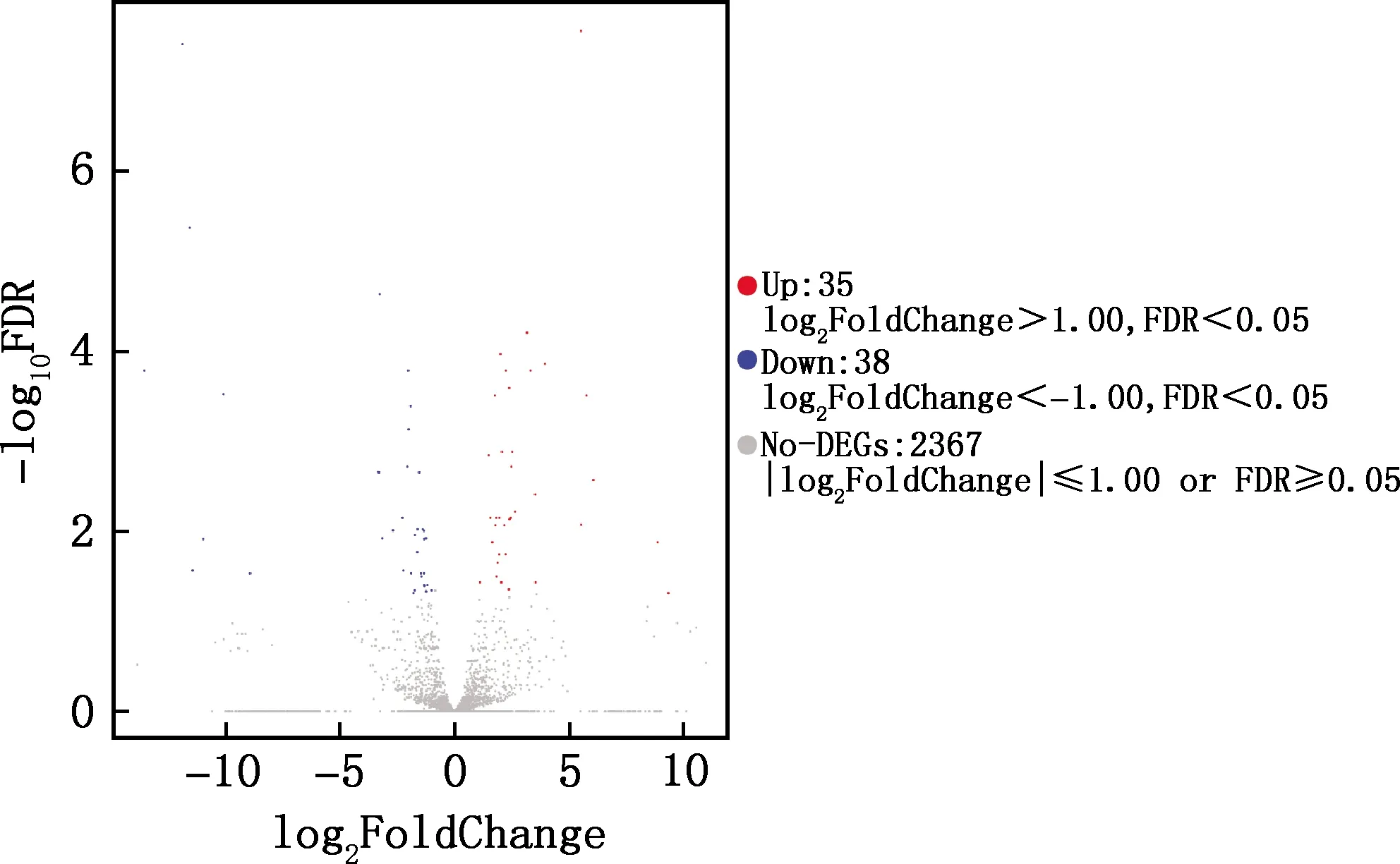
右侧点表示显著上调的基因;左侧点表示显著下调的基因
以样本为横坐标、差异表达基因为纵坐标对差异显著lncRNA进行聚类分析,结果见图2。由图2可知,2组样本间lncRNAs表达差异显著(P<0.05),试验组与对照组属于不同的分支,说明这2组样本所有基因的表达模式不同。

图2 差异表达lncRNAs聚类热图
2.4 lncRNA靶基因富集分析
2.4.1 GO功能富集 将筛选出来的差异表达的lncRNA进行反式调控靶基因预测,利用GO数据库进行分类,涉及生物过程(biological process,BF)510个条目、细胞组分(cellular component,CC)87个条目、分子功能(molecular function,MF)67个条目。生物过程包括调节免疫系统过程、防御反应、生物刺激、病毒反应和先天性免疫等;细胞组分大多富集在胞内的细胞器和染色体等;分子功能主要富集在蛋白结合、ATP酶调节活性、阴离子结合和腺苷酸结合等。挑选显著富集的前30个绘制气泡图,结果见图3。

每个节点代表一个GO条目术语,代表富集到每个GO 条目中的差异基因;节点的大小与富集到该通路中的差异基因个数成正比
同时对GO富集结果前10个GO条目绘制网络图,其中,调节免疫系统过程、多器官反应、压力应答等过程富集基因最多,且靶基因存在一定的交叉,同时调控多种反应过程,如STAT2参与病毒防御、病毒反应和压力应答等过程,调控病毒感染后的信号转导;IL23R、TRAF3、TNFRSF4、IFNGR1等多种细胞因子相关受体被显著富集到这些条目(图4)。

图4 GO功能富集网络图
2.4.2 KEGG通路富集 选取显著差异的前29条通路绘制柱状图(图5)。结果显示,841条靶基因共富集到332个信号通路上,大部分靶基因与细胞循环、疾病及免疫应答有关,其中细胞循环差异最显著,含127条靶基因,占15.1%,差异显著性依次为p53信号通路、减数分裂等。
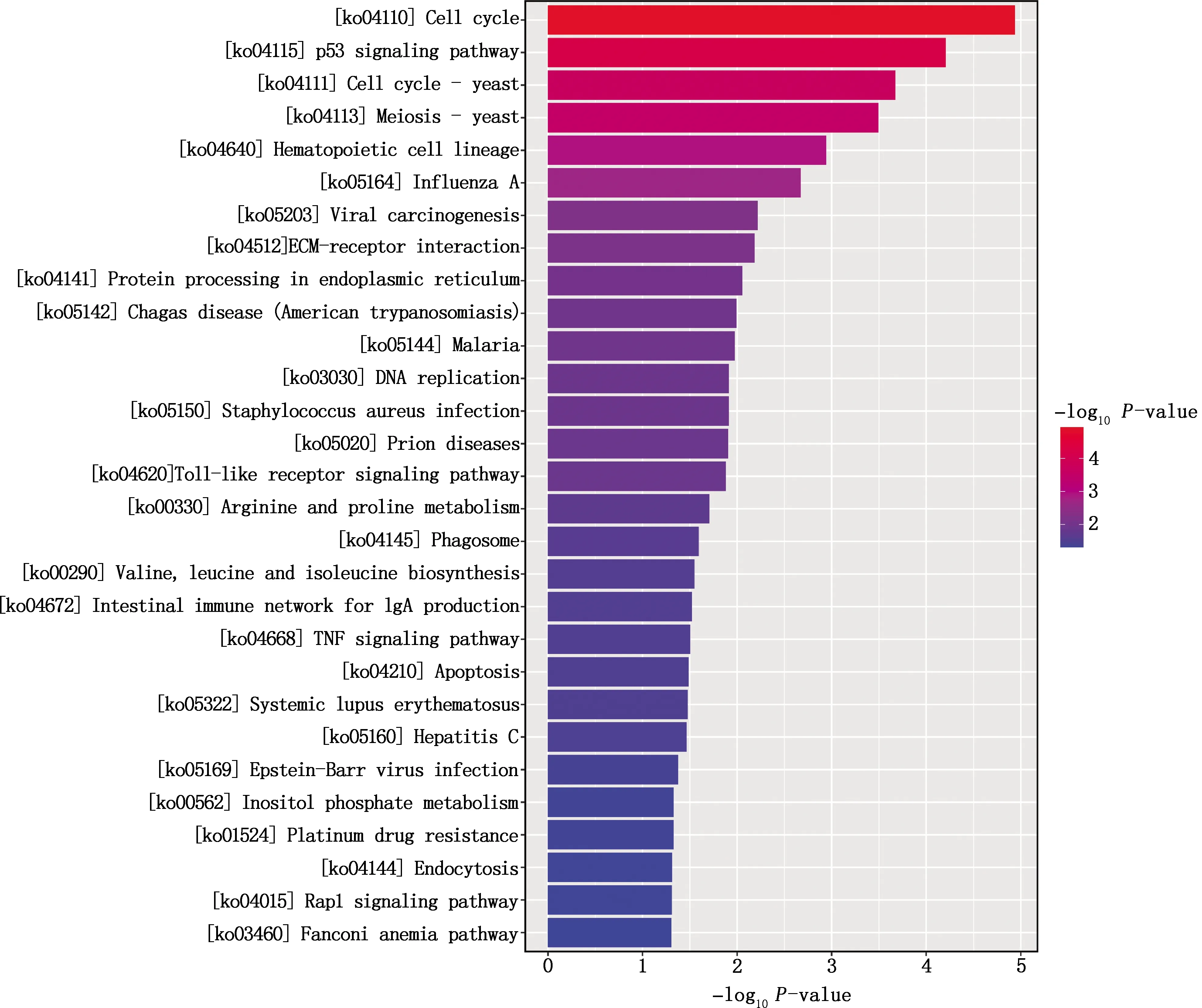
图5 KEGG通路功能分析
进一步分析发现,Toll样受体信号通路(Toll-like receptor signaling pathway)、TNF信号通路(TNF signaling pathway)、产生IgA的肠道免疫网络(intestinal immune network for IgA production)、甲型H1N1流感(influenza A)等与免疫应答反应、细胞凋亡等过程有关,其中,Toll样受体信号通路在这些通路中被显著富集。
2.5 Toll样受体信号通路调控网络分析
通过差异表达的lncRNA的KEGG信号通路分析发现Toll样受体通路显著富集,该通路共富集到靶基因22个,包括RIPK1、NFKBIA、TRAF3、PIK3CD、LY96、CXCL11、SPP1、MAPK8、IRAK1、IRF7、TLR3、MAP2K6、PIK3CB、TICAM1、TLR1、TLR6、PIK3CA、CCL4、CXCL10、CXCL9、TOLLIP、IFNAR1。lncRNA-ENSSSCG00000041959、lncRNA-ENSSSCG000000 37324、lncRNA-ENSSSCG00000049925、lncRNA-ENSSSCG00000048079共4个lncRNA(后续简写为lncRNA959、lncRNA324、lncRNA925、lncRNA079)是与Toll样受体信号通路相关的差异表达lncRNAs,具体信息见表4。经分析后发现多数靶基因与lncRNA959作用,lncRNA959位于6号染色体(P=0.00879),预测出lncRNA959通过反式调控靶基因RIPK1、IRAK1的表达,两者与lncRNA靶向调控的正确率分析高达0.97和0.99,初步鉴定出lncRNA959-RIPK1和lncRNA959-IRAK1可能是影响Toll样受体信号通路的lncRNA-mRNA调控网络。

表4 Toll样受体信号通路靶基因
2.6 差异表达lncRNAs的验证
为验证测序结果中获得的差异表达lncRNA结果的可靠性,对Toll样受体信号通路富集到的4个主要基因进行实时荧光定量RT-PCR分析,结果发现RNA-seq与实时荧光定量RT-PCR(qRT-PCR)基本一致(图6),说明测序结果较可靠。
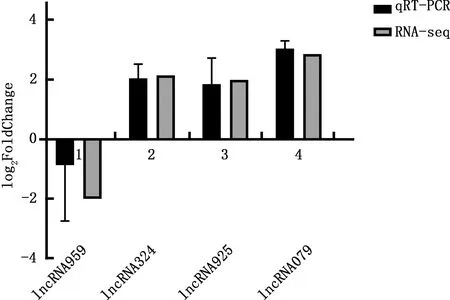
图6 4个差异表达lncRNAs的验证
3 讨 论
ASFV属于非洲猪瘟病毒科非洲猪瘟病毒属,为该科唯一成员。该病毒是唯一的DNA虫媒病毒,只感染猪,家猪和野猪尤为易感,感染后出现严重的临床症状,包括持续高烧、厌食、水样腹泻、皮肤潮红和运动失调等[13-15]。病理学上可见全身器官出血性病变,并伴有白细胞减少症和细胞因子风暴[16]。细胞因子在免疫反应、抗病毒作用等方面有着关键作用,调节先天和获得性免疫反应[17-18]。尽管目前对发病机理的认识不断加深,但ASFV诱发这些变化的具体机制仍有待进一步研究。
新一代高通量测序技术近几年得到快速发展并不断优化,在挖掘和鉴定lncRNA方面表现出巨大的优势。研究发现,非编码RNA在生物活动和病理过程(如病毒感染和肿瘤发生)中发挥重要作用[19],不仅对猪的各种性状具有调控作用,而且可影响某些疾病的发生发展[12],尤其是病毒宿主相互作用以及病毒增殖等过程[20]。Hao等[21]检测乙型肝炎病毒(HBV)感染相关lncRNAs的血浆水平发现,AP000253能促进肝癌细胞系中HBV的转录和复制,并可作为HBV感染的潜在生物标志物。Liu等[22]发现了参与调节抗病毒先天免疫反应的lncRNA-Malat1,通过RNA-RBP互作网络靶向TDP43激活来抑制抗病毒先天反应,增加了对先天反应和自身免疫发病机制的分子调控的认识。目前,有关ASFV感染后引起宿主mRNA和miRNA等差异表达谱已有报道,但ASFV感染后引起宿主lncRNA差异表达谱鲜有报道。根据先前的报道,急性ASF试验性感染在接种后7~10 d出现临床症状,可被视为感染晚期[10]。组织病理学评估显示疾病发生典型改变,如巨噬细胞浸润和细胞凋亡,以及ASF感染终末期的细胞因子风暴[23]。同时,本研究在试验过程中也发现在3~5 d开始表现食欲下降等临床症状,7 d左右出现运动障碍、食欲衰退和高热等症状。因此,本试验以ASFV感染7 d后的外周血淋巴细胞为研究对象,利用高通量测序技术成功构建了猪外周血淋巴细胞的lncRNA文库,去除低质量、受污染序列及<25 bp的小片段后,共获得Clean reads 504 387 798条,这些高质量数据不仅丰富了猪的RNA文库,同时为后续研究奠定了一定基础。经进一步统计学分析后得到73个差异表达lncRNAs,聚类热图显示,2组样本的基因表达量差别较大,存在明显的上调、下调。
利用GO数据库,将差异基因按照参与的生物过程、细胞组分、分子功能等分类富集分析,生物过程富集到调节免疫反应过程及先天性免疫,推测这些差异lncRNA可能通过模式识别受体识别特定病原体相关分子模式,启动先天免疫应答反应,从而诱导干扰素的表达。ASFV编码多种免疫逃逸蛋白以逃避宿主天然免疫系统,如MGF360、MGF505能抑制Ⅰ型干扰素(IFN-I)表达,同时抑制产生的抗病毒效应[24]。Jiang等[25]发现lnc-Lsm3b与病毒RNA竞争结合RIG-Ⅰ单体,限制RIG-Ⅰ蛋白的构象变化,阻止下游信号传导,从而终止IFN-Ⅰ的产生。IFN-Ⅰ诱导的lncRNA-ISIR反馈通过去除免疫反应中的抑制性Fli-1来增强IRF3的激活,揭示了lncRNA介导的转录因子激活的调节方法[26]。对于本研究中筛选到的差异lncRNAs调节先天性免疫需进一步验证。
差异表达lncRNAs靶基因的KEGG信号通路富集结果显示,Toll样受体信号通路、TNF信号通路、产生IgA的肠道免疫网络、甲型H1N1流感等通路显著富集。TLRs对病原体的识别通过诱导促炎细胞因子的产生和共刺激分子的上调,引起先天免疫的快速激活。通过MyD88依赖性途径进行TLR信号传导途径,导致促炎细胞因子的产生,并快速激活NF-κB和MAPK。Toll样受体在ASF感染过程中也发挥着重要作用[27]。Henriques等[28]发现一种新的ASFV蛋白pI329L可抑制Toll样受体3(TLR3)信号通路。ASFV编码蛋白A528R通过靶向p65激活和核转位抑制TLR8-NF-κB信号传导。I329L抑制dsRNA刺激的NFκB和IRF3的激活,I329L蛋白的表达也抑制了IFN-β和CCL5的激活。TRIF的过度表达逆转了I329L介导的NFκB和IRF3激活的抑制[29]。Yang等[30]在ASFV感染后的转录水平分析后发现,TLR4和TLR6是RLR途径的负调节因子,在ASFV感染期间呈显著下降趋势,本研究在参与Toll样受体信号通路的lncRNA靶基因中也发现了TLR1、TLR3、TLR6等因子,这表明ASFV感染可能激活了TLR和RLR信号通路。本研究发现,ASFV感染会导致外周血淋巴细胞Toll样受体信号通路显著富集,结合前期报道及研究,ASFV可能通过调控Toll样受体信号通路进而影响宿主免疫炎症反应。
4 结 论
本试验成功运用新一代高通量测序技术筛选出差异表达lncRNAs,并进行GO功能、KEGG通路富集分析,初步鉴定出lncRNA-ENSSSCG00000041959-RIPK1和lncRNA-ENSSSCG00000041959-IRAK1可能是影响Toll样受体信号通路的调控网络。预测lncRNA-ENSSSCG00000041959通过反式调控靶基因RIPK1、IRAK1的表达进而影响Toll样受体信号通路。
