γ-环糊精葡萄糖基转移酶的酶学性质及其产物特异性
2022-07-25陶志杰杨静文王清晨吴元元胡雪芹张洪斌
陶志杰,杨静文,王清晨,吴元元,胡雪芹,张洪斌*
1(蚌埠学院 食品与生物工程学院,安徽 蚌埠,233030)2(合肥工业大学 食品与生物工程学院,安徽 合肥,230009)
环糊精(cyclodextrin,CD)在自然界中主要由芽孢杆菌属细菌利用环糊精葡萄糖基转移酶(cyclodextrin glycosyltransferase,CGTase,EC2.4.1.19)催化淀粉而得到的不同聚合度的环状低聚葡萄糖[1-2]。CGTase属于糖基水解酶家族13,是一种具有4种催化反应的多功能酶,其中包含歧化、环化和偶联3个转糖基化反应和水解反应[3]。由于其转糖基活性远大于水解活性,被归属于转移酶类。该酶催化常见产物有6、7、8个葡萄糖基组成的α-、β-和γ-CD[4],以及更高聚合度的大环糊精[5-6]。环糊精结构呈“甜甜圈”状,具有内部疏水空腔和亲水表面,可以与客体分子形成包合物,由于这一独特的性质,CDs可以与广泛的固体、液体和气体化合物形成分子包合物(主客体复合物),提高了分子的稳定性、溶解性、反应性和生物利用度[7],在食品、医药、分析化学、农业等领域有着广泛的应用[8]。
β-CD产量高价格便宜,但溶解性差。γ-CD是一种备受关注的CD,因为它具有更大直径的空腔,这使得它可以与更大分子形成包合物。同时,它在25 ℃水中的溶解度是α-CD的1.6倍,更是β-CD的12.54倍,这有利于制备更高浓度的活性溶剂[9]。但由于其产量低、价格高,应用受到极大的限制。因此,获得新的CGTase对γ-CD的生产具有重要的科学意义和实用价值。
目前,用于合成γ-CD的主要微生物有Bacillussp.G-825-6[5]、Bacillusmacorous[10]、Bacillusthuringiensis[11]和Bacillusclarkii7364[12]等。由于野生菌种遗传背景复杂,不易调控且CGTase酶表达量低等缺陷,研究者们正通过基因工程技术构建高表达、高产物特异性的工程菌种。用于表达的系统主要有大肠杆菌、枯草芽孢杆菌[13]和毕赤酵母[14]表达系统,其中大肠杆菌是目前应用最广泛的CGTase表达系统[15]。已报道的γ-CGTase共有8种[16],来源不同的γ-CGTase存在产物特异性差异大、淀粉转化率低、产物中γ-CD占比低等不足,为后续γ-CD纯化带来不便。因此,γ-CGTase的自然筛选、分子改造以及催化工艺条件优化成为研究热点[17]。
本实验通过克隆来源于Bacillusclarkii7364的γ-CGTase基因,将其与pET28a(+)质粒连接,并转化到大肠杆菌(E.coliBL21)中进行表达。研究该酶的酶学性质和产物特异性,为获得γ-CGTase的工业化应用提供参考依据。
1 材料与方法
1.1 材料与试剂
菌株和质粒:E.coliDH5α、E.coliBL21(DE3)、质粒 pET28a(+)均为本实验室保存。
LB培养基(g/L):酵母提取物5,胰蛋白胨10,NaCl 10,121 ℃灭菌20 min。
主要试剂:质粒提取试剂盒、Fast Mutagenesis System试剂盒、胶回收试剂盒、蛋白定量试剂盒、蛋白纯化Ni-IDA Resin、FastPfu DNA 聚合酶、限制性内切酶BamHⅠ、XhoⅠ,北京全式金生物技术有限公司;胰蛋白胨、酵母抽提物,英国Oxoid公司;异丙基-β-D硫代半乳糖苷(isopropyl-β-D-thiogalactoside,IPTG),美国Sigma公司;硫酸卡纳霉素,上海雅吉生物科技有限公司;α-CD、β-CD、γ-CD标准品(色谱纯),上海生工生物工程有限公司;可溶性淀粉等均为国产分析纯或生化试剂,其他淀粉为食品级。
1.2 仪器与设备
ZHWY-2102恒温培养振荡器,上海智城分析仪器制造有限公司;DYY-5电泳仪,北京市六一仪器厂;TC-96/G/H(b)C PCR仪,杭州博日科技有限公司;Tanon 1600凝胶成像系统,安徽省鑫源祥生物技术有限公司;KS-150超声波细胞破碎仪,大庆仪器公司;Avanti J-E高速冷冻离心机,美国贝克曼库尔特公司;D-37520 1-14k小型离心机,德国Sigma离心机公司;Master touch-DUF超纯水制备仪,上海和泰仪器有限公司;示差折射率检测器,Shodexl永城仪器公司;X-Amide高效液相色谱柱,华谱科仪(北京)科技有限公司等。
1.3 实验方法
1.3.1 重组菌构建
通过NCBI查询获得来自于Bacillusclarkii7364的γ-环糊精葡萄糖基转移酶基因(NCBI登录号为BAH14968.1),由苏州金唯智生物科技有限公司完成基因合成。以合成的目的酶基因序列为模板设计引物,正向引物序列′-GAAACACGGATCCGCGACCCATTTGC-3′和反向引物序列5′-TTCGCCGCCTCGAGCACCACCACCACCACCACTGAGATCCGGCTG
CTAACAAA-3′,以pET-28a(+)为载体,得到连接产物pET-28a(+)-γ-CGTase转化至E.coliDH5α感受态中,提取质粒酶切和测序验证。将测序正确的重组质粒通过热转化法转入到大肠杆菌感受态细胞BL21(DE3)内,最终获得E.coliBL21/pET28a(+)-γ-CGTase重组基因工程表达菌株。
1.3.2 酶蛋白表达
将构建好的重组菌株E.coliBL21/pET28a(+)-γ-CGTase和对照菌株E.coliBL21/pET28a(+)分别以2%(体积分数)接种量接种于100 μg/mL卡那霉素的LB液体培养基中,在37 ℃、220 r/min条件下培养至OD600达到1.8~2.0后,加入终浓度为0.3 mmol/L的IPTG诱导,于25 ℃、200 r/min环境中表达培养8 h。在4 ℃、8 000 r/min的条件下离心15 min获得菌体,用0.05 mol/L甘氨酸-氢氧化钠(pH 10)洗涤细胞。将重悬菌液于冰浴中超声波破碎15 min,于4 ℃、6 000 r/min离心15 min获得粗酶液,用于后续实验。
1.3.3 酶蛋白分离纯化
将粗酶液用镍亲和凝胶柱纯化,分别收集80~200 mmol/L咪唑洗脱液。选择最佳咪唑洗脱浓度洗脱,洗脱液用5 000 Da透析袋透析24 h去除咪唑等杂质,收集透析酶液。随后用聚乙二醇进行酶液浓缩,得到纯化酶液。采用SDS-PAGE和Bradford法进行酶分子质量、酶蛋白浓度测定,计算每步纯化后比活力和活力回收率。
1.3.4 酶活力测定方法
该酶有环化、耦合、歧化、水解反应,而环化能力是该酶的主要特性,为了分析酶催化机制,因此测定该酶的γ-环化活力和水解活力。
1.3.4.1 酶水解活力测定
参照花敬涵[18]蓝值法略有改动。取稀释酶液10 μL加入200 μL质量分数为0.2%的可溶性淀粉溶液,在40 ℃,pH 10.0的甘氨酸-氢氧化钠缓冲液中反应10 min后,加入0.5 mol/L的冰乙酸500 μL结束反应,最后加入质量分数为0.005%的碘液3 mL显色,样品在700 nm下测定吸光度(以等量缓冲液代替淀粉溶液为空白对照),酶活力计算如公式(1)所示:
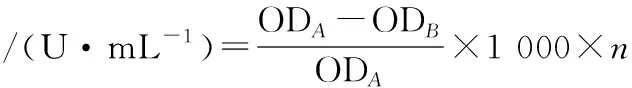
(1)
式中:ODA,未加酶液吸光度;ODB,加入酶液吸光度;n,稀释倍数。
一个酶活力单位定义为使吸光度下降10%的酶量。
1.3.4.2 γ-环化活力测定
反应条件:1 mL质量分数为2%淀粉,10 μL酶液,pH 10,40 ℃,催化30 min。反应结束,沸水热烫5 min,12 000 r/min离心10 min后去除沉淀,吸取上清液过0.22 μm滤膜,HPLC法检测并用外标法计算产量。
色谱条件:液相检测器为示差折射率检测器,X-Amide 酰胺色谱柱(4.6 mm×250 mm);色谱柱温度为25 ℃,流动相是体积分数为65%乙腈/蒸馏水,流速1.0 mL/min,进样量20 μL。
酶活力单位定义:1 min生成1 mg γ-CD所需加酶量为1个酶活力单位(U)。参照郑丹妮等[16]的方法。
标准曲线测定:精密称取0.50 g γ-CD标准品,以蒸馏水将其定容于25 mL容量瓶中,配制成20 mg/mL的母液。分别用蒸馏水稀释至γ-CD终质量浓度为2、4、6、8、10、12、14、16、18、20 mg/mL的梯度溶液,使用上述HPLC条件检测,以标准品浓度为横坐标,HPLC得到的γ-CD峰面积为纵坐标,通过Origin软件线性分析得出标准曲线方程。得回归线性方程Y=244 890X+40 766(R2=0.999 2),线性范围为2~20 mg/mL。在此范围内,γ-CD含量与峰面积呈正相关。
1.3.5 γ-CGTase最适温度及温度稳定性测定
最适温度:将酶反应温度设置在35~80 ℃,按1.3.4的方法操作,测定酶的最适温度。将最大相应酶活力定为100%,分别计算相对酶活力。
温度稳定性:将酶置于不同温度下孵育,隔不同时间测定相应酶活力。将初始酶活力定为100%,分别计算相对酶活力,考察该酶γ-环化与水解活力的温度稳定性。
1.3.6 γ-CGTase最适pH及pH稳定性测定
最适pH:该酶来自于碱性芽孢杆菌,因此本实验设计考察pH为7~13。配制0.05 mol/L 甘氨酸-氢氧化钠缓冲溶液,利用pH计调节各个缓冲液。用不同pH缓冲液配制2%(质量分数,下同)可溶性淀粉为底物溶液,测定酶活力。将最大酶活力定为100%,分别计算相对酶活力。
pH稳定性:配制0.05 mol/L pH 4~13的缓冲溶液(pH 4~7乙酸-乙酸钠缓冲液,7~13甘氨酸-氢氧化钠缓冲液),纯化酶用不同pH缓冲液稀释,于4 ℃冰箱保存1、24 h,测定酶活力,24 h与1 h酶活力之比,计算保留酶活力,考察该酶γ-环化与水解活力的pH稳定性。
1.3.7 金属离子对γ-CGTase酶活力影响
用超纯水分别配制50 mmol/L的NH4Cl、NaCl、KCl、CaCl2、MgCl2、NiCl2、CuSO4、BaCl2、MnSO4、ZnCl2、FeCl3、Al2(SO4)3和EDTA溶液,稀释至使其在酶促反应中终浓度为1 mmol/L,测定酶活力,以等量超纯水代替金属离子液为对照100%,计算相对酶活力,比较上述金属离子对酶活力的影响。
1.3.8 动力学参数测定
以可溶性淀粉为底物,利用双倒数法Lineweaver-Burk测定γ-CGTase反应动力学参数。测量0.4%~2%不同底物质量分数溶液下γ-CGTase的γ-环化活力。酶反应动力学曲线用纵坐标(1/υ)横坐标(1/[S])作图,即可得到酶反应动为学参数。
1.3.9 乙醇体积分数对γ-CD产量的影响
以2%可溶性淀粉为底物,酶添加量为3.35 U/g(环化酶活力/干淀粉),终体积分数为0、5%、10%、15%、20%、25%的乙醇,在50 ℃、pH 10的条件下催化6 h,HPLC法测定产物。
1.3.10 底物种类对产物特异性影响
分别配制2%葛根淀粉、木薯淀粉、小麦淀粉、豌豆淀粉、玉米淀粉和可溶性淀粉为考察对象。
反应体系:1 mL 2%不同种类的糊化淀粉为底物,酶添加量为3.35 U/g(环化酶活力/干淀粉),50 ℃,pH 10,反应6 h。反应结束,沸水热烫5 min,12 000 r/min 离心5 min,过膜,检测γ-CD。
1.3.11 数据分析及处理
每组平行测定3次,标准偏差以误差线的形式表示,利用Origin软件对结果进行统计分析并作图。
2 结果与分析
2.1 E.coli BL21/pET28a(+)-γ-CGTase重组菌株构建与表达
2.1.1 重组菌株构建
将PCR扩增的γ-CGTase基因与载体pET28a(+)片段用无缝克隆技术与相同酶切位点的载体pET28a(+) 相连接,通过42 ℃热击转化感受态E.coliDH5α细胞。经菌落PCR验证并提取转化子的质粒分别用限制性内切酶XhoⅠ和BamHⅠ进行双酶切验证。结果与理论片段大小相符,表明重组菌株E.coliBL21/pET28a(+)-γ-CGTase构建成功。
2.1.2 γ-CGTase的表达与纯化
重组菌株在25 ℃、200 r/min、终浓度为0.3 mmol/L的IPTG条件下诱导8 h,可达到蛋白可溶性表达。图1-a中,在加0.3 mmol/L IPTG诱导剂重组菌株破碎细胞上清液中明显可以看到70 kDa处有目的蛋白表达,与预测蛋白大小(78 kDa)一致。
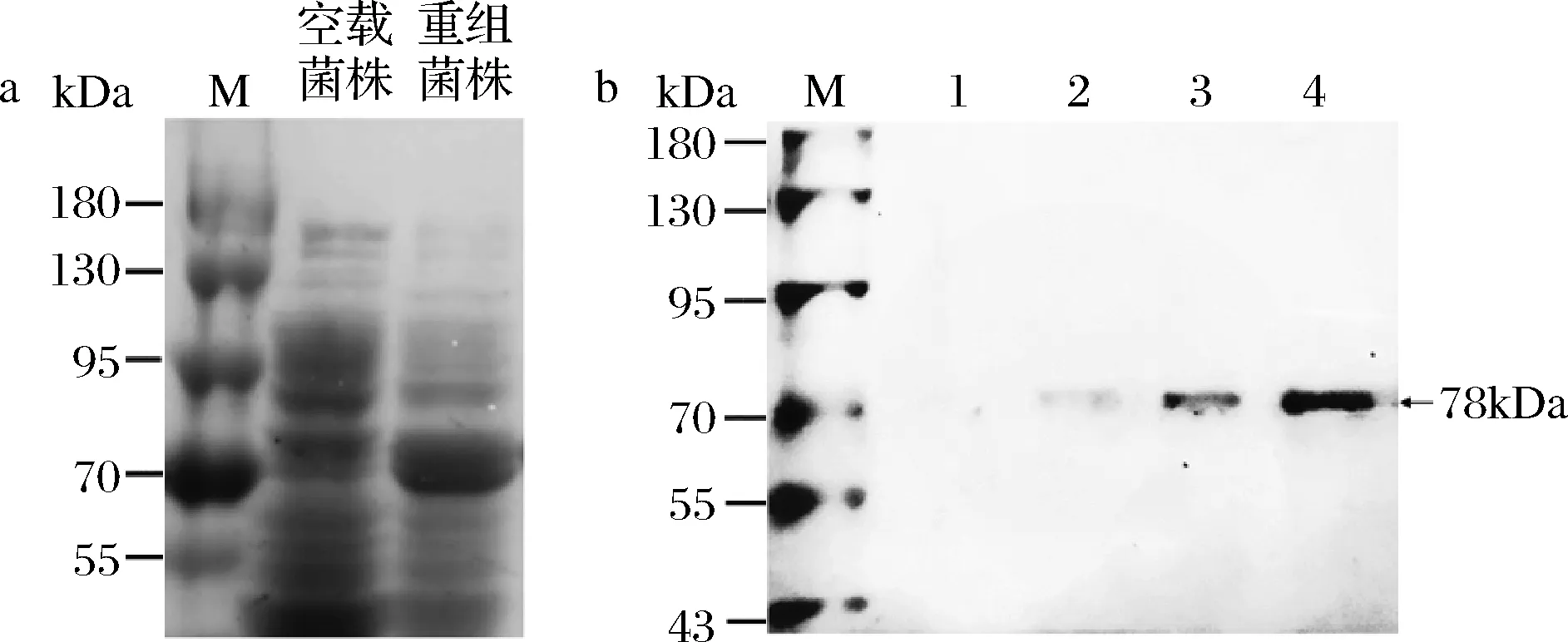
M-蛋白质Marker,1~4-80、120、160和200 mmol/L咪唑洗脱液a-重组菌蛋白表达;b-重组菌γ-CGTase纯化图1 重组菌产酶SDS-PAGE分析Fig.1 SDS-PAGE analysis of recombinant becteria production
由图1-b可知,在70 kDa Marker附近处有唯一条带,γ-CGTase由702个氨基酸组成,分子质量约为78 kDa,与理论值一致。200 mmol/L咪唑为最佳洗脱浓度,通过逐步纯化得到纯化酶,测定结果见表1(水解活力)。细胞破碎离心得到的上清液为粗酶液,由于是细胞内表达,会含有较多的宿主蛋白。通过Ni-NTA亲和层析纯化,γ-CGTase蛋白上含有6×His标签,可以有效去除杂蛋白,但由于亲和结合达饱和,也会使γ-CGTase蛋白未能充分结合而丢失,导致纯化后活力回收率低。透析可以有效去除咪唑等小分子物质,再通过聚乙二醇脱水浓缩,使得酶活力回收率基本保持无损失。
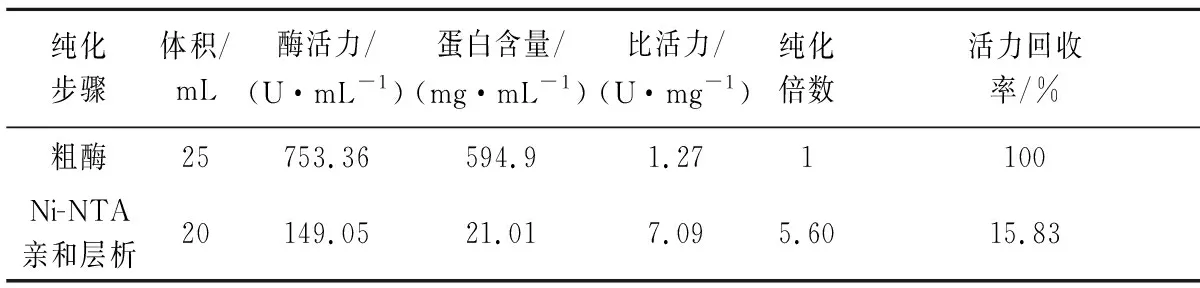
表1 γ-CGTase蛋白纯化Table 1 The purification of the γ-CGTase
2.2 γ-CGTase的酶学性质
2.2.1 温度对酶活力的影响
2.2.1.1 γ-CGTase的最适温度
γ-CGTase具有环化、耦合、歧化、水解4种催化功能,环化功能是其主要功能。从图2可知,γ-CGTase的水解最适温度比γ-环化最适温度范围窄。随温度升高酶水解活力增强,当65 ℃时达到最大活力,随着温度上升酶活力急剧下降。而γ-CGTase的γ-环化活力的最适温度范围较宽,60 ℃为最适温度,40~65 ℃均有较高的酶活力,相对酶活力保持在近90%或以上。
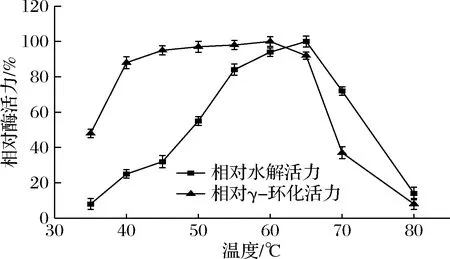
图2 γ-CGTase的最适温度Fig.2 The optimal temperature of the γ-CGTase
2.2.1.2 γ-CGTase的温度稳定性
由图3可知,γ-CGTase的水解热稳定性比γ-环化稳定性弱。40 ℃时,该酶的水解活力在8 h为63%,而γ-环化活力仍保持在95%以上。50 ℃时,水解活力8 h已达半衰期,而γ-环化活力仍保持在60%左右。随着温度再次升高,两种活力均出现下降,但在高温条件下γ-环化活力的衰退速度比水解活力衰退得慢。由此可得出,γ-CGTase的γ-环化活力热稳定性比水解活力强。

a-水解热稳定性;b-γ-环化热稳定性图3 γ-CGTase的水解和γ-环化热稳定性Fig.3 The temperature stability of the hydrolysis and cyclization activity of the γ-CGTase
2.2.2 pH对酶活力的影响
2.2.2.1 γ-CGTase的最适pH
pH对酶的催化活性有较强影响。由图4可知,γ-CGTase的水解最适pH比γ-环化最适pH偏碱。γ-CGTase的水解最适pH为12,在pH 11~13有较稳定的水解活力,而γ-CGTase的γ-环化最适pH为10,pH对γ-环化活力的影响比水解活力大。
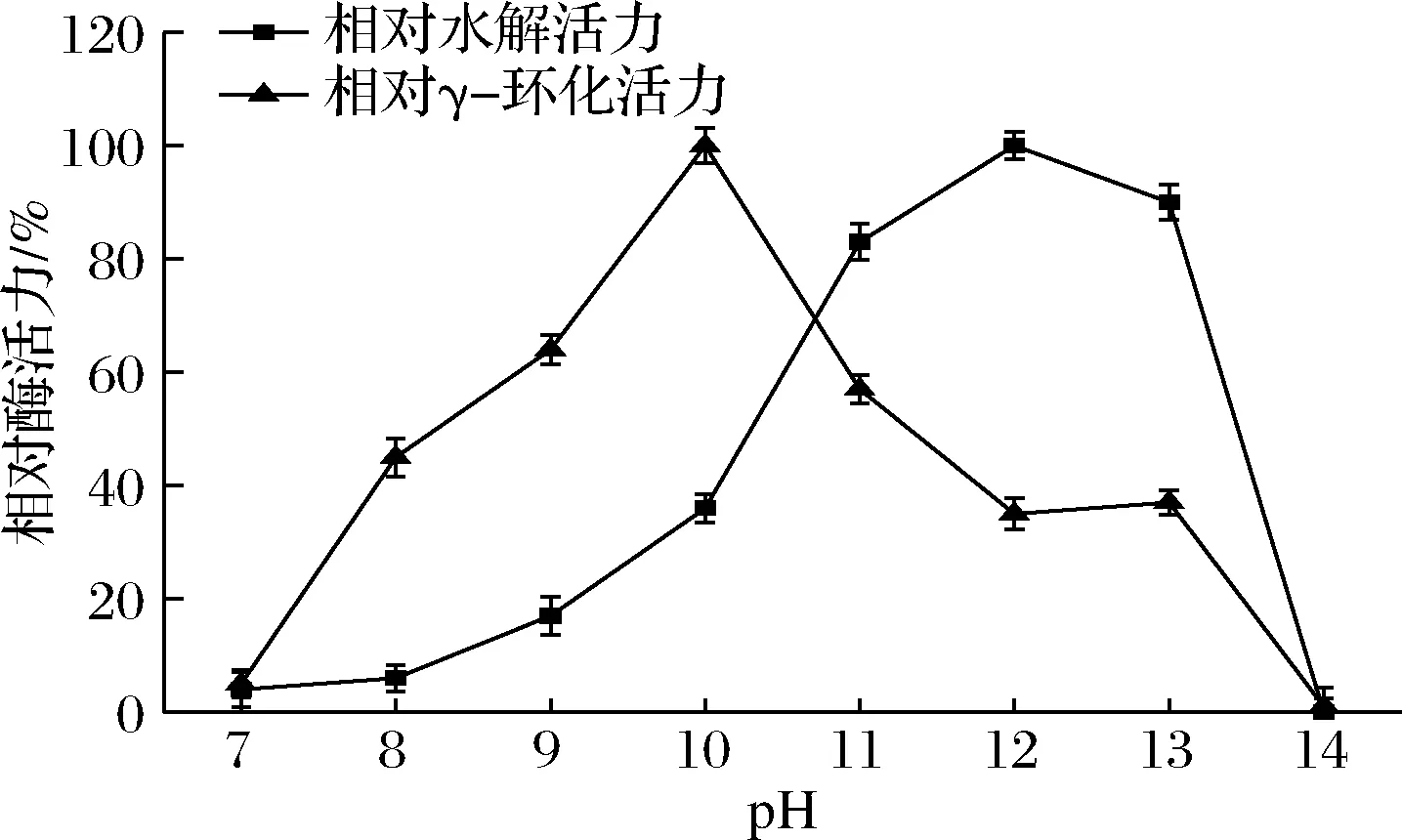
图4 γ-CGTase的最适pHFig.4 The optimal pH of the γ-CGTase
2.2.2.2 γ-CGTase的pH稳定性
γ-CGTase属于碱性酶。由图5可知,在pH>6环境中有较好的稳定性,24 h后两种酶活力仍可保留在60%以上。当pH低于5时,明显可见酶蛋白出现沉淀,活力急剧下降,水解活力基本消失。经软件分析,该酶的pI为4.59,因此出现蛋白质沉淀现象,与测算结果表现一致。γ-CGTase水解活力最高稳定条件在pH 11~13,γ-环化活力最高稳定条件在pH 9~10,两者存在差异。因此该酶催化的最佳pH(环化活力)为9~10,符合碱性芽孢杆菌来源酶的特性。
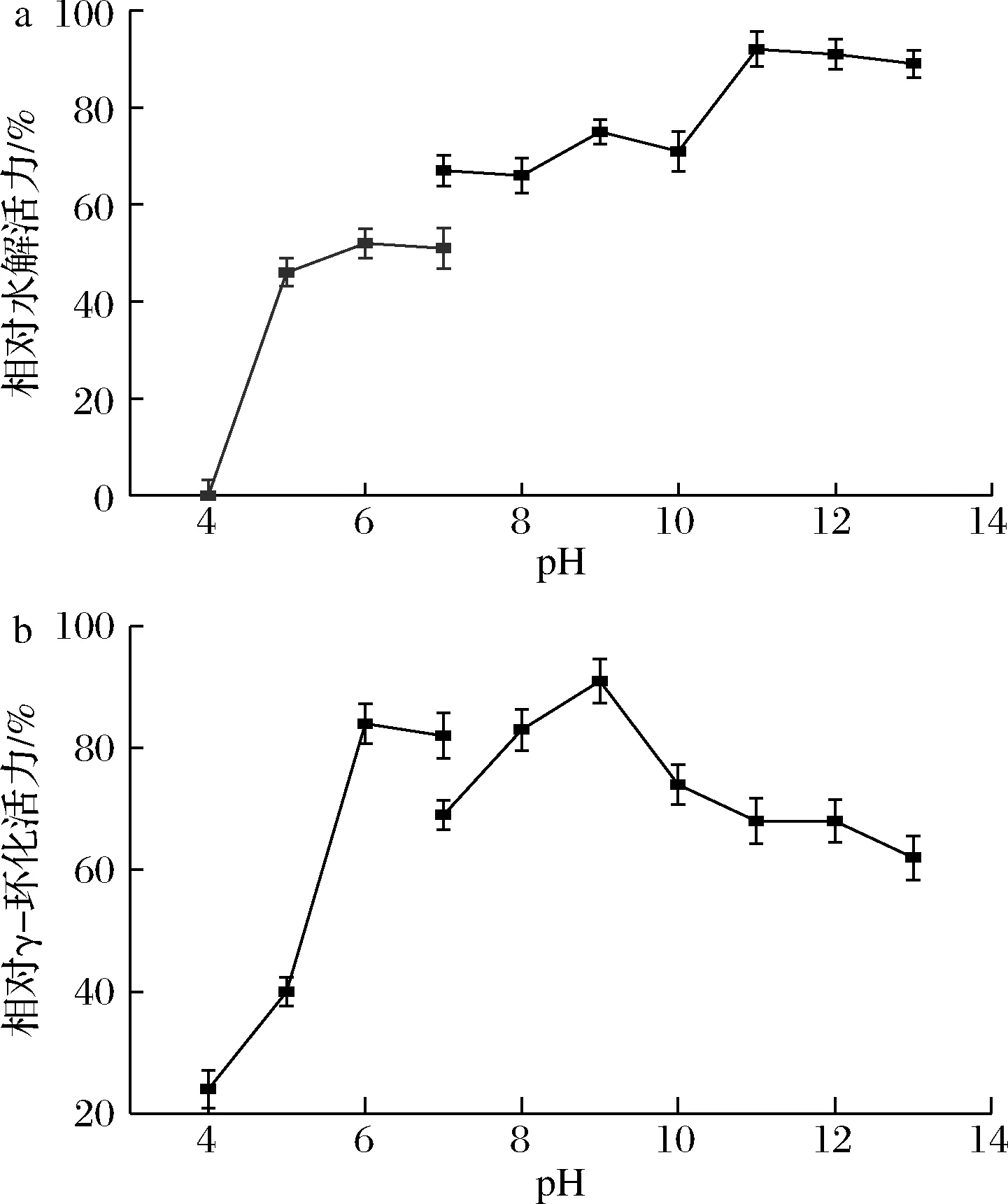
a-水解pH稳定性;b-γ-环化pH稳定性图5 γ-CGTase的水解和γ-环化pH稳定性Fig.5 The pH stability of the hydrolysis and cyclization activity of the γ-CGTase
2.2.3 金属离子对酶活力影响
不同金属离子对γ-CGTase活力的影响见图6。金属离子Ca2+、Mg2+对该酶的两种酶活力均有促进作用,提高约10%的酶活力,Zn2+、Mn2+和Al3+对该酶的水解活力有明显的抑制作用,使该酶水解活力丧失20%~40%不等,而对γ-环化活力影响较小。Ca2+激活作用主要是因为γ-CGTase也属于α-淀粉酶家族中的成员。

a-金属离子对γ-CGTase的水解活力影响;b-金属离子对γ-CGTase的γ-环化活力影响图6 金属离子对γ-CGTase酶活力影响Fig.6 Effect of metal ions on the enzyme activity of the γ-CGTase
2.3 酶动力学参数测定
以γ-环化活力为依据,进行测定计算。米氏常数(Km)和最大反应速率(Vmax)是酶非常重要的动力学参数。从Km可以判断底物和酶的亲和关系,Vmax可以判断出酶的催化效率。通过计算,该酶的Km为(50.42±2.45) mg/mL,Vmax为(1.36±0.68) mg/(mL·min)。与郑丹妮等[16]研究的来源于Bacillussp. FJAT-44876动力学参数相比,Vmax值较高,说明该酶催化能力较强。
2.4 乙醇体积分数对γ-CD产量的影响
适合的乙醇体积分数对环糊精葡萄糖转移酶有促进作用,不仅可以提高目标产物的产量,也可以提高产物专一性。图7中α-CD、β-CD和γ-CD标准品的质量浓度均为10 mg/mL。由图可知,该酶产物中没有α-CD,主产γ-CD。10%乙醇体积分数的反应体系,不仅γ-CD产量增加了89.91%,而且γ-CD/β-CD由7.70提高至13.38,增大了73.77%,使得γ-CD的合成比率达到93.05 %。因此,乙醇对该酶也具有提高产物产量和增强特异性效果。
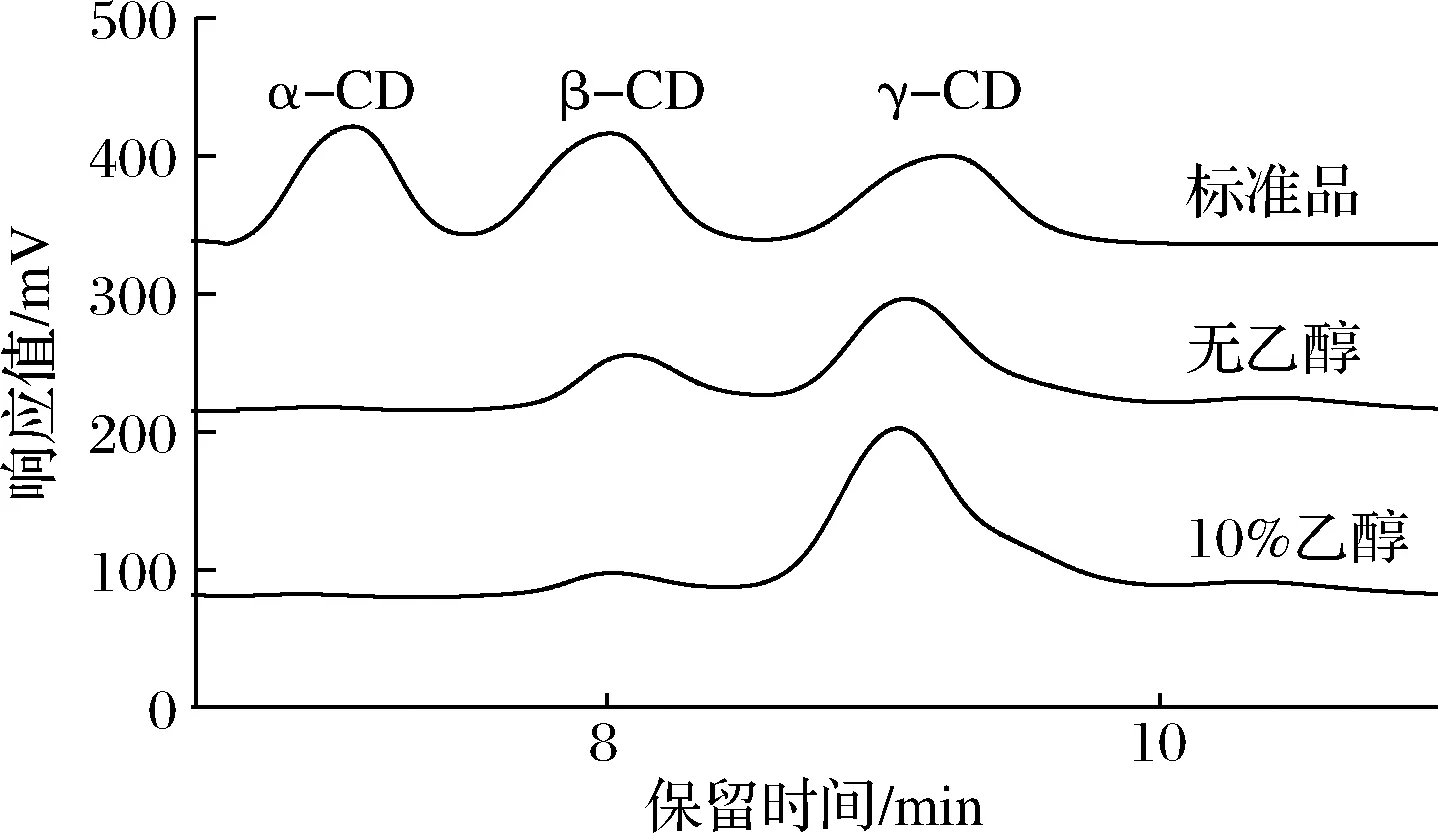
图7 乙醇对γ-CGTase催化产物特异性的影响Fig.7 Effect of ethanol on enzyme catalytic specificity of γ-CGTase
不同的环糊精葡萄糖基转移酶对乙醇体积分数要求不同,郑丹妮等[16]研究Bacillussp.FJAT-44876来源的γ-CGTase最佳乙醇体积分数为10%,花敬涵[18]研究的Bacilluscereus来源的β-CGTase最佳乙醇添加量为25%,换算乙醇体积分数应为20%。如图8可见,随着乙醇体积分数增加,γ-CD产量增加,当乙醇体积分数达到15%时,产量达最大值。随着乙醇体积分数增加,淀粉的溶解度受到影响,降低了淀粉利用度。原因如同王亮等[19]的解释,乙醇可提高酶的催化效率,添加适量的乙醇可以增加CGT酶与淀粉的结合位点提高其环化作用的效率,同时减少酶表面的水分含量或受体分子的量来阻碍CGT酶对CD的降解,对于偶合反应和水解反应起到一定的抑制作用,最终使CD的产率得到提高。
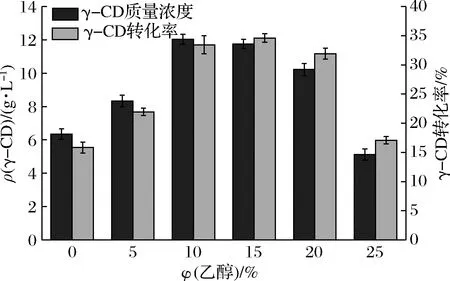
图8 乙醇体积分数对γ-CGTase催化产物γ-CD产量影响Fig.8 Effect of ethanol concentration on the γ-CD production of the γ-CGTase
2.5 底物种类对产物特异性影响
由图9可知,γ-CGTase催化不同淀粉的产物特异性不同。以豌豆淀粉为底物,得到的γ-CD/β-CD为12.92,且γ-CD转化率最高19.10%。与可溶性淀粉相比,可溶性淀粉的γ-CD/β-CD是7.92,γ-CD转化率是15.54%,分别提高了63.13%和22.90%。其次是木薯淀粉、葛根淀粉和小麦淀粉均比可溶性淀粉和玉米淀粉的γ-CD转化率高。而γ-CD/β-CD与γ-CD转化率并不一致,葛根淀粉≈木薯淀粉>豌豆淀粉≈玉米淀粉>小麦淀粉≈可溶性淀粉。因此,不同淀粉的组成和结构对γ-CGTase催化产物特异性有较大影响。

图9 不同淀粉催化后γ-CD转化效果比较Fig.9 Comparison of conversion effects of γ-CD from different starches
MATIOLI等[20]以麦芽糊精、大米、马铃薯、木薯、玉米淀粉为底物,结果表明玉米淀粉是生产γ-CD的最佳底物。王磊[21]比较了玉米、马铃薯、木薯和可溶性淀粉,结果表明马铃薯淀粉与可溶性淀粉优于其他淀粉。王金鹏等[22]同样对比了玉米、马铃薯、木薯和可溶性淀粉,结果却显示木薯淀粉>玉米淀粉>马铃薯淀粉>可溶性淀粉。这些差异主要与γ-CGTase酶和不同淀粉颗粒作用方式不同有关。BENAVENT-GIL等[23]通过研究CGTase酶催化玉米和马铃薯淀粉作用机理,发现玉米淀粉和马铃薯淀粉水解导致颗粒表面不同,玉米淀粉表面有序性和结晶度低,从而更有利于CGTase酶对玉米淀粉的催化作用。关于不同淀粉与CGTase酶的催化效果尚存在争议,应从不同淀粉组成与结构上分析酶催化机制。
3 结论
本研究克隆来源B.clarkii7364的γ-CGTase基因并构建了1株E.coliBL21/pET28a(+)-γ-CGTase 重组菌。经IPTG诱导镍柱纯化,SDS-PAGE测得γ-CGTase分子质量为78 kDa,其水解与环化活力趋势相同,但存在差异。水解酶的活力测定方法快速简便,可以用于酶活力表达测试。γ-CGTase的环化活力比水解活力高,且温度稳定性强,而适碱性则水解活力比环化活力高,环化活力最适条件为9~10。该酶催化各种淀粉产物中几乎无α-CD,主产物为γ-CD,属于γ-CGTase。乙醇对该γ-CGTase具有提高催化效率、增强产物特异性作用,10%乙醇体积分数可提高γ-CD产量89.91%,γ-CD/β-CD提高73.77%,使得γ-CD的合成比率达到93.05%。不同淀粉做催化底物,制备γ-CD的能力有较大差异。综合比较,豌豆淀粉表现出较明显优势,γ-CD纯度较高且转化率明显高于其他淀粉。虽然通过添加有机溶剂和筛选底物可以有效提高γ-CD产量和质量,但是γ-CD转化率低仍然是实验中存在的主要问题。后续可通过进一步优化催化条件,提高γ-CD转化率,为酶法制备γ-CD提供科学的参考依据。
