乳腺癌骨转移临床诊疗专家共识
2022-07-23中国抗癌协会骨肿瘤和骨转移瘤专业委员会
中国抗癌协会骨肿瘤和骨转移瘤专业委员会
近年来, 我国肿瘤发病率以及死亡率呈逐年升高趋势,自2010年起,肿瘤已经成为首要死亡原因[1]。乳腺癌是影响女性健康的首要恶性肿瘤,据不完全统计,2018年全球确诊超过210万例,死亡约63万例[1-2]。在我国,其发病率和死亡率分列女性恶性肿瘤第1位及第5位,人口标化率分别为31.54/10万及6.67/10万,年均新发病例约26.86万例,因病死亡6.95万例[3]。骨骼是乳腺癌最常见的远处转移部位,约占所有转移性乳腺癌患者的60%~75%[2,4]。研究发现激素受体阳性型乳腺癌更易发生骨转移[2]。乳腺癌骨转移是乳腺癌发展的特殊阶段,治疗方案的选择存在一定困难。乳腺癌骨转移的诊疗提倡多学科共同协作(multiple disciplinary treatment,MDT),合理而有计划的为患者制定个体化的综合治疗方案,治疗目的是为了缓解症状,减缓肿瘤进展,改善患者生存质量,延长生存时间[2]。本专家共识基于循证医学证据,力求为乳腺癌骨转移的临床诊疗提供帮助与指导。
1 乳腺癌骨转移的临床表现
乳腺癌骨转移在临床上多表现为单发或多发的溶骨性病变,少数患者表现为溶骨成骨混合性病变。骨转移灶破坏骨的生理结构与机械强度,常伴有中重度骨痛,严重者可发展为病理性骨折。骨转移灶形成的软组织包块可对周围重要神经血管形成压迫,导致肢体局部功能丧失。骨痛、病理性骨折、脊髓压迫及高钙血症等骨相关事件(skeletal-related events,SREs)的出现,严重影响患者的自主活动能力及生存质量[4]。
2 乳腺癌骨转移评估与诊断方法
对疑似乳腺癌骨转移患者应进行充分的治疗前评估。包括病情评估、预期生存评估、影像学评估、病理学及生物化学标志物评估。对既往有乳腺癌病史且出现或可能出现骨相关事件的患者推荐进行下述检查:
2.1 影像学评估
1)骨放射性核素显像(emission computed tomography,ECT):为骨转移筛查的最常用方法。具有敏感性高、全身显像不易漏诊的优点[5]。但同时也存在特异性较低,不能显示骨破坏程度等问题,需与其他检查联合使用。故常推荐用于出现骨痛、病理性骨折、碱性磷酸酶升高或高钙血症等可疑骨转移的乳腺癌患者的筛查,以及诊断为乳腺癌骨转移患者的常规复查手段。检查结果方面,绝大部分乳腺癌骨转移病灶均表现为局部核素摄取增加。对于骨放射性核素显像提示异常的乳腺癌患者,应进一步针对可疑部位进行X线、CT或MRI检查,以明确病变性质。
2)X线:X线检查是诊断乳腺癌骨转移的最基本和最主要的方法,应与临床症状和ECT结合使用。通过对ECT识别的重点区域行X线检查,可以明确病变具体位置和与周围骨与关节的关系。X线检查特异性较高,但敏感性较低,难以发现早期转移灶[5]。乳腺癌骨转移在X线上常表现为溶骨性破坏,但也可见成骨性或混合性病变。通过X线检查可识别骨破坏性质,发现病理性骨折,以及评估病灶发生病理性骨折的风险等。
3)计算机断层扫描CT:CT较X线的敏感性和特异性均更高。对病变部位进行CT检查可以进一步明确病变和相邻组织关系,对判断皮质骨破坏范围及程度较有帮助,尤其适用于复杂解剖部位的转移灶。增强CT扫描可用于判断病变血供情况,并显示病变与周围神经、血管结构的关系,为外科治疗提供帮助。
4)磁共振成像MRI:MRI对诊断乳腺癌骨转移的敏感性更高,能更准确地显示病灶侵犯部位、范围及周围软组织侵犯情况,明确病变与周围软组织和重要神经血管关系,是评价乳腺癌骨转移骨髓内浸润的首选工具[5]。同时对于位于脊柱的转移性病灶,MRI在判断病变范围,脊髓及神经受累及情况具有突出优势。
5)正电子发射计算机断层扫描(positron emission tomography-computed tomography,PET-CT):PET-CT对于骨转移诊断的敏感性和特异性均高于骨放射性核素显像,可以反映肿瘤细胞的代谢水平,同机CT可以辅助精确定位且全身显像,是相对于骨放射性核素显像更有效的乳腺癌骨转移筛查工具 。另一方面,目前PET-CT所常用的示踪剂18F-FDG易富集于溶骨性及骨髓浸润病变,适合乳腺癌骨转移的成像需求,是乳腺癌骨转移疗效评估和病情跟踪的良好手段。
2.2 病理学评估
乳腺癌患者骨病灶的组织病理学检查是诊断乳腺癌骨转移的金标准。如果临床上可行,应积极对可疑骨病灶进行组织学检查以明确诊断,尤其是首次出现的可疑转移灶和单发骨病灶。如组织病理学确诊为乳腺癌骨转移,应同时对转移灶的分子分型进行判断。尤其在治疗反应不符合原发灶肿瘤分子分型特点,及原发病灶分子分型不明确的患者中更为重要。有研究发现,乳腺癌骨转移患者原发灶和转移灶中存在相当比例雌激素受体及Her-2表达不一致情况,为肿瘤系统性治疗带来困扰[6]。
乳腺癌可疑骨转移病灶的组织病理学检查应遵循肌肉骨骼系统肿瘤活检取材的原则,对于特殊解剖部位可在影像学引导下进行。活检方式主要有粗针穿刺活检和切开活检。活检前应完善患处CT或MRI扫描,以进行全面的术前规划,尽量避开坏死区域,选取活跃溶骨性区域取材。原则上应避开重要血管神经束,穿过最少的组织解剖学间室。取材量应满足常规组织病理学及分子病理学诊断的要求。
2.3 分子生物学评估
1)骨代谢的生物化学标志物:可反映骨转移过程中骨吸收和形成的速度,提示骨破坏和修复程度,是评价治疗反应的辅助指标。主要有反映溶骨代谢水平的标志物,包括Ⅰ型胶原α1羧基末端肽(C-terminal telopeptide of type I collagen,CTX)、Ⅰ型胶原羧基末端肽(carboxyterminal propeptide of type Ⅰ procollagen,ICTP)、Ⅰ型胶原N末端肽 (N-telopeptide of type I collagen,NTX)、骨唾液蛋白(bone sialoprotein,BSP)等。另一方面是反应成骨性代谢水平的标志物,主要有骨特异性碱性磷酸酶(bone alkaline phosphatase,BALP)、ALP、Ⅰ型溶胶原N末端肽(procollagenⅠ N-terminal propeptide,PINP)等[7]。
2)药物靶点检测:不能作为骨转移诊断的方法。仅在相关靶向药物可及的情况下,为治疗困难,进展迅速的特殊类型乳腺癌骨转移患者提供挽救治疗思路。如针对三阴性乳腺癌患者进行PD-L1,BRCA等表达水平检测等。
2.4 生存质量评估
乳腺癌骨转移瘤的治疗多为姑息性,提高或维持患者的生存质量是各方共识。应注重患者的主观感受,强调患者进行自我评价(patient-reported outcome,PRO)的意义。欧洲癌症研究与治疗组织(EORTC)提出的QLQ-BM22和QLQ-C30量表,在我国经过了效度、信度、跨文化适应性的验证,可作为评估乳腺癌骨转移患者生存质量的一份有效量表[8]。
2.5 乳腺癌骨转移诊断
乳腺癌骨转移指临床或病理诊断为乳腺癌的患者,骨病变组织病理学检查符合乳腺癌转移。对于既往乳腺癌病理诊断明确,且具有典型骨转移影像学表现的病例可临床诊断为乳腺癌骨转移。
3 乳腺癌骨转移的治疗
3.1 治疗目标
乳腺癌骨转移的治疗目标包括下述几点:缓解疼痛、恢复功能、控制肿瘤进展、预防及治疗骨相关事件、改善患者生存质量。
3.2 治疗原则
乳腺癌骨转移作为一种终末期全身性恶性疾病,治疗应以全身治疗为主。其中,内分泌治疗、化疗、抗HER-2药物治疗为复发转移性乳腺癌的基本治疗方式,新型靶向治疗如PARP抑制剂、Trop2靶点的抗体藕联药物、CDK4/6抑制剂、PI3K/mTOR通路抑制剂等在特定患者中显示出较好的疗效,免疫治疗如免疫检查点抑制剂PD-1、PD-L1和CTLA4在乳腺癌特别是三阴性乳腺癌中显示处一定疗效,双磷酸盐及地舒单抗可用于预防和延缓骨相关事件的发生、发展。合理的局部治疗可以更好地控制骨转移相关症状,手术和放疗是骨转移局部治疗的有效手段。此外,完善的疼痛管理和关怀支持治疗不可或缺,可以明显改善患者的生存质量,治疗流程见图1。治疗方案的选择应充分考虑患者年龄、一般状态、月经状况、原发灶和转移灶的激素受体状态和HER-2状态、既往治疗情况(疗效、不良反应、耐受性等)、无病间期、肿瘤负荷(转移部位和数量)等因素,并应根据患者症状严重程度、是否有快速控制疾病和(或)症状的需求,制定个体化的综合治疗方案。总的来说,对于激素受体阳性、疾病进展相对缓慢、不合并内脏转移、非内分泌原发耐药患者应优先考虑内分泌治疗。激素受体阴性、术后无病间期短、合并内脏转移、对内分泌治疗无反应的患者应优先考虑化疗。Her-2阳性乳腺癌患者应合并抗Her-2治疗。
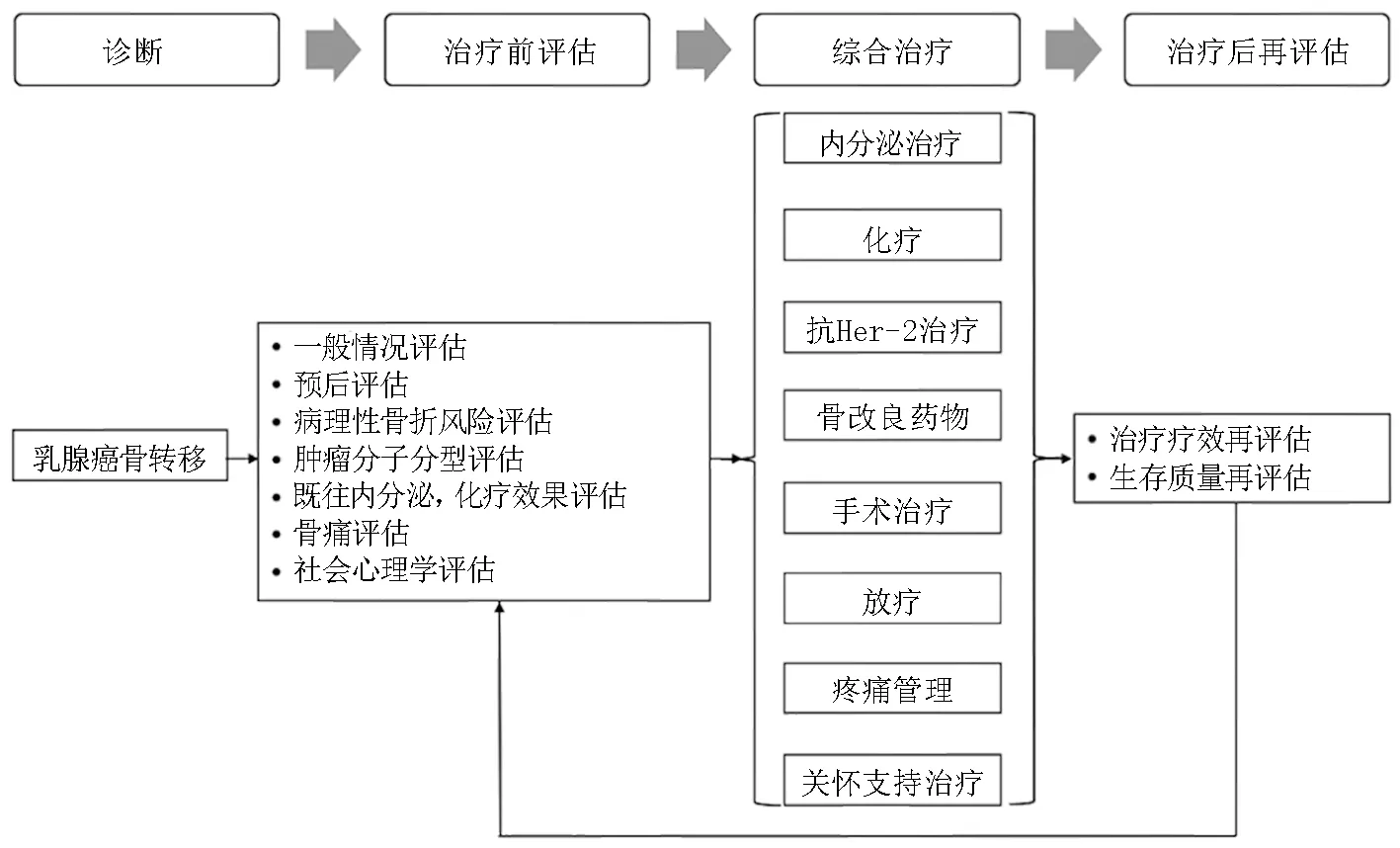
图1 乳腺癌骨转移治疗流程
3.3 乳腺癌骨转移药物及放射治疗疗效评估
乳腺癌骨转移患者在接受药物和放射治疗过程中,应根据治疗周期进行治疗疗效评估,以判断治疗的有效性。疗效评价主要从患者症状、实验室检查及影像学检查等多个方面综合进行。一般来说,患者主观骨痛症状的减轻,骨内病变边界清晰化,密度增高,软组织包块体积缩小,肿瘤中心出现液化坏死,ECT或PET-CT提示肿瘤摄取减少等,均可能提示肿瘤治疗有效。
3.4 内分泌治疗
对于激素受体阳性、Her-2阴性、不伴广泛的或症状明显的内脏转移的乳腺癌骨转移患者可优先考虑内分泌治疗。芳香化酶抑制剂+CDK4/6抑制剂、氟维司群+CDK4/6抑制剂、单药氟维司群等均为可选方案,近年来,HDAC抑制剂、PI3K抑制剂等亦有循证证据。内分泌治疗应参考患者在辅助治疗阶段及复发转移后使用内分泌药物的种类、时间和月经状态进行。对于既往内分泌治疗有效(临床有效或持续稳定)的患者,无论是否绝经,仍有可能从后续内分泌治疗中获益,故在疾病进展后可换用其他不同机制的内分泌药物治疗。连续三线内分泌治疗无效通常提示内分泌治疗耐药,应换用化疗。治疗药物详见乳腺癌治疗指南[9]。
3.5 化疗
对于激素受体阴性、Her-2阳性、伴有广泛的或有症状的内脏转移、疾病发展较快以及激素受体阳性但对内分泌治疗无效的乳腺癌骨转移患者应考虑化疗。推荐的首选化疗方案包括单药序贯化疗或联合化疗。联合化疗通常起效快,作用强,有更好的客观缓解率,适合肿瘤生长较快、肿瘤负荷较大或广泛内脏转移的患者,但是常伴有明显的不良反应,可能影响患者的生存质量且生存获益有限。对于肿瘤生长较慢、肿瘤负荷较小、无明显症状,难以耐受联合化疗的患者可考虑单药序贯化疗。单纯骨转移患者一般不采用联合化疗。化疗方案详见乳腺癌治疗指南[9]。
3.6 抗HER-2药物
对于乳腺癌骨转移患者,应尽量再次检测骨转移灶的Her-2状态,对Her-2阳性(免疫组织化学强阳性或荧光原位杂交检测显示HER-2基因扩增)的乳腺癌骨转移患者,应以抗Her-2治疗作为基础。对于Her-2阳性且激素受体阳性的转移性乳腺癌患者来说,如可耐受化疗,则应首先考虑抗Her-2治疗联合化疗。抗Her-2治疗一线方案应首选曲妥珠单抗(trastuzumab)及帕妥珠单抗(pertuzumab)双联靶向抗Her-2治疗联合紫杉类药物[10-11]。治疗药物详见乳腺癌治疗指南[9]。
3.7 骨改良药物
1)双膦酸盐(bisphosphonates):是治疗乳腺癌骨转移的有效药物,其有效成分为焦磷酸盐的稳定类似物,能阻止肿瘤转移引起的溶骨型病变、减少骨吸收、减轻骨痛及由骨转移所致的高钙血症及其SREs 。对于乳腺癌骨转移患者,如果其预期生存时间≥3个月,且血肌酐低于30 mg/L,在给予化疗、内分泌治疗及抗Her-2治疗等治疗疾病本身的基础上,应尽早给予双磷酸盐治疗。随机临床试验证实,双磷酸盐的应用可明显降低骨痛、病理性骨折、高钙血症等骨相关事件的发生,改善患者的生存质量[12]。
首选推荐唑来膦酸及伊班膦酸,用于治疗骨转移的中位时间为9~18个月,每3个月1次的使用可有效预防SREs的发生,持续给药18~24个月能够明显降低SREs的发生率[13]。即使在应用双膦酸盐治疗过程中发生SREs,仍建议继续用药,并根据患者获益情况考虑是否长期用药[14]。如在用药过程中出现明确与双磷酸盐治疗相关的严重不良反应或临床医生认为继续用药患者不能获益时,应停止使用或换用另一类双磷酸盐药物。需要注意的是,骨痛缓解并不是停药指征。
双磷酸盐应用的注意事项:
①双膦酸盐可增加患者肾功能负担。虽然大多数均为轻症,但在应用前应综合评估患者肾功能,对于肾功能重度不全患者应减量或延长输注时间[15]。
②应用双膦酸盐治疗可增加发生低钙血症发生的风险。长期使用患者应关注补充钙剂(1 200~1 500 mg/d)和维生素D(D3 400~800 IU/d)[16]。
③研究发现双膦酸盐可能导致无菌性下颌骨坏死(osteonecrosis of the jaw,ONJ)等副作用,且常与侵入性口腔科操作相关[17]。因此在初始治疗前应该进行口腔检查并且保持良好的口腔卫生状态。在治疗期间尽可能避免进行牙科手术或口腔内有创操作,至少每6个月进行全面的口腔检查,一旦出现ONJ应早期采取积极治疗。
2)地舒单抗(denosumab):是一种全人源单克隆抗体,以高特异性和高亲和力与核因子κB受体活化因子配体[receptor activator of nuclear factor-κB(NFκB)ligand,RANKL]结合,阻止RANKL与其受体核因子-κB受体活化因子(receptor activator of nuclear factor-κB,RANK)结合,从而抑制破骨细胞形成和活化,抑制骨吸收。研究显示地舒单抗可以延迟乳腺癌患者SREs发生时间,降低SREs发生次数,效果优于双膦酸盐[18]。全球多家权威指南美国临床肿瘤学会(ASCO)、欧洲肿瘤学会(EMSO)、中国临床肿瘤学会(CSCO)均肯定地舒单抗在乳腺癌骨转移中的地位,NCCN等循证医学指南以ⅠA类推荐[9,19-20]。对于存在肾功能不全或联合应用铂类等肾毒性药物的患者来说,地舒单抗的优势则更加明显。
推荐使用剂量:120 mg,每4周皮下注射,由于在治疗过程中容易出现低磷血症和低钙血症,应用地舒单抗前及治疗过程中应监测血浆钙浓度、肌酐、磷、镁水平,对相应电解质予及时补充。同时避免口腔有创操作,预防颌骨坏死的发生。
3.8 放疗
放射治疗是乳腺癌骨转移姑息性治疗的有效方法。其目的是为了在患者有限的生存期内,预防或减轻因骨转移病灶引起的症状和功能障碍,也可用于姑息手术后快速进展病变的局部控制。同时,随着肿瘤药物发展,对于全身药物控制的患者特别是寡转移患者,局部放疗可以进一步巩固全身效果,延长生存期。骨转移放射治疗的方案需要根据转移灶部位、邻近限量器官、疼痛程度以及是否再次治疗来决定照射总剂量和分次剂量。放射治疗的方法包括体外照射和放射性核素内照射。
1)体外照射:是乳腺癌骨转移姑息性放疗的首选方法。局部放疗可迅速有效地缓解骨破坏和软组织病变导致的疼痛,减缓局部疾病进展。随着放疗技术的发展,调强适形放疗(intensity modulated radiation therapy,IMRT)和三维适形放疗(three-dimensional conformal radiation therapy,3D-CRT)技术的出现,较普通放疗显著提高了放疗效率,同时降低了对周围组织损伤和并发症[20]。而对于脊柱,骨盆等骨转移部位,因为紧邻脊髓、马尾等重要复杂解剖结构,立体定向放疗成为主流治疗技术。
2)体外放疗适应证:
①经疼痛管理和系统治疗仍症状持续的非承重骨的骨转移灶[21]。
②承重部位有症状骨转移灶的姑息性放疗[22]。
③已发生或将发生的病理性骨折,无法耐受手术。
④姑息手术后快速进展的病灶的局部控制。
⑤长期生存患者寡转移灶[23]。
3)体外放疗常用剂量及分割方法
①普通放疗:300 cGy/次,共10次;200 cGy/次,共20次;400 cGy/次,共 5次;800 cGy/次,单次照射(适用于非中线骨转移病灶,行动不便急需解决骨痛的患者)。研究显示,不同方案照射的缓解骨疼痛的疗效及耐受性差异无统计学意义,也有研究显示放疗联合双膦酸盐可提高治疗有效性[21]。单次放疗后再放疗及病理性骨折发生率高于分次放疗。骨转移单次照射技术尤其适用于活动及搬动困难的晚期癌症患者。
②立体定向放疗:根据肿瘤部位,体积,累及病灶节段等一般给予24 Gy/1次,30~36 Gy/3次,40 Gy/5次等根治剂量。针对姑息治疗的患者,一般给予25~30 Gy/5次剂量等方式[24]。
4)放射性核素内照射:放射性核素治疗对治疗多发骨转移癌具有确切疗效,但应严格掌握适应证。内照射仅考虑选择性应用于全身广泛性骨转移患者缓解骨痛症状,且99Tcm-MDP骨显像证实骨转移病灶处有浓聚的病例。89Sr是乳腺癌骨转移内照射放射治疗中最常用的核素药物,其体内代谢特点与钙相似,能够在病变骨富集且半衰期长于正常骨,具有应用优势[25]。常用剂量为1.48 MBq/kg~2.22 MBq/kg。临床结果表明,低于 1.11 MBq/kg时缓解疼痛疗效明显减弱,过大剂量不但加重经济负担和不良反应,而且疗效并不随剂量的增加而提高。重复治疗间隔为3个月以上[26]。放射性核素内照射的绝对禁忌证为妊娠或哺乳期患者。同时,由于全身内照射带来的骨髓抑制,血细胞计数减少和肾小球滤过率降低的患者为相对禁忌证。由于骨髓抑制持续时间较长,对于有可能接受化疗的患者应合理计划。
3.9 手术治疗
外科手术治疗能够在最大程度上缓解肿瘤对周围神经血管的压迫症状,减轻癌痛,恢复肢体结构和运动系统功能[27]。虽然对于全身疾病来讲,乳腺癌骨转移的手术往往是姑息性的,但很多情况下,如不对骨转移灶进行适当的外科干预,患者生存质量将受到明显影响。手术治疗的核心在于对具有潜在病理性骨折发生风险病灶的手术时机和手术方式进行有效判断,争取在骨折前、截瘫前进行处理,使患者免受不必要的痛苦[28]。同时恢复骨机械结构和功能,提高生存质量。另一方面,手术可获得骨转移病灶的组织学诊断,便于疾病的进一步综合治疗。
1)预后评估:以最终使患者获益为出发点,对拟行手术治疗的乳腺癌骨转移患者在术前进行预后评估,权衡手术利弊,对决定手术时机和手术方式十分重要。对于骨转移癌患者整体预后评估,目前常用的有Path-Fx系统,改良Katagiri评分等[29-30],以及专门针对乳腺癌骨转移患者的预后评价体系等[31]。对于特殊转移部位,如脊柱转移性病灶,常用的有改良Tokuhashi评分,Tomita评分等[32-33]。推荐应用以上评价系统为术前计划提供参考。
2)手术相对适应证:对乳腺癌骨转移病灶进行手术计划前应充分考虑以下外科治疗的适应证,制定合理的手术方案[8,34-35]。
①肢体转移灶已发生或将发生病理性骨折。
②脊柱转移灶已发生或将发生病理性骨折、脊柱不稳定、脊髓神经根压迫。
③系统治疗和疼痛管理难以控制的骨痛,且有对应定位的骨病灶。
④肿瘤对系统治疗有效,但合并药物难以控制的局部症状。
⑤孤立的骨转移灶。
⑥患者预期生存>3个月,外科团队评估手术计划可使患者在生存期内获益。
⑦术前一般状况良好,未合并不可控的内脏器官转移和脑转移。
3)手术相对禁忌证:
①预期生存期<3个月。
②术前患者一般情况较差,ECOG评分<2分,或KPS<50分。
③合并严重的心血管、呼吸系统疾病,不可耐受系统麻醉。
④全身多发骨破坏,合并不可控的内脏转移和脑转移病灶。
4)手术方式选择:手术方式的选择取决于病变位置及患者预期寿命,应充分体现个体化。总得来说,对于预期寿命较短、全身治疗效果不佳、疾病进展迅速、病变数量较多的患者,病变位于肢体的应以姑息性固定手术为主,位于脊柱的应以神经根减压、脊髓减压、分离手术为主,尽量恢复骨的连续性和机械性,缓解疼痛,减轻神经和脊髓的物理性压迫,为放疗提供条件。对于预期寿命较长、全身治疗有效、疾病进展相对缓慢、孤立性病变的患者,应更多考虑病变切除、重建的手术方式,以期一次手术能为患者在后续生存期内达到控制局部肿瘤和恢复肢体功能的目的[8,34-35]。
5)肢体长骨:应积极对位于肢体的病变在病理性骨折发生前进行外科干预,使患者免受不必要的病理性骨折痛苦。预防性内固定的治疗比已发生骨折的治疗要更简单和安全。预判骨转移病灶发生病理性骨折的风险十分重要,应对每个影像学确诊的乳腺癌骨转移病例进行独立分析[36]。另一方面,对内固定物进行选择时应实现即刻稳定性,预计使用时间应长于患者预期寿命,并且坚强固定应覆盖包括所有骨强度降低区。
①长骨病理骨折的风险评价:评估病理性骨折发生风险的方法较多,但Mirels评分系统因其应用简单有效较为普遍被临床接受[37]。该评分系统主要包括骨病变的性质、部位、疼痛和皮质的病变范围4个方面。推荐在患者评分≥8分时进行预防固定。如评分<7分提示病理性骨折的风险较低(表1)。但也应充分认识到,仅通过X光片来判断骨病变的范围存在局限性。应充分借助CT或MRI检查协助判断病变的范围,更好的评估病理性骨折的发生风险。

表1 Mirels评分
②治疗方式:⑴钉板固定:对病理性骨折采取切开复位内固定的治疗措施时,可对病灶进行刮除,应用骨水泥填充来增加重建后的稳定性,提高轴向和旋转的稳定性。需根据骨折部位、临近骨质量、刮除后残留骨量决定应用固定方式。锁定钢板在特殊部位的骨折,如肱骨近端、股骨远端、桡骨远端,尤其是骨质条件欠佳时具有应用优势,且可降低术后螺钉拔出率。骨水泥的应用也可以改善螺钉的抗拔出能力。⑵髓内钉:对于位于股骨、肱骨等长骨骨干病理性骨折或即将出现病理性骨折的患者,应用髓内钉是安全和有效的。髓内钉的长度选择应完全跨越病变区域,避免选择过短的髓内钉而造成不必要的应力集中。有研究提示髓内钉固定联合病变处的病灶刮除、骨水泥填充治疗可进一步缓解患者的骨痛症状。⑶肿瘤型假体:当病变临近或累及肢体大关节,需要进行彻底切除或内固定难以达到治疗目的时,可以使用肿瘤型假体进行重建。肿瘤型假体能够提供即刻负重和稳定性,使患者快速恢复活动。组配式假体可以更好的匹配每个患者的需要。通常采用骨水泥固定假体以提供即刻的稳定性。
6)脊柱:手术治疗乳腺癌脊柱转移癌患者的目的是解除神经压迫、减轻患者疼痛、重建或维护脊柱稳定性并为放疗提供条件。推荐应用NOMS流程图(图2)综合评价患者病情并设计治疗方案,应用SINS评分判断脊柱稳定性(表2),应用ESCC评分(图3)判断脊髓压迫程度[38-39]。手术计划应参考Tomita评分、改良Tokuhashi评分来指导治疗。如Tomita评分2~3分者可行广泛或边缘切除以获得长期的局部控制;4~5分者可行边缘或病变内切除以获得中期的局部控制;6~7分者可行姑息性手术,8~10分者不应手术而行支持治疗[32-33]。

图3 ESCC分级
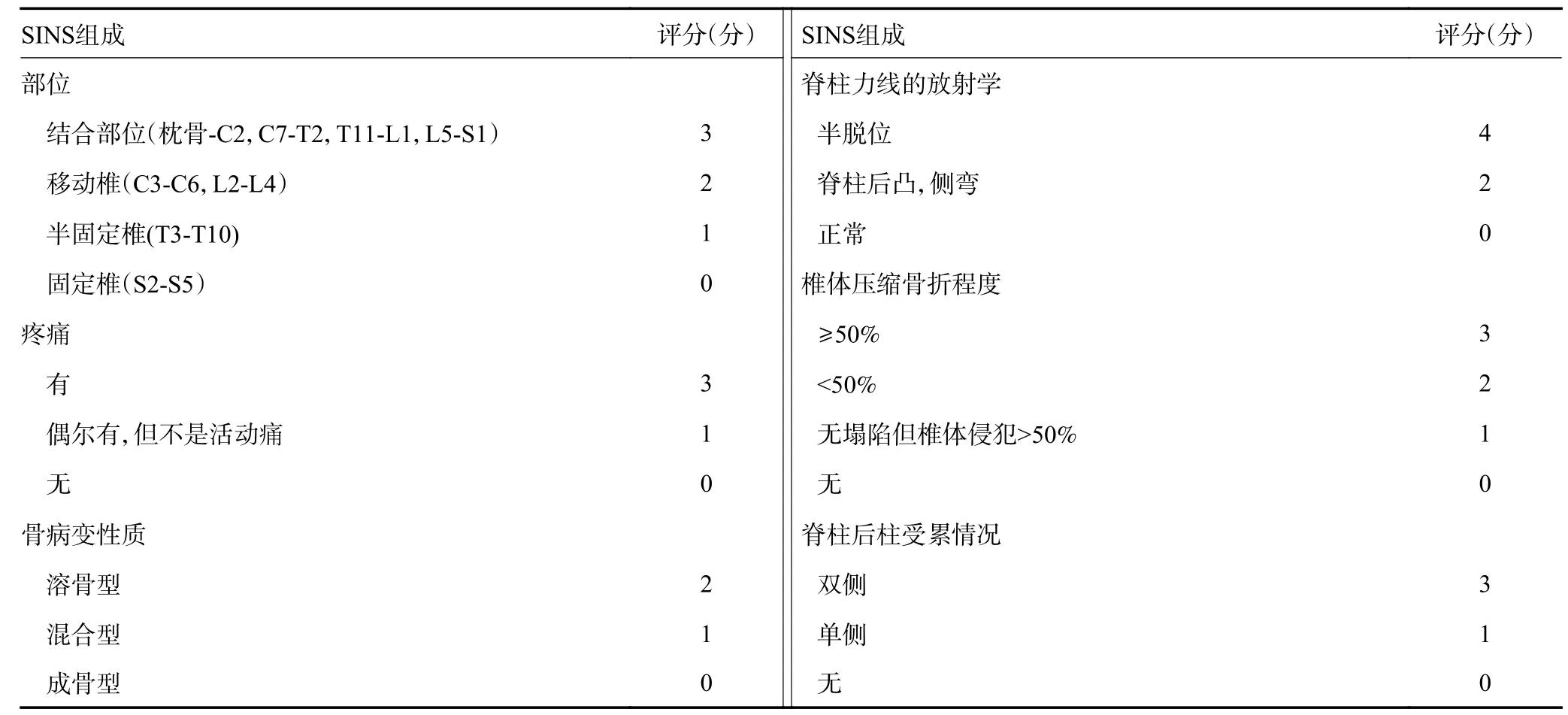
表2 脊柱骨转移不稳定性评估评分[39]

图2 乳腺癌脊柱转移治疗流程NOMS流程图
在应用评分的基础上还应注意以下要素:①手术应积极解除脊髓、神经根的压迫或压迫风险,以重建或维护脊柱稳定性为目标。②对肿瘤组织的去除应以解除在患者预期寿命内无再次造成脊髓压迫风险为目标。③对于肿瘤侵犯广泛的病例,应以分离手术等方式解除脊髓神经压迫,重建脊柱稳定性,为放疗提供条件[35,40]。
由于脊柱解剖结构的特殊性,多种影像学引导下的微创介入治疗技术在乳腺癌骨转移局部控制、减轻疼痛、改善生存质量方面的应用中也展现出优势。如射频消融治疗,是利用射频针产热形成的物理化学效应直接杀伤肿瘤细胞使其发生不可逆损伤的一种微创的治疗技术[41]。又如微创技术骨成形术,通过建立经皮穿刺通道,将骨水泥(甲基丙烯酸甲酯PMMA)注入溶骨性病灶内,待其固化后起到填充空间、稳定结构的作用,同时骨水泥在固化过程中放热也可杀伤部分肿瘤组织。其主要包括经皮椎体成形术、后凸成形术。适用于各种溶骨性病变,在脊柱应用较有优势,也可应用于其他部位如骨盆等[42]。此类技术既可以与开放手术结合应用,也可在术中影像的指导下微创经皮操作,适用于因全身情况差不能耐受手术或顽固性疼痛的患者。
7)骨盆:是乳腺癌骨转移好发的部位之一,同时因其特殊的解剖部位成为了治疗的难点,尤其是累及髋臼和骨盆应力传导区的病变,因为站立负重时承受了巨大应力,故此部位也是病理性骨折最好发的部位。髋臼周围转移癌常常会导致严重疼痛及功能丢失。当出现机械性不稳时,与手术治疗相比,非手术治疗如放化疗、抗血管靶向治疗及骨改良药物治疗等治疗手段不足以缓解疼痛、重建功能并提高生存质量。治疗原则应以重建和加强应力传导区机械强度和结构,重建受损的髋关节结构功能为核心。可选择的方法包括肿瘤的切/刮除术联合内固定、骨水泥及人工假体重建。对于位于非应力传导区的系统治疗无效的有症状的病变(耻、坐骨),可行单纯切除或放射治疗[34,43-44]。
髋臼周围转移瘤破坏常导致股骨头逐渐向髋臼顶部及内侧移位,有时可发生急性髋臼骨折或塌陷。该部位转移瘤即使进行了有效的放疗后仍可能因为放疗导致局部骨溶解、骨坏死而发生病理骨折或关节塌陷。外科重建时需要保留髋关节修复骨缺损,以保证向脊柱方向的力量传导。如果髋臼骨破坏较小,股骨头移位不明显,应用普通骨水泥型全髋关节假体将取得良好的效果。如果髋臼周围骨质因转移瘤或放疗后骨坏死遭到大范围破坏,残留的骨质难以防止髋臼组件的移位和松动,普通的全髋置换难以成功。由于骨水泥可以抵抗压力但不能抵抗剪切应力,需用斯氏针、空心钉桥接骨缺损、复合骨水泥固定(钢筋水泥法)。经皮髋臼三柱空心螺钉成型固定技术对部分患者可恢复髋臼强度和负重功能[45]。
目前临床上最常用的髋臼周围骨转移瘤分类系统是Harrington于1981年根据骨折的部位、肿瘤或放疗后骨破坏的程度以及稳定固定的特殊技术要求对髋臼转移癌进行的分类,指导髋臼转移瘤手术[46]。本共识根据Harrington分型描述了不同的骨缺损的解剖范围,并提出了相应的治疗方法。
Ⅰ型:髋臼外侧皮质、髋臼顶及内壁结构完整,关节面软骨下骨被转移灶侵犯。此型虽可出现广泛转移灶骨侵犯,但髋臼周围仍保留充足的正常骨质,对此类使用传统的骨水泥固定的普通全髋关节置换可以达到长期牢固固定。
Ⅱ型:髋臼内壁骨质连续性遭到破坏,但髋臼顶以及与髋臼毗邻的髂骨及耻坐骨外侧皮质完整。采用普通的髋臼基座及传统的全髋关节置换术其发生假体及骨水泥早期松动并向内侧移位的几率较高,即使选择使用钛网杯增强髋臼内壁仍不能有效阻止假体内移。对于这种情况,应采用特殊设计的带翼的髋臼加强杯,可以有效地将假体应力由破损的髋臼内壁分散至髋臼边缘。
Ⅲ型:髋臼内壁、顶部及边缘均存在骨破坏。大部分病例伴有广泛的耻坐骨病变,故此类患者髋臼下缘功能同时丢失。对此类患者,即使使用带翼的髋臼加强杯的全髋假体重建仍无法获得有效的固定。这种情况下, 需要在骨盆缺损处放置数根斯氏针或空心钉架桥连接正常骨、复合骨水泥填充, 称之为“钢筋水泥髋臼成形术”。有效的髋臼组件固定应能够很好地将股骨侧负重力量传导至被肿瘤侵犯区域上方骨质正常的结构完整的髂骨及骶骨。对于骨盆破环范围较大、伴有巨大软组织肿块的Ⅲ型骨转移患者,建议采取整块切除的方法,可以有效减少术中出血、降低复发率、延长生存期、提高患者的生存质量。
Ⅳ型:单发髋臼周围转移灶,应行整块切除并辅以相应重建以达到改善患者预后的目的。
3.10 疼痛管理
乳腺癌骨转移患者的疼痛管理是综合治疗的重要一环,影响着患者的生存状态。应综合分析患者临床症状、既往疾病史、既往镇痛药物情况和社会经济学因素,建立个性化的疼痛管理方案,同时应关注药物依赖和非甾体类抗炎药引发的副作用。对于乳腺癌骨转移患者疼痛药物治疗应结合世界卫生组织(WHO)癌症三阶梯止痛治疗指导原则和《国家癌症疼痛诊疗规范(2018年版)》指导原则,即:①首选口服及无创给药途径;②按时服药;③按阶梯服药;④个体化给药;⑤关注细节[47]。
1)疼痛评估:充分进行用药前疼痛评估是合理、有效镇痛治疗的前提,应当遵循“常规、量化、全面、动态”的癌痛评估原则。通常应用数字分级法(numerical rating scale,NRS)、面部表情评估量表法及主诉疼痛程度分级法(verbal rating scales,VRS)3种方法;对疼痛病因和类型、疼痛发作情况(疼痛的部位、性质、程度、加重或减轻的因素)、止痛治疗情况、 重要器官功能情况、心理精神情况、家庭及社会支持情况以及既往史(如精神病史、药物滥用史)等进行全面评估。
2)药物选择:
①非甾体类抗炎药和对乙酰氨基酚:是骨转移疼痛药物止痛治疗的首选基础用药,当止痛效果不佳时,或出现中重度疼痛时,推荐合用阿片类镇痛药。
②阿片类止痛药:是中、重度癌痛治疗的首选药物,推荐选择阿片受体激动剂类药物。长期用药时,首选口服给药途径,有明确指征时可选用透皮吸收途径给药,也可临时皮下注射用药,必要时可以自控镇痛给药。使用阿片类药物时需要注意剂量滴定方法和不良反应管理。当全身阿片类药物治疗弊大于利时,应考虑侵袭性干预措施如神经阻滞术、神经切断术等。对频繁发作的突发性疼痛的患者,可以通过增加镇痛药的按时用药剂量缓解疼痛。控制突发性疼痛的主要方法是备用速效或短效镇痛药。控制突发性疼痛的短效镇痛药单次用药剂量一般为日用剂量的5%~10%。
③其他辅助用药:如三环类抗抑郁药可用于中枢性或外周神经损伤所致的麻木样痛、灼痛,改善心境和睡眠。抗惊厥类药(加巴喷丁,卡马西平等)用于神经损伤所致的撕裂痛、放电样疼痛及烧灼痛。糖皮质激素(甲基强的松龙、地塞米松等)用于脊柱转移有脊髓压迫症状的患者。
4 结语与展望
乳腺癌骨转移的治疗是一个复杂的过程,应综合考虑肿瘤本身、患者机体状态以及现有治疗手段等多种因素。一、二线治疗方案的临床研究数据较多,但后线治疗方案因缺乏高水平的循证医学证据而仍存在一定的局限性。
在过去的几十年,乳腺癌辅助治疗发生了实质性的改变,使得乳腺癌骨转移患者的生存期显著延长,乳腺癌患者的治疗逐渐进入慢病管理模式,一些既往的治疗研究结果可能不适合目前的治疗情况。因此,乳腺癌骨转移的治疗最终依赖于“多学科协同,个体化方案”的方针。在设计外科治疗方案时应充分了解患者的分子分型和预后因素。另一方面,医务和科研工作者应致力于设计并推广高质量的临床试验,以寻求乳腺癌骨转移的最优治疗策略和最佳药物选择,最终达到优化治疗方案,延长生存时间,提高生存质量的目的。
专家共识委员会
专家组组长:
郭 卫 北京大学人民医院
专家组成员(按姓氏笔画排列):
于秀淳 济南960医院
牛晓辉 北京积水潭医院
王国文 天津医科大学肿瘤医院
王 晋 中山大学肿瘤医院
王 臻 空军军医大学西京医院
王 殊 北京大学人民医院
叶招明 浙江大学第二附属医院
曲国藩 哈尔滨医科大学肿瘤医院
庄洪卿 北京大学第三医院
张伟滨 上海瑞金医院
肖建如 上海长征医院
吴苏稼 南京东部战区总医院
严望军 复旦大学肿瘤医院
李建民 山东大学齐鲁医院
李浩淼 南方医科大学第三医院
沈靖南 中山大学第一附属医院
邵增务 华中科技大学同济医学院附属协和医院
郭 征 空军军医大学唐都医院
屠重棋 四川大学华西医院
董 扬 上海市第六人民医院
蔡郑东 上海市第一医院
樊征夫 北京大学肿瘤医院
