鸡血藤总黄酮对环磷酰胺所致小鼠肝损伤的保护作用
2022-07-23史鑫锐陈滢锴陈中婷赵尉丹江明生陈海兰
史鑫锐,陈滢锴,陈中婷,赵尉丹,江明生,陈海兰
(1.广西大学动物科学技术学院,广西 南宁 530005;2.北京生泰尔科技股份有限公司,北京 102600)
鸡血藤为豆科(Leguminosae)密花豆属植物密花豆(Spatholobus suberectus Dunn)的干燥藤茎[1],又名大血藤,分布于广西、云南、广东、贵州、福建等地,主产于广西,以广西产者为道地药材[2]。 鸡血藤性温,味苦、甘,归肝、肾经,具有补血活血、舒筋活络[3]的功效,常用于治疗月经不调、血虚萎黄、 麻木瘫痪及风湿麻痹等。 现代药理学研究表明,鸡血藤具有抗肿瘤、抗病毒、抗炎、抗氧化、免疫调节、酪氨酸酶双向调节、镇静催眠[4-5]等作用。鸡血藤的化学成分主要含有黄酮类(包括异黄酮类、黄酮醇类、异黄烷类等)、萜类、甾醇类、木质素类、蒽醌类及儿茶素类化合物等[6]。 陈海兰等[7]发现鸡血藤总黄酮对二甲苯所致小鼠耳肿胀急性炎症具有较强的抑制作用, 且在体外对LPS 刺激免疫细胞引起的NO 和炎症细胞因子的分泌具有显著抑制作用,证实鸡血藤总黄酮具有抗炎活性。同时, 鸡血藤总黄酮乙酸乙酯部位对LPS 处理RAW264.7 细胞引起的氧化应激损伤具有一定的保护作用, 能降低LPS 诱导氧化应激细胞内ROS和NO 的含量,具有抗氧化作用[8]。 王妮佳等[9]发现鸡血藤总黄酮能抑制HeLa 细胞由G0/G1 期向S 期与G2/M 期的转化,具有抗肿瘤功能。
环磷酰胺是临床上广泛应用的化学药物,主要用于自身免疫性疾病,如风湿性关节炎、全身性红斑狼疮、肾病综合征以及癌症的治疗[10],但毒副作用比较大,可导致膀胱损伤、肝损伤、免疫抑制、脱发、畸形等[5,11]。 环磷酰胺代谢活化物的治疗作用是非常明显的, 但其毒性作用目前还没有有效的防治对策[12]。 该试验旨在探讨鸡血藤总黄酮对环磷酰胺所致小鼠肝损伤的保护作用, 为减轻环磷酰胺的毒副作用提供新思路。
1 材料与方法
1.1 试验材料
1.1.1 实验动物
昆明系小鼠60 只,SPF 级,体重(20±2)g,雌雄各半,购于广西医科大学实验动物中心。在实验动物房标准笼中饲养7 d,自由进食、饮水,使其适应环境。 试验前禁食12 h,禁水6 h。
1.1.2 药品与试剂
鸡血藤总黄酮(TFSD),棕黄色粉末,由广西大学动物科学技术学院药理实验室通过乙醇提取法从广西崇左产鸡血藤中提取得到。 环磷酰胺(CTX), 购于美国Sigma 公司。 黄嘌呤氧化酶(XOD)、超氧化物歧化酶(SOD)、髓过氧化物歧化酶(MPO)、谷胱甘肽过氧化物酶(GSH-Px)等检测试剂盒均购于南京建成生物工程研究中心。 TNFα、IL-6 与IL1-β 酶联免疫吸附(ELISA)试剂盒购于美国eBioscience 公司。
1.1.3 仪器设备
电子分析天平 (型号:AB104-L), 瑞士梅特勒—托利多公司产品; 台式高速冷冻离心机 (型号:3K-15),德国Sigma 公司产品;超纯水仪(型号:Q5UV),美国Millipore 公司产品;多功能酶标仪(型号:Multimode Plate Reader),瑞士PerkinElmer公司产品。 全自动生化分析仪(型号:AU5800),贝克曼库尔特公司产品。
1.2 试验方法
1.2.1 实验小鼠的分组与处理
将60 只昆明系小鼠随机分为6 组: 对照组、CTX 组、TFSD100 组、CTX +TFSD25 组、CTX +TFSD50 组、CTX+TFSD100 组,每组10 只,雌雄各半。 对小鼠腹腔注射CTX 建立肝损伤模型,灌胃给予不同剂量TFSD。试验周期为7 d。具体处理方法见表1。

表1 小鼠分组与处理方法
1.2.2 肝组织氧化还原相关酶活力水平的测定
小鼠处死后,采集肝脏,取一小块称重,按照1∶9 比例加入预冷的生理盐水,制成匀浆。然后将匀浆转移至灭菌的1.5 mL EP 管内,4 ℃、5 000 r/min离心10 min 后,取上清液,严格按照试剂盒说明书检测SOD、XOD、MPO 和GSH-Px 活力。
1.2.3 血液生化检查
眼球采血获取血液样本后,4 ℃、5 000 r/min离心5 min,然后取部分血清,用全自动生化分析仪检测谷丙转氨酶(ALT)、谷草转氨酶(AST)和碱性磷酸酶(ALP)活力。
1.2.4 炎症因子水平的检测
从“1.2.3”项下分离的血清中取部分样品采用商品化ELISA 试剂盒检测炎症因子TNF-α、IL-6和IL-1β 水平。
1.3 数据分析
试验数据采用SPSS 21.0 统计学软件进行单因素方差分析(One-Way ANOVA),采用LSD 法进行组间比较,结果用“平均值±标准差”的形式表示。P<0.05 表示差异显著,P>0.05 表示差异不显著。
2 结果与分析
2.1 鸡血藤总黄酮对环磷酰胺所致肝损伤小鼠肝脏中氧化还原酶活力的影响
如表2 所示,经CTX 处理后,小鼠肝脏中的SOD 和GSH-Px 活力与对照组小鼠相比显著下降(P<0.05), 表明CTX 可引起小鼠肝脏中氧化还原酶活力的代偿性降低。 25、50、100 mg/(kg·BW)的TFSD 处理均可显著(P<0.05)抑制由CTX 引起的SOD 活力降低,25 mg/(kg·BW) 的TFSD 可显著(P<0.05)抑制CTX 处理小鼠的GSH-Px 活力。
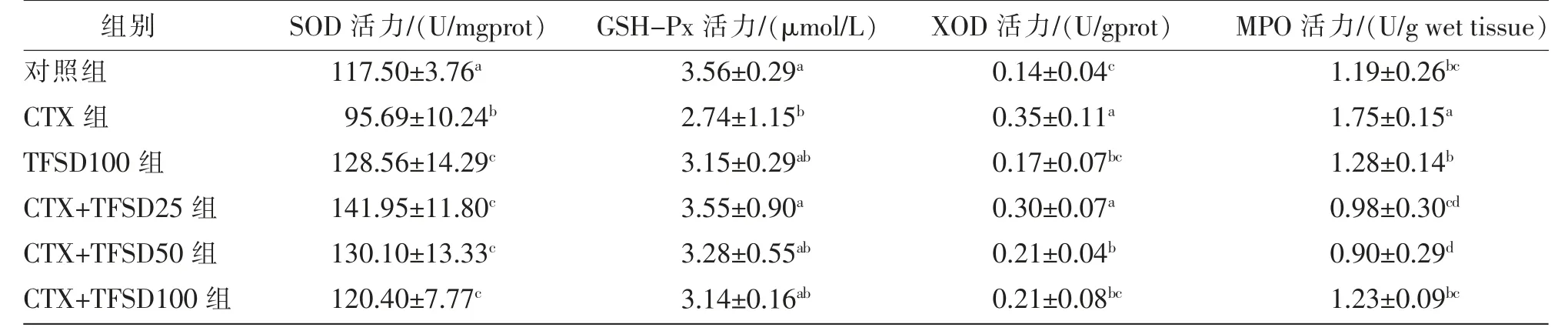
表2 小鼠肝脏氧化还原酶活力测定结果(n=10)
另外,CTX 处理可引起小鼠肝脏中XOD 和MPO 活力显著(P<0.05)升高,而单独给予TFSD 处理的小鼠肝脏XOD 和MPO 活力与对照组相比差异不显著(P>0.05),表明CTX 可引起肝脏中氧化应激的产生,而TFSD 则对肝脏中氧化还原状态无不良影响。 不同剂量的TFSD 处理可抑制CTX 引起的XOD 和MPO 活力升高,50、100 mg/(kg·BW)的TFSD 处理组可显著(P<0.05)抑制由CTX 引起的XOD 活 力 升 高,25、50、100 mg/(kg·BW)的TFSD 处理均可显著(P<0.05)抑制由CTX 引起的MPO 活力升高。
2.2 鸡血藤总黄酮对环磷酰胺所致肝损伤小鼠血液生化指标的影响
如表3 所示,CTX 处理对小鼠血清中的AST活力无显著(P>0.05)影响,但显著(P<0.05)降低ALT 活力,而单独使用TFSD 显著(P<0.05)降低小鼠血清中的ALT 和AST 活力。 对CTX 处理的小鼠给予25、50 mg/(kg·BW)TFSD 可显著 (P<0.05)降低血清中AST 活力,给予25、50、100 mg/(kg·BW)TFSD 均可显著(P<0.05)降低血清中的ALT活力。

表3 小鼠血液生化指标测定结果(n=10) 单位:U/L
另外,CTX 处理可显著(P<0.05)提高小鼠血清中的ALP 活力,而经CTX 处理的TFSD 组ALP活力与对照组相比差异不显著(P>0.05),表明CTX可引起小鼠血清中ALP 活力升高, 而TFSD 则对ALP 活力无明显影响。 用25、50、100 mg/(kg·BW)的TFSD 处理后,均可显著(P<0.05)抑制由CTX导致的ALP 活力升高。
2.3 鸡血藤总黄酮对环磷酰胺所致肝损伤小鼠炎症因子分泌水平的影响
由表4 可知,CTX 处理小鼠后, 血清中TNFα 水平有所升高,但与对照组相比差异不显著(P>0.05),给予25、50 mg/(kg·BW)的TFSD 可略微降低CTX 处理小鼠血清中的TNF-α 水平, 但与CTX 组及对照组相比差异均不显著(P>0.05)。

表4 小鼠血清中炎症因子分泌水平的测定结果(n=10) 单位:pg/mL
CTX 可显著(P<0.05)升高小鼠血清中的IL-6水平, 而TFSD100 组与对照组相比差异不显著(P>0.05)。 另外,TFSD 处理未能有效抑制CTX 引起的IL-6 水平升高,25、50、100 mg/(kg·BW)剂量组与CTX 组相比差异均不显著(P>0.05)。
与对照组相比,腹腔注射CTX 后,小鼠血清中的IL-1β 水平显著(P<0.05)升高,而TFSD100组的IL-1β 水平与对照组相比无显著差异 (P>0.05)。 对经CTX 处理的小鼠给予不同剂量的TFSD,均可显著(P<0.05)抑制CTX 引起的IL-1β水平升高。
3 讨论
环磷酰胺是临床常用的恶性肿瘤治疗药物,主要代谢产物丙烯醛可引起肝细胞坏死, 导致肝小叶中心充血,肝毒性作用可能与氧化应激有关。该研究通过腹腔注射环磷酰胺建立小鼠肝损伤模型,并给予不同剂量的鸡血藤总黄酮,通过分析肝组织中氧化还原酶活力、 血液中炎症因子分泌水平和血液生化指标, 探讨鸡血藤总黄酮对环磷酰胺所致肝损伤的保护作用。
几乎所有的细胞个体有一套完整的自我保护系统,用来清除新陈代谢过程中产生的羟自由基、过氧化物自由基、过氧化氢等氧化物质,保护生物大分子免受氧化损伤[13-14]。 SOD、GSH-Px、XOD 和MPO 是维持机体氧化还原平衡的重要酶,其活力变化直接反映机体氧化还原状态。研究发现,环磷酰胺可引起小鼠体内SOD 和GSH-Px 水平显著下降,表明环磷酰胺可打破小鼠体内氧化还原动态平衡,引起氧化应激,造成肝损伤[15-16]。 邢家玮等[17]发现腹腔注射环磷酰胺可引起小鼠体内MPO 水平显著升高,SOD 水平显著降低,与该研究结果一致。 胡小艳等[18]发现腹腔注射环磷酰胺可导致XOD 活力显著提高。 在该研究中,腹腔注射环磷酰胺引起小鼠肝脏内SOD 和GSH-Px 活力显著下降,XOD 和MPO 活力显著提高,与前人报道一致。 使用环磷酰胺处理小鼠并给予不同剂量的鸡血藤总黄酮可提高小鼠肝脏中的SOD 和GSH-Px活力, 降低环磷酰胺处理小鼠肝脏中的XOD 和MPO 活力,表明鸡血藤总黄酮可通过改变氧化还原酶的活力, 改善环磷酰胺处理小鼠肝脏中的氧化还原状态,保护机体不受氧化损伤。
谷草转氨酶(AST)和谷丙转氨酶(ALT)广泛存在于肝脏组织细胞内, 在机体蛋白质代谢中发挥重要作用, 这两个酶的活力直接反映肝组织的损伤程度,而血清中的ALP 水平对骨骼、肝胆系统的损伤具有指示意义。 环磷酰胺的肝毒性作用曾被多次报道, 对小鼠腹腔注射环磷酰胺可引起AST 和ALP 活力显著升高, 而中药复方柴胡垂盆汤[19]、中药活性成分水苏糖[20]、蓝莓 花 苷[21]、杨梅素[22]可抑制环磷酰胺引起的ALT 和AST 水平升高,减轻环磷酰胺所致肝损伤。 在该研究中,腹腔注射环磷酰胺后,小鼠血清中的ALP 活力显著升高,提示模型小组的骨骼和肝胆系统造成了损伤,而使用鸡血藤总黄酮处理后,血清ALP 水平显著下降,表明鸡血藤总黄酮对环磷酰胺引起的骨骼、肝胆系统损伤具有抑制作用。但是,在该研究中经环磷酰胺处理后,血清中的AST 与ALT 活力水平出现下降,且经中低剂量的鸡血藤总黄酮处理后,AST 与ALP 水平进一步下降, 推测可能是环磷酰胺对肝脏中包括AST 和ALP 在内的多种代谢酶的活性产生了一定程度的抑制作用。 此外, 关于TFSD 的急性毒性试验在国内外还未有报道,急性毒性可能是造成药物剂量较高的CTX+TFSD100组的AST 活力与ALP 活力不降反增的原因,具体还需验证。
TNF-α 是巨噬细胞清除病原微生物或杀死肿瘤细胞的主要效应分子,参与炎症反应的发生,且出现在炎症反应的最早期[18]。 分泌的TNF-α 可激活中性粒细胞和淋巴细胞,加速其他炎症因子,如IL-1β、IL-6 等的释放,扩大连锁反应,使机体产生炎症[23]。 IL-6 是炎症反应的促发剂,能诱导B 淋巴细胞的增殖与分化,从而促使其分泌中和抗体,并可调节机体的免疫应答与血细胞的生成。IL-1β和TNF-α 称为前炎症因子,在早期固有免疫和细胞免疫应答中具有十分重要的作用。但是,这些炎症因子的过量分泌可引起机体发热、肿痛、组织细胞损坏,导致组织细胞变性和坏死。 在该研究中,腹腔注射环磷酰胺提高了TNF-α、IL-1β 和IL-6的分泌水平,且IL-1β 与IL-6 水平与对照组相比差异显著,表明环磷酰胺引起小鼠发生炎症反应。对环磷酰胺处理小鼠给予中低剂量的鸡血藤总黄酮,可抑制这几种炎症因子的释放,对IL-1β 水平的代偿性升高表现出显著的抑制作用, 提示鸡血藤总黄酮对环磷酰胺引起的炎症反应具有一定的抑制作用, 可保护机体组织在炎症反应中免受损伤。但值得注意的是,在正常小鼠和环磷酰胺处理小鼠中使用100 mg/(kg·BW)TFSD 的小鼠均出现了TNF-α 水平的升高, 由于TNF-α 在细胞免疫功能调节中具有重要作用,TNF-α 水平的升高提示高剂量的TFSD 可能会通过早期炎症的调节增强机体的免疫功能。
4 结论
腹腔注射环磷酰胺可造成小鼠肝脏发生氧化应激,诱导炎症反应的发生,表现为SOD 与GSHPx 活力显著降低,MPO、XOD 与ALP 活力显著升高,以及TNF-α、IL-1β 和IL-6 释放水平升高。 低剂量的鸡血藤总黄酮对环磷酰胺引起的肝脏氧化还原酶SOD、GSH-Px、XOD、MPO,血清ALP,以及炎症细胞因子TNF-α、IL-1β、IL-6 的代偿性改变具有抑制作用, 且低剂量组的效果最明显,除XOD、TNF-α、IL-6 外,均具有显著抑制作用,表明鸡血藤总黄酮可通过调节小鼠肝组织中的氧化还原状态及炎症因子释放, 对环磷酰胺所致肝损伤提供保护,推荐剂量为25 mg/(kg·BW)。
