高脂饮食对非酒精性脂肪性肝炎小鼠肠肝免疫及肠道菌群的影响
2022-07-22钟立萍谢旦立楼永良
钟立萍 谢旦立 楼永良
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是一种常见的慢性肝病,与肥胖、高脂血症和代谢综合征等疾病密切相关[1],全球发病率约为25.2%[2]。非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)是NAFLD严重病理类型之一,临床资料显示,多达1/3的NASH患者可能发展为晚期纤维化、肝硬化和肝细胞癌,需要进行肝移植治疗[3-4]。因此,阐明NASH炎症进展的潜在机制,对疾病研究及诊疗具有重要意义。本研究通过高脂饮食喂饲野生型C57BL/6小鼠和遗传易感型肝特异性PTEN基因缺失(liver-specific PTEN deficiency,PtenCKO)小鼠构建NAFLD模型,研究不同处理小鼠组织病理、调节性T细胞(regulatory T cells,Tregs)的免疫调节作用和肠道菌群特征,以期为NASH诊治提供科学依据。
1 材料和方法
1.1 材料
1.1.1 实验动物 6周龄雄性C57BL/6野生型(wild type,WT)小鼠购自上海斯莱克实验动物有限公司[许可证号:SCXK(沪)2017-0005],PtenCKO小鼠购自南京大学模式动物研究所[许可证号:SCXK(苏)2018-0008],为C57BL/6背景,均由温州医科大学实验动物中心饲养于SPF环境。所有动物实验均通过温州医科大学实验动物伦理委员会审批(批准编号:2019-0266)。
1.1.2 主要试剂 IMDM细胞培养基、1000×β-mercaptoethanol购自美国Gibco公司;FBS购自中国浙江天杭生物公司;4%多聚甲醛固定液(4%PFA)购自中国北京索莱宝公司;冷冻包埋剂购自日本SAKURA公司;Live/Dead可固定死细胞荧光抗体、eBioscience破膜试剂盒含固定/通透液、eBioscience Perm/Wash™洗涤缓冲液购自美国Thermo Fisher Scientific公司;ChamQ qPCR SYBR Green Master Mix购自中国南京诺唯赞公司;Percoll细胞分离液购自美国GE公司;流式荧光抗体:抗鼠-CD4-AF488、CD8-PE/Cy7、FoxP3-PE购自美国Biolegend公司;鼠D-乳酸(D-Lactate,D-LA)ELISA试剂盒购自中国上海源叶生物公司;Trizol RNA提取试剂盒、粪便基因组提取试剂盒购自美国Omega Bio-Tek公司;逆转录试剂盒购自中国大连TaKaRa公司。
1.2 方法
1.2.1 动物建模及标本采集 实验小鼠分为PtenCKO高脂饮食组(PtenCKO HFD)、PtenCKO正常饮食组(PtenCKO NCD)、野生型高脂饮食组(WT HFD)和野生型正常饮食组(WT NCD),每组8只,给予相同量的标准饲料或60%高脂饲料(中国江苏协同生物公司)。造模10周,期间小鼠自由饮食、饮水。
1.2.2 标本采集 (1)粪便标本采集:造模结束前2天采集4组小鼠粪便,采集后及时提取或立即-80℃冻存备用。(2)血浆标本采集:实验前1天晚上小鼠禁食不禁水。实验当天称取小鼠体质量,异氟烷麻醉后眼球采血,收集于含有EDTA抗凝剂的离心管,提取血浆,-80℃冻存备用。(3)组织标本采集:小鼠颈椎脱臼处死,手术剪剪取整个肝,记录肝脏的一般情况,相机拍照。记录肝湿质量,计算肝重指数,肝重指数=肝湿质量/体质量×100%。剪取一部分肝左叶固定于4%PFA,剩余部分肝脏组织置于10%IMDM培养基中。根据解剖标记(自回盲瓣近端5 cm处取材)剪取小鼠回肠组织,一部分回肠组织固定于4%PFA,剩余部分回肠组织-80℃冻存备用。沿肠系膜收集肠系膜淋巴结并置于10%IMDM培养基中备用。
1.2.3 肝脏、回肠病理观察 石蜡切片HE染色后,观察肝细胞脂肪变、气球样变和小叶内炎症及小肠组织黏膜的结构变化;冷冻切片油红O染色后,观察肝脏脂肪变。
1.2.4 回肠组织紧密连接蛋白mRNA转录水平检测采用荧光定量PCR法。按照Trizol RNA提取试剂盒方法提取回肠组织总mRNA,按照逆转录试剂盒方法逆转录成cDNA。以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)基因为内参。ZO-1 引物序列:F-5′-AGGACACCAAAGCATGTGAG-3′,R-5′-GGCATTCCTGCTGGTTACA-3′;Claudin-1:F-5′-TGCCCCAGTGGAAGATTTACT-3′,R-5′-CTTTGCGAAACGCAGGACAT-3′;GAPDH:F-5′-CGTGCCGCCTGGAGAAACCTG-3′,R-5′-AGAGTGGGAGTTGCTGTTGAAGTCG-3′。引物由中国上海桑尼生物科技有限公司合成。
1.2.5 肠道屏障指标D-LA浓度检测 采用ELISA法。按照鼠D-LA ELISA试剂盒方法检测各组小鼠血浆D-LA浓度。
1.2.6 肠道菌群分析 按照粪便基因组提取试剂盒方法提取4组小鼠粪便样本基因组DNA。用特异性引物扩增16S rDNA的V3-V4区域并委托中国杭州晶佰生物科技有限公司进行高通量测序。引物由中国上海桑尼生物科技有限公司合成,引物序列:F-5′-CCTACGGGNGGCWGCAG-3′,R-5′-GACTACHVGGGTATCTAATCC-3′。数据处理:(1)稀释曲线分析。对所有样本序列进行随机抽样,以抽取到的序列数与它们所能代表的OTU数目构建稀释曲线,用于说明样本的测序数据是否足以反映菌群的多样性。(2)α多样性分析。测定Chao1指数、PD Whole tree指数等丰度指数,值越大,表明丰度越高;测定Shannon指数、Simpson指数等多样性指标,值越大,表明多样性越高。(3)β多样性分析。进行PCoA主坐标分析。使用QIIME软件制作PCoA图表,选取贡献率最大的主坐标组合进行作图,通过测定坐标轴中各样本间距离分析菌群差异性。距离越近,表示菌群差异性较小,相反则差异性较大。(4)菌群组成分析。根据OTU分析结果,得到各样品在各分类水平上(门、属)的物种组成比例。(5)组间菌群差异分析。进行物种LEfSe差异分析,以线性判别分析(linear discriminant analysis,LDA)效应量来估算每个物种丰度对差异效果影响的大小。
1.2.7 单个核细胞分离与免疫细胞Tregs检测 (1)单个核细胞分离:采用密度梯度离心法,取新鲜肝参考文献[5]方法分离肝脏单个核细胞。将肠系膜淋巴结研磨后过滤,离心(4 ℃,1 500 r/min,5 min)弃上清液,IMDM培养基重悬,分离得到肠系膜淋巴结(mesenteric lymph nodes,MLNs)单个核细胞悬液。(2)免疫细胞Tregs检测:采用流式细胞术。根据牛鲍计数板细胞计数结果,按1×106个/孔的细胞数在96孔尖底板中铺板,弃上清液后染色;用流式染色缓冲液按1∶400配制流式荧光抗体(CD4-AF488、CD8-PE/Cy7、Live/Dead),50 μl/孔加至尖底板,避光染色20 min;加入200 μl/孔流式染色缓冲液终止染色,并用200 μl/孔流式染色缓冲液重复洗涤2次,用100 μl固定/通透液重悬,4℃避光破膜过夜;加入200 μl 1×eBioscience Perm/Wash™洗涤缓冲液终止,并重复洗涤2次;用洗涤缓冲液按1∶200配制流式荧光抗体(FoxP3-PE),50 μl/孔加至尖底板,冰上避光染色2 h,再重复洗涤2次。重悬后流式细胞仪检测。
1.3 统计学处理 采用Graphpad Prism 7.0进行图形制作和分析。流式数据通过BD FACS AriaⅡ流式细胞仪采集,采用Flowjo V10软件分析。符合正态分布的计量资料以表示,采用单因素方差分析(One-Way ANOVA);不符合正态分布的以M(P25,P75)表示,采用非参数检验(Kruskal-Wallis)法进行多重比较。P<0.05为差异有统计学意义。
2 结果
2.1 小鼠肝脏外观及组织病理学观察 与其他3组肝脏相比,PtenCKO HFD组小鼠肝脏体积明显增大,边缘厚且钝,颗粒粗糙,表面和切面有油腻感,色泽黄白色(图1a,见插页)。与正常饮食组相比,高脂饮食组小鼠肝湿质量显著增加(P<0.05)(图1b,见插页),PtenCKO HFD组肝重指数高于其他3组,差异均有统计学意义(均P<0.05)(图1c,见插页)。病理染色显示:高脂饮食组小鼠肝脏脂肪变的程度和炎性浸润程度均较正常饮食组增加,其中PtenCKO HFD组可见弥漫性、大颗粒状红色脂滴堆积,且部分融合呈片状,汇管区清晰可见炎性细胞浸润(图1d,见插页)。这些结果表明:高脂饮食明显加快了PtenCKO小鼠肝损伤病程。

图1 不同饮食对小鼠肝脏组织病理的影响(a:肝脏外观;b:肝湿质量;c:肝重指数;d:肝组织HE及油红O染色,×20)
2.2 4组小鼠肠黏膜组织病理观察及肠黏膜通透性指标变化的分析 病理染色显示:正常饮食组中,WT NCD组小肠黏膜结构完整,绒毛表面细胞排列整齐、紧密,无充血、水肿改变;PtenCKO NCD组小肠黏膜结构较为完整,但微绒毛表面细胞排列混乱,并伴有充血、水肿现象。高脂饮食组小鼠均有不同程度的小肠黏膜水肿,并伴有炎性细胞浸润,微绒毛间隙增宽,部分伴有微绒毛变短、断裂并伴有充血、水肿现象(图2a,见插页)。定量检测发现:与WT NCD组相比,WT HFD组回肠ZO-1和Claudin-1相对表达量均降低,差异有统计学意义(P<0.05),相比其他3组,PtenCKO HFD组ZO-1表达异常增高,差异均有统计学意义(均P<0.05)(图2b,见插页)。与WT NCD组相比,其他3组小鼠D-LA浓度均有不同程度升高,差异均有统计学意义(均P<0.05)(图2c,见插页)。这些结果表明:高脂饮食导致小鼠肠黏膜屏障受损并伴有肠组织炎症。

图2 4组小鼠肠黏膜组织病理及肠黏膜通透性指标的变化(a:小肠组织HE染色,×20;b:紧密连接蛋白相对表达量;c:血浆D-LA浓度)
2.3 小鼠肠道菌群组成及多样性的变化 稀释曲线分析显示:各组小鼠的稀释性曲线逐渐趋向平坦,更多的序列数只会产生少量的OTU,表明本次测序基本能够真实反映样本中的微生物情况(图3a,见插页)。α多样性分析显示:正常饮食组肠道菌群的丰度和多样性均高于高脂饮食组,其中,PtenCKO HFD组小鼠肠道菌群的丰度和多样性均最低(图3b,见插页)。PCoA主坐标分析显示:高脂饮食组的WT和PtenCKO小鼠两组间直线距离较近,菌群构成较为相似;正常饮食组的WT和PtenCKO小鼠两组间直线距离较远,菌群构成存在差异性(图3c,见插页)。物种注释和分析显示:在门分类水平上,各组小鼠主要肠道菌均为拟杆菌门、厚壁菌门、变形菌门,其中拟杆菌门和厚壁菌门是各组小鼠的绝对优势菌门(图3d,见插页)。在属分类水平上,相比WT NCD组,WT HFD组和PtenCKO HFD组Bacteroides属、Alloprevotella属、Alistipes属丰度增高,Barnesiella属、Odoribacter属丰度下降;WT NCD组Akkermansia属丰度高于其他3组(图3e,见插页)。对肠道菌群的LEfSe分析显示:PtenCKO HFD组与WT HFD组菌群构成较为相似,PtenCKO NCD组和WT NCD组小鼠肠道菌群构成不同;高脂饮食主要引起Bacteroides属、Parabacteoides属、Enterococcus属、Enterorhabdus属、Desulfovibrionaceae属、Escherichia属和Escherichia-Shigella属等肠道致病菌和条件致病菌丰度增加,而Lactobacillus属、Butyricicoccus属等肠道有益菌丰度降低(图3f,见插页)。可见,饮食和遗传缺陷对小鼠肠道菌群存在不同程度的影响,高脂饮食对肠道菌群的构成影响更为显著。

图3 不同饮食对小鼠肠道菌群变化的影响(a:稀释曲线图;b:Chao1指数,PD Whole tree指数,Shannon指数,Simpson指数;c:PCoA主坐标分析图;d:门水平;e:属水平;f:LEfSe分析图)
2.4 小鼠肝脏、肠系膜淋巴结免疫细胞Tregs变化分析 经过10周的高脂饮食,与WT NCD组相比,WT HFD组肝脏免疫细胞Tregs下降,但差异无统计学意义(P>0.05);与PtenCKO NCD组相比,PtenCKO HFD组肝脏免疫细胞Tregs上升,差异有统计学意义(P<0.05)。与WT小鼠比较,PtenCKO小鼠肝脏免疫细胞Tregs升高,差异有统计学意义(P<0.05)(图4a,见插页)。与其他3组相比,PtenCKO HFD组肠系膜淋巴结免疫细胞Tregs细胞比例上升,差异均有统计学意义(均P<0.05)(图4b,见插页)。
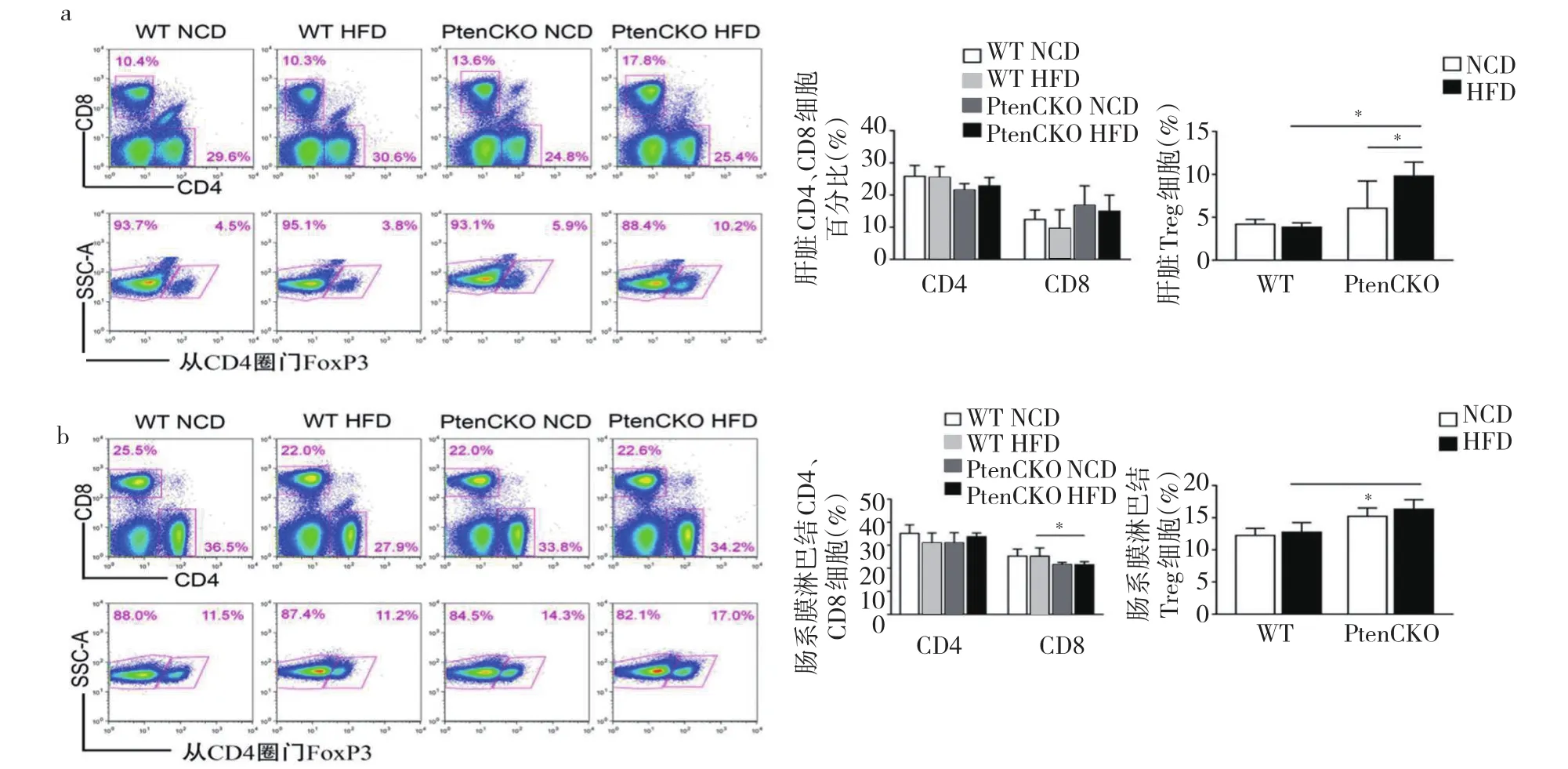
图4 不同饮食对小鼠肝脏和肠系膜淋巴结Tregs细胞变化的影响(a:肝脏Tregs细胞流式图及百分比;b:肠系膜淋巴结Tregs细胞流式图及百分比)
3 讨论
NASH是NAFLD的进行性表现,持续炎症刺激使NASH向肝纤维化发展,是肝硬化及肝癌的重要危险因素,目前尚未出台有效的治疗方案及药物用于治疗NASH[6]。研究显示:患有肥胖相关的脂肪肝人群存在PTEN表达下降的现象[7]。PtenCKO小鼠在遗传和基因表达上都是NASH研究较为理想的实验动物模型[8]。本研究对PtenCKO转基因鼠肝脏进行了病理染色,结果发现:PtenCKO小鼠即使正常饮食也伴有典型的NASH表现,高脂饮食下,NASH症状加重,个别小鼠伴有轻度的纤维化。
NASH的发生、发展与免疫病理、肠道屏障受损及肠道菌群失调等因素密切相关[9]。本研究发现:高脂饮食组的小鼠肠组织发生不同程度的病理改变,D-LA升高,ZO-1、Claudin-1的相对表达量发生变化。Xu等[10]发现:WT小鼠在高脂饮食下,紧密连接蛋白ZO-1、Claudin-1的mRNA下降,提示肠黏膜屏障损伤;与本研究发现的高脂饮食下PtenCKO小鼠紧密连接蛋白ZO-1的mRNA表达水平异常升高的结果不一致,需进一步实验探讨。也有研究显示:ZO-1在肝癌患者中的表达水平较健康人群升高[11],而PtenCKO小鼠最终将自发发展为肝癌[12]。D-LA是肠道细菌的代谢产物,当肠道屏障受损而导致肠黏膜屏障通透性增加时,D-LA活性增高,提示肠道屏障完整性的缺失可能推动了肝脏炎症和NASH病程进展。肠道菌群易受膳食影响。本研究发现:高脂饮食对肠道菌群影响显著,小鼠肠道菌群丰度及多样性均减少。LEfSe分析显示:高脂饮食主要引起Bacteroides属、Parabacteoides属、Enterococcus属、Enterorhabdus属、Desulfovibrionaceae属、Escherichia属和Escherichia-Shigella属等肠道致病菌和条件致病菌丰度增加,而Lactobacillus属、Butyricicoccus属等肠道有益菌丰度降低。与WT小鼠相比,高脂饮食下PtenCKO小鼠Alloprevotella属增加,Odoribacter属降低。研究显示:Prevotellacea 科[13]、Odoribacter属[14]在NASH患者中丰度较低。Alloprevotella属隶属于Prevotellaceae科,Prevotellaceae科主要为琥珀酸产生菌,Odoribacter属主要为琥珀酸消耗菌,均与肠道琥珀酸代谢相关;在体内琥珀酸浓度受肥胖、糖耐量受损等影响,琥珀酸浓度失衡是机体缺氧和炎症下局部应激和免疫危险的代谢信号。此外,肠道内的产短链脂肪酸菌,如产丁酸梭菌属等可以增加和辅助Tregs细胞的归巢和分化,对维持免疫稳态具有重要作用[15]。可见,高脂饮食会降低肠道有益菌丰度,增加有害菌丰度,造成菌群失调,免疫功能紊乱,加剧病程。
PTEN具有维持Tregs细胞稳定的作用。研究显示:PTEN缺失或抑制等情况下,Tregs细胞具有促进脂肪酸氧化磷酸化的作用,FoxP3是维持和控制Tregs发育和功能的主要转录因子之一,可以促使Tregs对脂肪酸的利用,防止脂质毒性[16]。本研究发现:高脂饮食下,PtenCKO小鼠肝损伤严重,病理表型为严重NASH,其肝脏及肠系膜淋巴结Tregs细胞比例较野生型明显升高。与Wang等[17]发现胆碱蛋氨酸缺乏和高脂饲料同时喂食下NASH小鼠肝脏Tregs细胞比例增高的结果一致。WT小鼠因为症状轻微,病理表型为单纯性脂肪变性,肝脏免疫细胞Tregs比例下降,但趋势不明显,这可能与本研究造模时间较短有关。本研究还发现CD8+T细胞百分比在PtenCKO小鼠肝脏和肠系膜淋巴结中趋势变化不一致,尚需进一步实验研究。
综上,本研究综合运用PtenCKO小鼠及高脂造模证实高脂饮食会加重PtenCKO小鼠的肝损伤,肠黏膜屏障受损,免疫细胞Tregs比例失衡及肠道菌群失调,这些因素共同加剧了遗传易感小鼠肝脏炎症反应和NASH病程进展。本研究为进一步阐明NASH炎症发展机制,以及探索潜在的作为NASH病情评估的生物标志物或治疗方法提供了参考依据。
